Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.29 n.2 Caracas dez. 2009
Estructura y ultraestructura de Pythium insidiosum en la pitiosis gastrointestinal canina
Yaritza Josefina Salas Araujo*,a, Victoria del Rosario Colmenaresa, Adelys Antonio Márquez Alvaradob, Juan Jesús Luis-Leónc,d, Olivar Castejóne
a Anatomía Patológica Veterinaria. * Correspondencia: E-mail: ysalas@ucla.edu.ve
b Unidad de Investigación en Ciencias Funcionales Dr. Haity Moussatché. Universidad Centroccidental Lisandro Alvarado. Estado Lara, Venezuela.
c Departamento de Microbiología.
d Instituto de Investigaciones Biomédicas (BIOMED).
e Laboratorio de Microscopia Electrónica de Barrido. Facultad de Ciencias de la Salud. Universidad de Carabobo. Núcleo Aragua. Estado Aragua, Venezuela.
Resumen:
La pitiosis es una enfermedad granulomatosa que se presenta en humanos y en otros mamíferos, causada por Pythium insidiosum, un pseudohongo clasificado en el reino Straminipila. En Venezuela se han diagnosticado casos de pitiosis en perros con diarrea hemorrágica crónica, sin embargo, las características estructurales y ultraestructurales de las lesiones han sido poco estudiadas. Se planteó como objetivo describir, a través de microscopia electrónica de barrido y de transmisión, la estructura y ultraestructura de P. insidiosum y las lesiones que produce en el tracto gastrointestinal de los perros. Se procesaron para microscopia electrónica muestras de tejido procedentes de caninos con diagnóstico de pitiosis gastrointestinal, referidos al Hospital Veterinario de la Universidad Centroccidental Lisandro Alvarado. Las muestras examinadas mostraron tejido necrótico, trombosis vascular y numerosas hifas de P. insidiosum, caracterizadas por ser largas, onduladas, de paredes aplanadas, de 3 a 5 µm de diámetro, ramificadas en ángulo de 90° y externamente rodeadas por un material granular electrón denso en forma de incrustaciones, sugestivo del fenómeno de Splendore-Hoeppli. Se concluyó que la pitiosis en caninos cursa con lesiones granulomatosas y trombóticas, donde se observa que el agente etiológico mantiene su integridad, a pesar de estar íntimamente relacionado con células fagocíticas.
Palabras clave: Pythium insidiosum, pitiosis gastrointestinal, estructura, ultraestructura, perros
Structure and ultrastructure of Pythium insidiosum in canine gastrointestinal pythiosis
Abstract:
Pythiosis is a granulomatous disease that occurs in humans and other mammals, produced by Pythium insidiosum, a pseudofungus classified in the Straminipila kingdom. In Venezuela, pythiosis cases have been diagnosed in dogs with chronic hemorrhagic diarrhea; nevertheless, the structural and ultrastructural characteristics of the lesions have not been studied in depth. The objective set for this study was to describe, through scanning and transmission electron microscopy, the structure and ultrastructure of P. insidiosum, and the lesions it produces in the gastrointestinal tract of dogs. Tissue samples from canines with a gastrointestinal pythiosis diagnosis, referred by the Veterinary Hospital of the Universidad Centroccidental Lisandro Alvarado, were processed for electron microscopy study. The samples examined showed necrotic tissue, vascular thrombosis and numerous P. insidiosum hyphae, characterized by being long, ondulating, with flattened walls, 3 to 5 µm in diameter, ramified in a 90o angle, and externally surrounded by an electron dense granular material in the form of inlays, suggestive of the Splendore-Hoeppli phenomenon. It was concluded that canine pythiosis evolves with granulomatous and thrombotic lesions, which show that the etiologic agent maintains its integrity, in spite of being intimately related with phagocytic cells.
Keywords: Pythium insidiosum, gastrointestinal pythiosis, structure, ultrastructure, dogs
Recibido 28 de agosto de 2009; aceptado 3 de diciembre de 2009
Introducción
La pitiosis es una enfermedad granulomatosa crónica que afecta a humanos y a varias especies animales, causada por Pythium insidiosum [1], patógeno presente en regiones de clima tropical, subtropical y templado; ha sido descrita en América, algunos países europeos y en el sureste asiático [2]. Según estudios sobre la clasificación de los hongos, basados en sistemas filogenéticos y moleculares, el agente etiológico de esta patología es un organismo clasificado en el Reino Straminipila, Phylum Oomycota, Clase Oomycetes, Orden Pythiales y Familia Pythiaceae [3]. Las especies del género Pythium habitan en suelos sumamente húmedos y se les considera entre los fitopatógenos más importantes; no obstante, de todas las especies descritas de este género, únicamente P. insidiosum ocasiona enfermedades en mamíferos, las cuáles son conocidas como pitiosis. El microorganismo en referencia se caracteriza por ser acuático y producir zoosporas flageladas móviles, responsables de la migración y diseminación del agente en el medio ambiente; es capaz de invadir los tejidos orgánicos del aparato digestivo y el subcutáneo, así como las arterias [4].
En caninos y felinos la forma de presentación de la enfermedad puede ser cutánea o digestiva. Esta última es la más común y se manifiesta con vómitos, anorexia crónica, pérdida de peso, diarrea (que puede o no ser sanguinolenta) y con presencia de masas nodulares a la palpación abdominal [5]. Se ha reportado que las lesiones gastrointestinales se caracterizan por la formación de grandes masas en la pared del estómago y/o intestino, que microscópicamente presentan inflamación de tipo granulomatosa y piogranulomatosa, con áreas de necrosis e intenso infiltrado celular a predominio de leucocitos polimorfonucleares eosinófilos, así como macrófagos, linfocitos y la presencia de hifas gruesas no septadas [6].
En los humanos la pitiosis ha sido ampliamente reportada y se han observado tres formas de presentación: la subcutánea, la sistémica vascular y la oftálmica. La lesión principal que se observa en la pitiosis humana es una oclusión arterial progresiva y crónica, con el subsiguiente desarrollo de aneurisma y gangrena, en algunas ocasiones con hemorragias arteriales fatales, especialmente en pacientes con hemoglobinopatías [7]. El primer caso en Latinoamérica de pitiosis en humanos fue reportado recientemente en Brasil, en un individuo que presentó una úlcera tibial de 15 centímetros de diámetro, infiltrante y de bordes redondeados, con diagnóstico inicial de celulitis bacteriana. Sin embargo, el estudio histopatológico reveló una dermatitis granulomatosa supurativa con hifas no septadas, observadas con la coloración de metenamina de plata de Gomori, lo que conllevó al diagnóstico inicial de una zigomicosis; finalmente el diagnóstico definitivo de pitiosis se realizó con cultivo microbiológico y ensayos moleculares [8].
Las características morfológicas estructurales y ultraestructurales de las lesiones provocadas por P. insidiosum, basadas en observaciones realizadas a través de microscopia electrónica de transmisión, han sido poco estudiadas. Solo se ha reportado la caracterización morfológica de este microorganismo en biopsias obtenidas de lesiones cutáneas en bovinos. No se ha reportado previamente su caracterización ultraestructural en lesiones gastrointestinales en caninos, por lo que no se dispone de datos importantes que puedan ser utilizados como herramientas complementarias junto a la realización de los métodos diagnósticos, ni estudios que aclaren interrogantes en relación al potencial zoonótico de la pitiosis; tampoco se dispone de información para elaborar medidas de prevención y tratamiento de la enfermedad.
En base a lo anteriormente expuesto, y teniendo en cuenta que existe en Venezuela una marcada frecuencia de diagnóstico compatible con pitiosis en perros con diarrea hemorrágica crónica [9,10], es necesario establecer criterios morfológicos estructurales y ultraestructurales de lesiones gastrointestinales en casos de pitiosis canina, que a su vez contribuyan con la implantación y divulgación de medidas de control sanitario para la prevención de esta enfermedad, tanto en animales como en el hombre. A pesar de que en el país actualmente no se han reportado casos de esta enfermedad en humanos, no se puede descartar la posibilidad de que puedan verse afectados, teniendo en cuenta que la pitiosis humana es causada por el mismo agente etiológico responsable de esta patología en caninos, el cual está presente en el país y representa un riesgo inminente de infección. En tal sentido, en este estudio se planteó como objetivo describir, a través de microscopia electrónica de barrido (MEB) y de transmisión (MET), la estructura y ultraestructura de Pythium insidiosum y las lesiones que produce en el tracto gastrointestinal de los perros afectados.
Materiales y métodos
Se estudiaron aquellos perros referidos al Servicio de Diagnóstico Anatomopatológico, del Área de Patología del Hospital Veterinario del Decanato de Ciencias Veterinarias de la Universidad Centroccidental Lisandro Alvarado (DCV-UCLA), durante el periodo comprendido entre el mes de enero del año 2001 hasta julio del 2007, con diagnóstico de pitiosis gastrointestinal a través de histopatología, histoquímica y cultivo microbiológico. Las muestras de tejido gastrointestinal fueron procesadas para MEB y MET en el Laboratorio de Microscopia Electrónica del Centro de Investigación y Análisis Docente Asistencial del Núcleo Aragua (CIADANA), Facultad de Ciencias de la Salud de la Universidad de Carabobo, según la técnica descrita por Glauert en 1975 [11], modificada y estandarizada en dicho laboratorio.
Para la MEB se realizó el siguiente procedimiento:
Corte del material: El tejido fijado en 2% glutaraldehido – 4% de formaldehído en buffer fosfato, fue cortado en fragmentos de aproximadamente 4x1x1 mm.; posteriormente fue lavado con solución buffer fosfato por 3 veces durante 15 minutos cada uno y luego fue dejado por 10 minutos en agua destilada.
Fijación secundaria: Las muestras de tejido fueron fijadas con solución de tetraóxido de osmio en solución amortiguadora de buffer fosfato a pH 7,4 durante un periodo de 2 horas; luego fueron lavadas con buffer fosfato 3 veces por 15 minutos cada una y finalmente con agua destilada por 10 minutos.
Deshidratación: Las muestras de tejido se sometieron a deshidratación utilizando concentraciones crecientes de etanol (70%, 85%, 95% y 100%) durante 15 minutos en dos sesiones para cada alcohol, seguido por solución fría de etanol:amil acetato, en diluciones 3:1, 1:1 y 1:3 durante 15 minutos cada una, para luego colocar las muestras en amil acetato a 4 ºC por 15 minutos.
Desecación de punto crítico: Las muestras de tejido fueron recubiertas internamente con papel de filtro y colocadas en cestas metálicas dentro de la cámara de desecación de punto crítico con CO2; se utilizó un desecador de punto crítico Hitachi HCP-2 (Nissei Sangyo Co, Ltd, Tokio, Japón).
Montaje de la muestra: En el porta muestra de aluminio se colocó una solución de plata coloidal en forma de pasta sobre la cual descansa la muestra, que fue llevada a la estufa a 42 ºC por 5 minutos, con la finalidad de que la plata también evapore su componente líquido.
Cubrimiento metálico: Las muestras en este paso fueron cubiertas por una fina capa de 100 Aº de platino-paladio bajo un cobertor iónico IB3 (Eiko Co. Ltd., Tokio, Japón).
Una vez finalizado el cubrimiento metálico, las muestras fueron observadas y fotografiadas en toda su extensión utilizando un microscopio electrónico de barrido Hitachi S2300 (Nissei Sangyo Co. Ltd., Tokio, Japón), operando a 10-20kV.
En el caso de la MET se utilizaron muestras de tejido completamente deshidratadas y desecadas mediante el método anteriormente descrito para MEB. Las muestras de tejido fueron cortadas en forma de cono de 1 mm e incluidas en araldita, siguiendo las técnicas convencionales de MET. Para la confección de los bloques de tejido, las muestras se colocaron en los moldes plásticos para inclusión, los cuales fueron llenados con araldita para posteriormente realizar la polimerización de los mismos, en una estufa a 60 ºC durante 48 horas continuas.
Con la finalidad de llevar a cabo la evaluación ultraestructural de las muestras, los bloques de araldita fueron trasladados al Laboratorio de Virología Vegetal, Departamento de Protección Vegetal del Centro Nacional de Investigaciones Agropecuarias (CENIAP), donde se realizaron cortes seriados de 1m, los cuales se tiñeron con azul de toluidina al 0,5% y se analizaron en el microcopio de luz de alta resolución, con la finalidad de evidenciar el nivel en el cual se realizarían los cortes ultrafinos, evaluándose a su vez las características estructurales del tejido. Finalmente, en base a estas observaciones, se procedió a realizar cortes ultrafinos (250 A° - 300 A°) del tejido a ser teñidos con uranilo y citrato de plomo, para finalmente ser evaluados a través del microscopio electrónico de transmisión Hitachi H-500MET.
Resultados y discusión
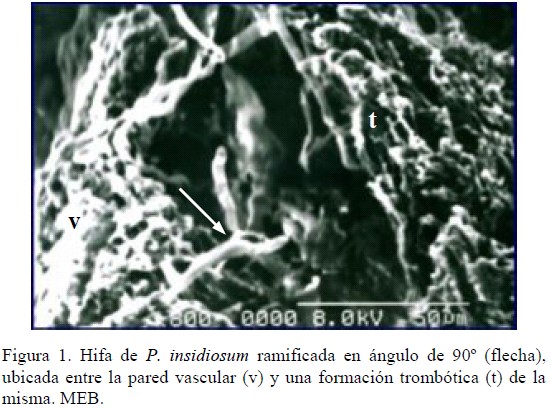
En los diferentes cortes observados a través del MEB y MET se pudo evidenciar tejido necrótico amorfo donde se encontraban inmersas numerosas hifas, caracterizadas morfológicamente por ser tubulares, largas, onduladas y aplanadas, de un diámetro promedio entre 3 a 5 µm, con botones de ramificación y ramificadas en ángulo de 90° (Figura 1). En estudios análogos, con el uso de microscopia de alta resolución a partir de cultivos o en tejidos teñidos con coloraciones argénticas, se han reportado micelios constituidos por numerosas hifas irregulares ocasionalmente septadas, ramificadas, de pared lisa, de 4 a 8 µm de diámetro [12] e hifas prominentes, onduladas, de 4 a 6 µm, con ramificaciones laterales y septos transversos, así como hifas ramificadas y ocasionalmente septadas, de 4 a 15 µm de diámetro [13].
Asimismo, en esta investigación se pudo observar por intermedio de la MEB, estructuras vasculares con formación trombótica, a partir de las cuales sobresalían elementos hifales que se ubicaban entre éstas y la pared vascular (Figura 1). Las lesiones vasculares no han sido ampliamente reportadas en la pitiosis gastrointestinal, sin embargo, Helman y Oliver [14] observaron que la enteritis granulomatosa en la pitiosis canina puede ir acompañada de arteritis y vasculitis necrotizante prominente, acompañada de hifas gruesas, de aproximadamente 5 a 7 µm de diámetro, ocasionalmente septadas e irregularmente ramificadas. Por otra parte, se han reportado numerosos casos que cursaron con isquemia, necrosis e infarto del segmento intestinal afectado por obstrucción vascular, caracterizado microscópicamente por presentar una necrosis difusa y numerosas bacterias saprófitas, vasos sanguíneos congestivos y numerosos neutrófilos y eosinófilos, así como también, hifas ramificadas y tabicadas [15]. Adicionalmente, una de las principales lesiones observadas en casos de pitiosis en humanos, particularmente en aquellos con hemoglobinopatías, ha sido la trombosis con la oclusión arterial progresiva y crónica, que incluso termina en el desarrollo de aneurisma con la consecuente hemorragia arterial fatal o desarrollo de gangrena [7].
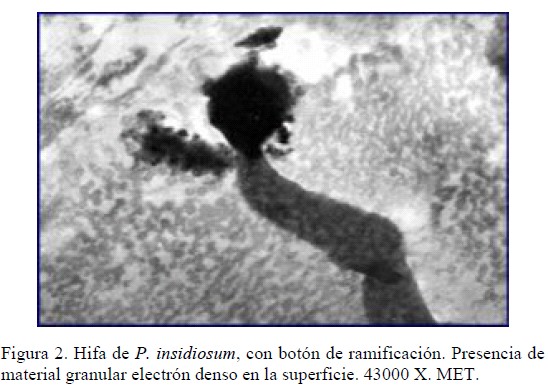
De igual forma, fueron observadas estructuras similares a los botones de ramificación o botones terminales descritos por Grooters [15], quien en cultivo microbiológico los reportó en estadios tempranos de la zoosporogenesis como filamentos no diferenciados de la hifa vegetativa, que se prolongan lateralmente formando el tubo germinativo que posteriormente dará origen a la formación de una vesícula terminal llamada esporangio.
En otro de los cortes ultrafinos, observados mediante MET, se pudo apreciar la pared de las hifas en su superficie externa rodeada por un material electrón denso granular en forma de incrustaciones, sugestivo de complejos antígeno anticuerpo o material proteico, derivado de la desgranulación de neutrófilos y/o eosinófilos (Figura 2). Estas observaciones coinciden con las realizadas por Miller et al., [16] quienes en lesiones cutáneas de bovinos y a través de MET revelaron numerosas hifas de pared densa y de apariencia laminar, electrón densas, revestidas externamente por incrustaciones granulares semejantes al fenómeno de Splendore-Hoeppli asociado a infecciones fúngicas, el cual está constituido por complejos antígeno-anticuerpo y detritus celulares, rodeando íntimamente las hifas. Por otra parte, Santurio et al., [17] también observaron hifas circunscritas por una banda de 0,5 a 3 µm de un material granular con mínimas formaciones incrustadas en algunas zonas. Este reporte representa la primera observación en caninos de dichas incrustaciones electrón densas sugestivas del fenómeno de Splendore-Hoeppli, apoyada en observaciones microscópicas y ultraestructurales, donde las hifas se evidenciaron inmersas en un material necrótico rodeadas por células inflamatorias.
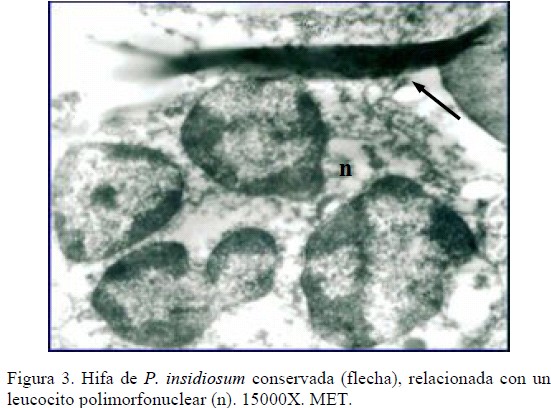
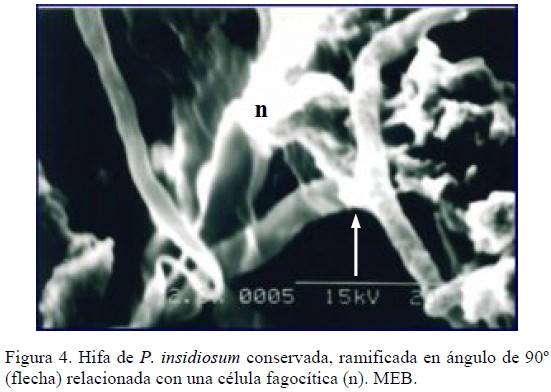
Por otra parte, en uno de los cortes ultrafinos observados con MET se evidenciaron hifas conservadas y relacionadas íntimamente con leucocitos polimorfonucleares (Figura 3), y a través de MEB se observó que éstas células inflamatorias emiten prolongaciones tratando de ingerir los segmentos hifales (Figura 4). En concordancia con lo expuesto, Miller et al., mediante MET evidenciaron, en lesiones cutáneas de bovinos con pitiosis, numerosos neutrófilos cerca de las hifas intentando fagocitarlas. Además, algunas hifas fueron vistas aparentemente viables dentro de células gigantes multinucleadas [16].
En este estudio, el exudado celular inflamatorio que predominantemente rodeó las hifas de P. insidiosum, estaba constituido por leucocitos polimorfonucleares neutrófilos y en menor proporción por eosinófilos, macrófagos y linfocitos, resultados similares a los reportados en bovinos [18]. Resultados diferentes han sido reportados en equinos, donde predominan los eosinófilos, los cuales entre otros factores, dan origen a grandes masas amarillentas y cilíndricas, similares en su presentación a las formaciones coralinas, (los llamados kunkers en inglés), observadas hasta ahora solo en estos animales y que tienen su origen en el acumulo focal de eosinófilos desgranulados alrededor de las hifas [19].
Conclusión
En una visión bidimensional y tridimensional, obtenida a través de las observaciones realizadas con MEB y MET, en lesiones granulomatosas y trombóticas presentes en la pitiosis gastrointestinal canina, se pudo evidenciar que el agente etiológico mantiene su integridad morfológica a pesar de estar íntimamente relacionado con células fagocíticas.
Referencias
1. Trindade Leal A, Monteiro Leal AB, Furtado Flores E, Morais Santurio J. Pitiose. Ciência Rural. 2001; 31: 735-43. [ Links ]
2. Foil C. Update on Pythiosis (Oomycosis). In: International Symposium of Antimicrobial Therapy: Applications in Dermatology. 1996; 57 pp. [ Links ]
3. Trindade Leal A, Morais Santurio J, Monteiro Leal AB, Machado Pinto A, Griebeler J, Furtado Flores E, et al. Resposta sorológica de coelhos imunizados com antígenos de Pythium insidiosum associados a diferentes adyuvantes. Ciência Rural. 2002; 32:1027-32. [ Links ]
4. Mendoza L, Kaufman L, Standard P. Antigenic relationship between the animal and human pathogen Pythium insidiosum and nonpathogenic Pythium species. J Clin Microbiol. 1987; 25: 2159-62. [ Links ]
5. Fischer JR, Pace LW, Turk JR, Kreeger JM, Miller MA, Gosser HS. Gastrointestinal pythiosis in Missouri dogs: eleven cases. J Vet Diagn Invest. 1994; 6: 380-2. [ Links ]
6. Bentinck-Smith J, Padhye AA, Maslin WR, Hamilton C, McDonald RK, Woody BJ. Canine pythiosis-isolation and identification of Pythium insidiosum. J Vet Diagn Invest. 1989; 1: 295-8. [ Links ]
7. Krajaejun T, Sathapatayavongs B, Chaiprasert A, Srimuang S. Do you know human pythiosis?. J Infect Dis Antimicrob Agents. 2008; 25: 45-51. [ Links ]
8. Gimenes Bosco SM, Bagagli E, Pessoa Araújo Jr J, Grisi Candeias JM, de Franco MF, Alencar Marques ME, et al. Human pythiosis, Brazil. Emerg Infect Dis. 2005; 11: 715-8. [ Links ]
9. Capodacqua J. Diseño de un protocolo diagnóstico para alteraciones de aspecto tumoral de vías digestivas en caninos con diarrea hemorrágica crónica. Trabajo de grado. Universidad Centrooccidental Lisandro Alvarado. DCV–UCLA. Cabudare, Venezuela. 2004; 97 p. [ Links ]
10. Mendoza L, Arias M, Colmenares V, Perazzo Y. Intestinal canine pythiosis in Venezuela confirmed by serological and sequencing analysis. Mycopathologia. 2005; 159: 219-22. [ Links ]
11. Glauert M. Fixation, dehydratation and embedding of biological specimens. Practical Methods in Electron Microscopy. North Holland Publishing Company. 1987. [ Links ]
12. Morais Santurio J, Hartz Alves S, Brayer Pereira D, Siqueira Argenta J. Pitiose: uma micose emergente. Acta Scienti Vet. 2006; 34: 1-14. [ Links ]
13. Pavletic MM, Miller RI, Jurnwold GH. Intestinal infarction associated with canine phycomycosis. J Am Anim Hosp Assoc. 1983; 19: 913-9. [ Links ]
14. Helman RG, Oliver 3rd J. Pythiosis of the digestive tract in dogs from Oklahoma. J Am Anim Hosp Assoc. 1999; 35: 81-3. [ Links ]
15. Grooters AM, Leise BS, Lopez MK, Gee MK, O`Reilly KL. Development and evaluation of an enzyme-linked immunosorbent assay for the serodiagnosis of pythiosis in dogs. J Vet Int Med. 2002; 16: 142-6. [ Links ]
16. Miller R, Olcott B, Archer M. Cutaneous pythiosis in beef calves. J Am Vet Med Assoc. 1985; 186: 984-6. [ Links ]
17. Santurio JM, Monteiro AB, Leal AT, Kommers GD, de Sousa RS, Catto JB. Cutaneous pythiosis insidiosi in calves from Pantanal region of Brazil. Mycopathologia. 1998; 141: 123-5. [ Links ]
18. Perez RC, Luis-León JJ, Vivas JL, Mendoza L. Epizootic cutaneous pythiosis in beef calves. Vet Microbiol. 2005; 109:121-8. [ Links ]
19. Miller RI, Campbell RS. Clinical observations on equine phycomycosis. Aust Vet J. 1982; 58: 221-6. [ Links ]












 uBio
uBio