Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.30 n.2 Caracas dez. 2010
Transmisión congénita de Trypanosoma cruzi en crías de ratas Wistar con infección chagásica aguda
Maritza E. Alarcón Mendoza a,*, Glenda Ruiz Rangel a, Ana Lugo de Yarbuh a, Carmen Briceida Guillén a, Elio A. Moreno Balza a, Mary Carmen Pérez Aguilar a, John Cruz b
a Laboratorio de Parasitología Experimental (LAPEX), Facultad de Ciencias.
b Laboratorio de Biología y Medicina Experimental (LABIOMEX), Facultad de Medicina. Universidad de los Andes. Mérida, Venezuela.
* Correspondencia: E-mail: amaritza@ula.ve
Resumen: Se evaluó la transmisión congénita de Trypanosoma cruzi en crías de ratas Wistar con infección aguda. Las ratas fueron inyectadas intraperitonealmente con 1,5x104 tripomastigotes metacíclicos de la cepa I/PAN/VE/00/PLANALTO linaje TcI. La parasitemia fue significativamente mayor (P<0,05) en las ratas infectadas preñadas (IP) que en las ratas infectadas vírgenes (IV). Las crías de las ratas IP a los 15, 30, 45 y 60 días de nacidas (dn) no mostraron tripanosomas circulantes. El ensayo ELISA reveló aumento progresivo de IgM anti-T. cruzi en el suero de 6 crías (24%) de las ratas IP entre los 15 y 60 dn. La IgG anti-T. cruzi disminuyó progresivamente en las crías de ratas IP y fueron negativos a los 60 dn. Cortes de corazón y músculo esquelético del 15% de las crías con 60 dn de las ratas IP mostraron antígeno de T. cruzi con PAP. ADN de T. cruzi fue detectado por PCR en el suero de 4 crías (16%) a los 60 dn de ratas IP. La presencia de anticuerpos IgM anti- T. cruzi y ADN del parásito en las crías de ratas con infección aguda, pueden ser considerados como un criterio de infección congénita en las crías sin parasitemia patente.
Palabras clave: Trypanosoma cruzi, crías de ratas, transmisión congénita, IgM, PCR
Congenital Trypanosoma cruzi transmission in pups of Wistar rats with acute Chagas infection
Abstract: Congenital Trypanosoma cruzi transmission was evaluated in pups of Wistar rats with acute Chagas infection. The rats were injected intraperitoneally with 1.5 x 104 metacyclic tripomastigotes from the I/PAN/VE/00/PLANALTO strain TcI lineage. Parasitemia was significantly higher (P<0.05) in the pregnant infected rats (PI) than in the infected virgin rats (VI). The offspring of the PI rats at 15, 30, 45 and 60 days after birth (ab) did not show circulating trypanosomes. An ELISA test revealed progressive increase of anti-T. cruzi IgM in the serum of pups (24%) of the PI rats between 15 and 60 days. Anti-T. cruzi IgM decreased progressively in the PI pups and became negative at 60 ab. Heart and skeletal muscle sections of 15% of the pups of the PI rats at 60 ab showed T. cruzi antigen with PAP. T. cruzi DNA was detected through PRC in the serum of 4 pups (16%) of PI rats at 60 ab. Presence of anti-T. cruzi IgM and parasite DNA in the pups of rats with acute infection can be considered as a criterion of congenital infection in pups without evident parasitemia.
Keywords: Trypanosoma cruzi, rat pups, congenital transmission, IgM, PCR
Recibido 27 de marzo de 2010; aceptado 20 de octubre de 2010
Introducción
La enfermedad de Chagas es causada por el parásito Trypanosoma cruzi y transmitida a los mamíferos por insectos hematófagos de la subfamilia Triatominae [1]. Esta patología representa la primera causa de lesiones cardíacas en jóvenes y adultos en los países endémicos de América Latina, donde existen de 18 a 20 millones de personas infectadas y 100 millones en riesgo de contraer la infección [2]. En Venezuela, el Ministerio del Poder Popular para la Salud (MPPS) reporta una incidencia de 4% y una prevalencia de 13% de infección en los habitantes del medio rural [3]. La dinámica de la transmisión de la enfermedad de Chagas en el continente americano se ha relacionado con los fenómenos evolutivos y adaptativos que han sufrido los vectores selváticos y peridomiciliarios [4]. Aunque la transmisión vectorial de T. cruzi ha generado elevados casos de la enfermedad, se ha reportado que entre un 2 y 8% de las madres infectadas transmiten el parásito al recién nacido [5].
En la actualidad, la migración de mujeres en edad fértil, desde zonas rurales con alta prevalencia para la enfermedad de Chagas, hacia las grandes ciudades en busca de mejores condiciones de vida, ha convertido a la transmisión con-génita en un serio problema de salud pública en aquellas zonas libres de la infección por T. cruzi [6].
En relación con los recién nacidos infectados, se ha encontrado que no existe un perfil clínico patológico único, por cuanto pueden presentarse tanto casos asintomáticos (60 a 90%) [7], como recién nacidos con sintomatología y con diversas alteraciones clínicas, atribuidas a infecciones precoces o tardías durante la vida fetal intrauterina, a la respuesta inmunológica del recién nacido, a la duración del estímulo antigénico [8] o a la virulencia de la cepa del parásito [9].
Los estudios histopatológicos e inmunohistoquímicos realizados en placentas de mujeres chagásicas, han revelado una amplia diversidad patológica, con presencia de nidos de amastigotes, áreas de necrosis, parásitos en los fibroblastos coriónicos, y en el mesénquima sub-amniótico del sinus marginal e infiltrado inflamatorio en las vellosidades coriónicas, compuesto de macrófagos CD68+, células T y células Natural Killer (NK) [10,11].
En animales experimentales ha sido demostrada la transmisión congénita por T. cruzi [12-14], observándose, la presencia de parásitos en el útero grávido y en el líquido amniótico de ratas Wistar en fase aguda de la infección, así como nidos de amastigotes en el músculo cardíaco de los fetos de ratas [13].
El diagnóstico de la enfermedad de Chagas suele ser complejo, puesto que la identificación parasitológica del agente causal pocas veces puede realizarse en las muestras de pacientes que se encuentran en la fase indeterminada o crónica de la enfermedad con escasa parasitemia [15]
Los estudios inmunológicos suelen ser ensayos o pruebas de diagnóstico muy utilizados, sin embargo, su especificidad es limitada por su reactividad cruzada con anticuerpos de otras enfermedades como la leishmaniasis, presente en las mismas áreas geográficas endémicas que T. cruzi [16]. El diagnóstico pudiera hacerse mediante la detección de anticuerpos específicos de los isotipos IgA e IgM, en los casos con infección en las etapas indeterminadas o crónicas de la enfermedad, en las que el parásito no se encuentra en la circulación sanguínea [15].
La comparación entre varias técnicas de diagnóstico de la infección congénita por T. cruzi, ha mostrado que la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) presenta un alto grado de sensibilidad y especificidad en relación a las técnicas serológicas, más aún cuando la identificación de la infección se realiza en niños recién nacidos infectados con T. cruzi, en los que el parásito no puede ser identificado con las técnicas de diagnóstico tradicionales: examen sanguíneo y xenodiagnóstico [17].
En este trabajo, se evaluó la transmisión congénita de T. cruzi en crías nacidas de ratas Wistar con infección aguda mediante estudios parasitológicos, ensayos inmu-noenzimáticos (ELISA), peroxidasa-antiperoxidasa (PAP) y PCR para la amplificación del ADN del parásito.
Materiales y métodos
Cepa de T. cruzi: Se utilizó la cepa I/PAN/VE/00/PLANALTO linaje TcI, aislada de un Panstrongylus geniculatus (Heteroptera, Reduviidae), insecto hematógafo capturado en una vivienda humana.
Animales experimentales: Se utilizaron ninfas de IV estadío de Rhodnius prolixus, procedentes del insectario de cría Herman Lent de la Facultad de Ciencias infectadas experimentalmente con la cepa PLANALTO de T. cruzi y ratas albinas (Rattus norvegicus) hembras cepa Wistar de dos meses y medio de nacidas y con 250 g de peso, procedentes del Bioterio Central de la Universidad de los Andes (BIOULA).
Infección experimental y apareamiento de animales: Un total de 18 ratas Wistar fueron separadas en tres grupos de seis ratas cada uno, identificados como: ratas infectadas preñadas (IP) y los controles ratas infectadas vírgenes (IV) y sanas preñadas (SP). Las ratas de los grupos IP e IV fueron infectadas por inyección intraperitoneal de una suspensión de 1,5x104 tripomastigotes metacíclicos, obtenidos de las deyecciones y orina de R. prolixus.
Para obtener la preñez, a los 12 días posteriores a la infección experimental (pi) a 6 de las ratas infectadas con T. cruzi y a 6 ratas sanas se les determinó el ciclo estral, revisando una muestra del contenido vaginal coloreado con azul de metileno. La presencia de células nucleadas cornificadas y epiteliales en el moco vaginal, dio evidencia de la condición de proestrus o estrus del ciclo estral [18]. Luego, fueron colocadas 2 ratas hembras con 1 macho por jaula durante tres días a fin de permitir el apareamiento, al cabo de este tiempo se verificó la presencia de espermatozoides en el fluido vaginal y se les hizo seguimiento para verificar la preñez. Los animales fueron mantenidos en el bioterio experimental en condiciones controladas de temperatura, humedad relativa (54%) y alimentadas con Ratarina® comercial y agua ad libitum. A los 21 días del apareamiento las ratas infectadas parieron 25 crías y las ratas SP parieron 30 crías. Ambos grupos de ratas se dejaron junto a sus madres hasta el día 21 en el cual las crías fueron destetadas.
Obtención y procesamiento de las muestras. La parasitemia patente (PP) fue estimada en las ratas IP entre los 12 y 34 días pi, a los 6, 12 y 20 días de preñadas y en las ratas IV a los 12; 19; 24 y 34 días pi. El número de parásitos fue estimado en 5 mm3 de sangre obtenida de cada rata ligeramente anestesiada, mediante la ruptura del plexo venoso de la órbita ocular con capilares heparinizados y el número de tripanosomas fue cuantificado en 100 campos microscópicos a 400x.
En las 25 crías de las ratas IP la parasitemia fue estimada a los 15, 30, 45 y 60 días de nacidas (dn). Para tal fin, la sangre de cada cría, ligeramente anestesiada con vapores de cloroformo (J. K. Baker Chemical, C.O), fue obtenida por ruptura del plexo venoso de la órbita ocular con capilares heparinizados, recogida en tubos de microcentrífuga y centrifugada a 3000 rpm durante 45 min. El suero sanguíneo de cada cría fue separado y almacenado a -40 0C hasta su utilización en el diagnóstico serológico y la detección de ADN por PCR. Las crías de las ratas IP y SP fueron sacrificadas a los 60 dn, mediante la aplicación intraperitoneal de una dosis de 40 mg/kg de peso de pentobarbital sódico y, el corazón y fragmentos de músculo esquelético fueron extraídos, lavados con solución salina fisiológica, fijados en formalina neutra al 10% por 48 h y deshidratados mediante pasos sucesivos por alcohol isopropílico a gradientes crecientes de concentración de 70%, 80%, 90% y 100% una hora cada uno, alcohol-acetona 1:1, acetona pura, acetona-xilol 1:1, una hora cada pase y en xilol puro por dos horas. Las muestras se colocaron en una estufa toda la noche en una mezcla de xilol- paraplast 1:1, se impregnaron con parafina pura (Paraplast® plus tissue embedding médium OXFORD) a 56ºC por 72 h y se incluyeron en parafina. Cortes de 7µm de cada tejido fueron usados en el estudio inmunohistoquímico con PAP.
El manejo de los animales experimentales se llevó a cabo siguiendo las recomendaciones del Comité de Bioética y Seguridad del FONACIT capítulo 2 [19].
Determinación de anticuerpos anti-T. cruzi: La presencia de anticuerpos IgM e IgG específicos de T. cruzi fue determinado en el suero de las crías de ratas IP, mediante el ensayo inmunoenzimático ELISA [20]. El extracto antigénico de formas de cultivo de T. cruzi fue colocado en la superficie interna de los pozos de cada microplaca (Nunc Brand Products), luego un volumen de 100 µL de cada muestra de suero diluida de 1:50 a 1:4000 fue colocada en cada uno de los pozos de las microplacas, seguida de incubación con el anticuerpos IgM o IgG específicos conjugado con peroxidada (Sigma, St. Luis, USA), diluidos 1:4000 e incubados 2h a temperatura ambiente. Posteriormente, los pozos fueron lavados con PBS a pH 7,2 y se incubó la microplaca con 3´3-tetramethylbenzidine por 10 min. La reacción fue detenida con ácido sulfúrico 1N. La absorbancia de cada placa fue medida a 450 nm usando un lector de placas (Microwell System). La densidad óptica promedio (DO) de los sueros controles negativos y de sueros positivos que contenían IgM o IgG específico anti-T. cruzi fueron calculados. Los resultados fueron expresados como DO con un cut-off de 0,040 DO.
Reacción de peroxidasa-anti-peroxidasa (PAP). Los cortes del corazón y músculo esquelético de las crías de las ratas IP y SP fueron desparafinados, hidratados e incubados con peróxido de hidrógeno (Merck) al 3% en metanol (Sigma, St. Luis, USA) por 45 min, lavados con PBS a pH 7,2 e incubados por 30 min con suero normal de cabra al 30% diluido en PBS a pH 7,2. Posteriormente, se lavaron con PBS y se incubaron con suero de conejo anti-T. cruzi diluido 1:100 en PBS 1 h y con suero de conejo anti-IgG conjugado con peroxidada (Sigma, St. Luis, USA) diluido 1:500 por 45 min, se revelaron con 3,3´diaminobenzidina-urea (Sigma, St. Luis, USA), se lavaron con PBS, se contra colorearon con hematoxilina de Mayer (Sigma, St. Luis, USA), y se cubrieron con el medio de montaje Mar-TEX (Macrosearch C.A. Suecia) y laminilla para la observación microscópica [21].
Reacción en cadena de la polimerasa: Para la extracción de ADN 500 µL de suero de las crías nacidas de ratas IP y de ratas SP se mezclaron con buffer de lisis 2X (Tris-HCl 10 mM, pH 7,4, EDTA 5M a pH 8, SDS al 0,5%) y 10 µL de proteinasa K (New England BioLabs,) a 20 mg/mL y se incubaron a 56°C por 12 h. Luego de la inactivación de la proteinasa K, el ADN en el suero de las crías fue obtenido empleando la técnica de extracción con fenol (Prolabo): cloroformo (J. K. Baker Chemical), y precipitación con etanol absoluto (J. K. Baker Chemical) [22].
Una vez extraído el ADN, se amplificó un fragmento de 130 pb de la región del espaciador intergénico del ARN ribosomal de T. cruzi [23]. La prueba fue realizada en un volumen final de 50 μL que contenía 250 ng de ADN, 0,5 µL de cada uno de los nucleótidos (New England BioLabs), 0,2 µM de los iniciadores TCPM1: 5`-GGG AGA GGT TCC AGA TGT- 3` y TCPM2: 5`-GTC GGA GCA GGG ACA GCA-3´, 5 U de Taq polimerasa (Invitrogen), 5 µL de tampón de PCR (BioLabs New England), 10X y 2,5 mM de MgCl2 (J. K. Baker Chemical). La mezcla de reacción se sometió a amplificación en un termociclador (PTC-100 Programmable Termal Controller) mediante los siguientes ciclos: 1 ciclo de 5 minutos a 94°C, 30 ciclos de 1 minuto a 53°C, 1 min a 72°C, 1 min a 94°C, (correspondientes a las fases de desnaturalización, hibridización y extensión de los iniciadores), y por último un ciclo de 10 min a 72°C. Los productos de la PCR se separaron en un gel de agarosa al 2% (Sigma, St. Luis, USA) y una vez realizada la corrida electroforética, el gel fue teñido con bromuro de etidio (Sigma, St. Luis, USA) y colocado en un analizador digital de geles (UVP, USA) para la visualización de las bandas específicas. Se consideraron positivas, las muestras que presentaron bandas de amplificación de 130 pb [23]. El control positivo consistió de ADN extraído de epimastigotes de T. cruzi de la cepa PLANALTO y como control negativo se utilizó una solución con los reactivos utilizados donde el ADN fue reemplazado por agua destilada.
Análisis estadístico: El análisis de los valores promedios de las parasitemias patentes (tripanosomas/mm3 de sangre) en las ratas IP y la comparación entre los títulos de anticuerpos específicos IgM e IgG anti-T. cruzi en el suero de las crías fue realizado usando el programa GraphPad Prism 4. Se fijó un nivel de significancia de 0,05.
Resultados
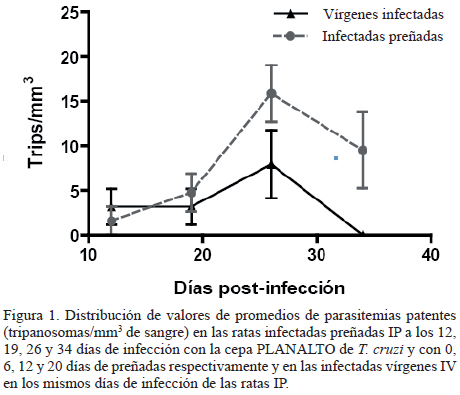
Evaluación de la parasitemia patente: Los niveles promedio de parasitemias patentes en las ratas IP fueron de 1,58; 4,75; 15,85 y 9,51 tripomastigotes/mm3 de sangre a los 12, 19, 26 y 34 días pi y con 0; 6; 12 y 20 días de preñadas respectivamente. En las ratas IV las parasitemias fueron de 3,8; 3,8; 9,5 y 0,0 tripomastigotes/mm3 de sangre en los mismos días pi que las ratas IP, observándose que en las ratas infectadas gestantes los niveles de parasitemia fueron significativamente mayores a los 26 y 34 días pi y 12 y 20 días de gestación, en relación con la observada en las ratas IV. La comparación de la evolución de la parasitemia entre las ratas IP e IV con T. cruzi, revelaron diferencias altamente significativas (p<0,005) a partir de la segunda semana de gestación. (Figura 1). En las muestras de sangre de las crías examinadas desde los 15 hasta los 60 dn no se observaron tripanosomas circulantes en sangre periférica.
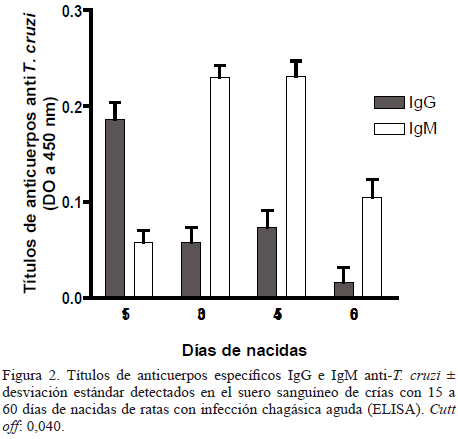
IgM específico anti-T. cruzi: Los anticuerpos IgM específicos de T. cruzi en el suero fueron detectados en 6 crías (24%) de las ratas IP entre los 15 y 60 dn, con incremento progresivo y valores máximos de DO a los 45 dn, lo cual indica la producción de este isotipo de anticuerpo por las crías (Figura 2).
IgG específico anti-T. cruzi: Las DO de los anticuerpos IgG anti-T. cruzi disminuyeron en forma progresiva y resultaron negativas en las crías a los 60 dn de las ratas IP. La comparación entre los valores de las DO de los isotipos IgM e IgG en los sueros de las crías de las ratas IP en los diferentes tiempos de muestreo, reveló diferencias significativas (p<0,005) (Figura 2). Los anticuerpos IgM e IgG específicos no fueron detectados en las muestras de sueros de las 15 crías de las ratas RS.
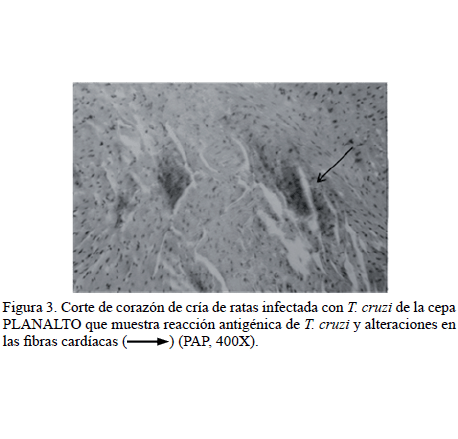
Estudio inmunohistoquímico: La inmunotinción con PAP de los tejidos miocárdico y esquelético de las crías de las ratas IP, reveló lesiones moderadas con infiltrados inflamatorios focales en el corazón y músculo esquelético del 75% de las crías. En 3 crías (15%) nacidas de las ratas IP se observó antígeno de T. cruzi en esos tejidos (Figura 3).
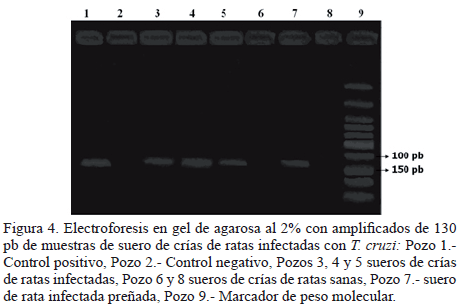
Estudio molecular: La técnica de PCR en las muestras de suero obtenidas de 4 crías (16%) entre los 15 y 60 dn de las ratas IP, confirmó la presencia de ADN de T. cruzi (Figura 4).
Discusión
La infección congénita ocurre por el paso de T. cruzi al feto a través de la placenta y se encuentra asociada a la parasitemia patente maternal. Aunque se interrumpiera totalmente la transmisión vectorial, la infección congénita continuaría siendo un problema de salud pública hasta que las mujeres infectadas por esta vía y en edad fértil disminuyan proporcionalmente, razón por la cual seguirán apareciendo casos con enfermedad de Chagas congénito muchos años después del control vectorial [14]. En este sentido, el seguimiento de madres en edad fértil es de gran importancia para conocer la casuística de la enfermedad de Chagas en áreas endémicas y no endémicas para esta parasitosis [5]. Igualmente es importante señalar que la reagudización de la infección por T. cruzi por efecto del embarazo, como consecuencia de la supresión transitoria de la inmunidad mediada por células para prevenir el rechazo del feto por la madre [24,25]; produce incremento de la IgM maternal y fetal [26-28].
De todas las formas clínicas de la enfermedad de Chagas, la congénita es la que demanda un diagnóstico rápido y de alta sensibilidad para identificar T. cruzi en los recién nacidos, en los cuales no es posible la detección mediante los métodos directos convencionales menos sensibles. Los anticuerpos IgM anti-T. cruzi no siempre son detectables en el recién nacido, debido a que la infección es muy reciente, o la transmisión ocurrió al inicio del embarazo, o porque existe un exceso de IgG materna que suprime la síntesis fetal de IgM específica [29].
Las técnicas serológicas permiten, tanto estimar los niveles de infección por T. cruzi al confirmar su presencia (por un largo período de tiempo, de IgG específica en niños nacidos de madres chagásicas), como evaluar las medidas de control epidemiológico y vectorial [30,31]. Sin embargo, la probabilidad de obtener falsos positivos, producto de reacciones cruzadas con anticuerpos de individuos que padecen otras enfermedades parasitarias, ha llevado a la OMS recomendar el uso de por lo menos dos técnicas serológicas con fundamentos metodológicos diferentes [32].
La técnica ELISA ha sido utilizada tanto para detectar IgM como IgG específicos en los recién nacidos, como para distinguir entre infecciones congénitas y anticuerpos transferidos por la madre [15]. Aun cuando el sistema inmune fetal es considerado inmaduro, se ha demostrado que los fetos infectados por T. cruzi, son capaces de desarrollar una respuesta inmune linfocitaria específica que reconoce otros tipos de antígenos [24]. En este estudio en el modelo murino el uso de la técnica ELISA permitió detectar la presencia de IgM anti-T. cruzi en el suero de 6 crías (24%) nacidas de ratas con infección aguda, condición que confirma la producción de IgM por las crías y por tanto la infección congénita, ya que se ha demostrado que este tipo de anticuerpo no cruza la placenta [9].
De igual forma, la detección de antígenos anti-T. cruzi detectados por PAP en cortes de músculo cardíaco de 3 crías, indicó que su presencia podría ser consecuencia de la ruptura de células inflamatorias que median la lisis de células infectadas con T. cruzi, promoviendo su liberación [11,12]. La presencia de los restos antigénicos constituye una evidencia de T. cruzi en los tejidos de las crías analizadas y posiblemente se relacionen con la activación del complemento por parte de los parásitos durante el período de gestación [33].
La técnica de PCR ha sido utilizada en diversas infecciones parasitarias producidas por protozoarios y en cuanto a T. cruzi, ha sido considerada la mejor prueba para el diagnóstico de la infección congénita, al amplificar pequeñas cantidades de ADN parasitario presente en las muestras de nacidos de madres con elevadas parasitemias [12,14]. En este estudio, usando la PCR, detectamos DNA de T. cruzi en muestras de sueros colectados de 4 (16%) crías de ratas IP, en las cuales también se observó la presencia de IgM específico. Estos resultados señalan que la detección de IgM y de ADN del parásito en las muestras de suero de crías de ratas con infección chagásica, es indicativo de infección congénita por T. cruzi.
En este sentido, la metodología de detección de genes y secuencias específicas ha sido perfeccionada con el desarrollo de diferentes sistemas de PCR en tiempo real, un abordaje cuantitativo automatizado basado en el empleo de sondas fluorogénicas (TaqMan) o colorantes fluorescentes con afinidad por la molécula de ADN (SYBR Green), para medir en tiempo real la reacción de amplificación [34,35]. Esta metodología de alto impacto posee un elevado grado de sensibilidad, mas no permite discriminar la fase reciente o tardía de la infección, por lo tanto la aplicación de la metodología molecular y de métodos serológicos en las muestras de las crías de madres IP utilizados en este estudio, así como la metodología de PCR en tiempo real, son ampliamente recomendables para el diagnóstico de la transmisión congénita por T. cruzi. La combinación de las técnicas serológicas y moleculares de alto impacto y elevado grado de sensibilidad que ha contribuido tanto en la demostración de la carga parasitaria de pacientes chagásicos, como en el monitoreo de las parasitemias en respuesta a la quimioterapia específica anti-T. cruzi, las cuales podrían ser aplicadas en el diagnóstico de mujeres chagásicas durante el período de gestación y en el monitoreo de sus hijos desde el momento del nacimiento.
Conclusiones y recomendaciones
El diagnóstico serológico de T. cruzi en recién nacidos de madres con enfermedad de Chagas, tiene un bajo valor predictivo positivo debido a que la presencia de anticuerpos IgG anti-T. cruzi en la mayoría de los recién nacidos se debe a la transferencia pasiva de anticuerpos IgG de la madre al feto; sin embargo, la detección de anticuerpos específicos IgM anti-T. cruzi en el suero de crías nacidas de ratas IP es una evidencia concluyente de una infección por T. cruzi.
Ese hecho soporta la necesidad de centralizar esfuerzos para estandarizar protocolos tanto serológicos como de PCR convencional y en tiempo real, los cuales probablemente serán base para el establecimiento de criterios confiables para la detección de casos congénitos de enfermedad de Chagas. Aunque la transmisión vectorial de T. cruzi ha generado gran cantidad de casos con enfermedad de Chagas, existe consenso acerca de que, aún cuando se interrumpiera la transmisión vectorial, la transmisión congénita de la infección chagásica continuará siendo un problema de salud pública.
Finalmente se recomienda la detección de IgM específica y de ADN de T. cruzi, en muestras de suero de recién nacidos de madres con infección chagásica aguda, ya que permiten diagnosticar casos de enfermedad de Chagas congénita. Sin embargo, es necesario continuar desarrollando métodos sencillos y específicos que permitan un diagnóstico rápido y seguro de la infección por T. cruzi en el recién nacido.
Agradecimientos
Al Consejo de Desarrollo Científico, Tecnológico y Humanístico de la Universidad de los Andes (CDCHT) Proyecto: C-1488-07-03-C.
Referencias
1. Aché A. Programa de control de la enfermedad de Chagas en Venezuela. Bol Dir Malariol y Saneam Amb. 1993; 33:11-22. [ Links ]
2. Moncayo A. Chagas disease: current epidemiological trends after the interruption of vectorial and transfusional transmission in the southern one country. Mem Inst Oswaldo Cruz. 2003; 98:577-91. [ Links ]
3. Ministerio de Salud y Desarrollo Social. Programa de control de la enfermedad de Chagas. Caracas: Ministerio de Salud y Desarrollo Social; 2000. [ Links ]
4. Valente VC. Potential for domestication of Panstrongylus geniculatus (Latreille, 1811) (Hemiptera,Reduviidae, Triatominae) in the Municipality of Muaná, Marajó Island, State of Pará, Brazil. Mem Inst Oswaldo Cruz. 1999; 94:399-400. [ Links ]
5. Torrico F, Vega A, Suarez E, Rodriguez P, Torrico-Cruz M, Dramaix M, Truyens C, Carlier Y. Maternal Trypanosoma cruzi infection, pregnancy outcome, morbidity and mortality of congenitally infected and non-infected newborns in Bolivia. Am J Trop Med Hyg. 2004; 70:201-9. [ Links ]
6. Mallimaci M, Sijvarger C, Dates A, Álvarez M, Sosa- Estani S. Seroprevalencia de la enfermedad de Chagas en Ushuaia, Argentina, una zona sin triatominos. Rev Panam Salud Pública. 2001; 9:169-71. [ Links ]
7. Sosa S, Segura E. Tratamiento de la infección por Trypanosoma cruzi en fase indeterminada. Experiencia y normatización en la Argentina. Medicina (Buenos Aires). 1999; 59:166-70. [ Links ]
8. Garcia A, Bahamonde M, Verdugo S, Correa J, Pastene C, Solari A, Tassara R, Lorca M. Infección transplacentaria por Trypanosoma cruzi: situación en Chile. Rev Med Chil. 2001; 129:330-2. [ Links ]
9. Blanco S, Segura E, Cura E, Chuit R, Tulian L, Flores I, Garvarino G, Villalonga JF, Gurtler R. Congenital transmission of Trypanosoma cruzi: an operational outline for detecting and treating infected infants in north-western Argentina. Trop Med Int Health. 2000; 5:293-301. [ Links ]
10. Altemani A, Bittencourt A, Lana A. Immunohistochemical characterization of the inflammatory infiltrate in placental Chagas` disease: a qualitative and quantitative analysis. Am J Trop Med Hyg. 2000; 62:319-26. [ Links ]
11. Carlier Y, Torrico F. Congenital infection with Trypanosoma cruzi from mechanism of transmission to strategies for diagnosis and control. Rev Soc Bras Med Trop. 2003; 36:767-71. [ Links ]
12. Moreno E, Araujo M, Alarcón M, Lugo de Yarbuh A, Araujo S, Borges R. Efecto de la infección chagásica aguda en ratas Wistar gestantes. Rev Cient. 2006; 5:506-16. [ Links ]
13. Alarcón M, Lugo de Yarbuh A, Moreno E, Araujo S, Colmenares M. Infección intrauterina de los tejidos fetales en ratas Wistar con infección chagásica aguda. Bol Malariol y Sal Amb. 2006; 46:137-48. [ Links ]
14. Alarcón M, Pérez MC, Villarreal J, Araujo S, Goncalves L, González A, Moreno E, Lugo-Yarbuh A. Detección de ADN de Trypanosoma cruzi en la placenta y fetos de ratones con infección chagásica aguda. Invest Clin. 2009; 50:335-45. [ Links ]
15. Lorca M, Veloso C, Munoz P, Bahamonde M, Garcia A. Diagnostic value of detecting specific IgA and IgM with recombinant Trypanosoma cruzi antigens in congenital Chagas disease. Am J Trop Med Hyg. 1995; 52:512-15. [ Links ]
16. Flores M, Bastrente B, Postigo J, Mendoza N, Cruz I, Izquerra J. Leishmaniasis visceral subclinical en 123 individuos de un cantón de la provincial Caranavi-La Paz. Rev Chil Pediatr. 2004; 75:285-93. [ Links ]
17. Freilij H, Altech J. Congenital Chagas´ disease: diagnostic and clinical aspects. Clin Infect Dis. 1995; 2:551-5. [ Links ]
18. Marcondes F, Bianchi F, Tanno A. Determination of the estrous cycle phases of rats: some helpful considerations. Braz J Biol. 2002; 62: 609-14. [ Links ]
19. Código de Bioética y Boseguridad En: http://www.fonacit.gob.ve/locti/documentos/bioetica2009.pdf. Acceso 12 de agosto de 2010. [ Links ]
20. Voller A, Bidwell D, Bartlett A. Microplate enzyme immunoassays for the immunodiagnosis of virus infections. En Rose NR and Friedman H. eds. Manual of Clinical Immunology. Washington. DC: American Society for Microbiology. 1976. p. 506-12. [ Links ]
21. Sell P, Burton M. Identification of Leishmania amastigotes and their antigens in formalin fixed tissue by immunoperoxidase staining. Trans R Soc Trop Med Hyg. 1981; 75:461-8. [ Links ]
22. Gonzalez N, Galindo I, Guevara P, Novak E, Scorza JV, Añez N, Da Silveira J, Ramirez J. Identification and detection of Trypanosoma cruzi by using a DNA amplification fingerprint obtained from the ribosomal intergenic spacer. J Clin Microbiol. 1994; 32:153-8. [ Links ]
23. Lugo-Yarbuh A, Colasante C. Aspectos patológicos del músculo esquelético debido a la infección experimental con Trypanosoma cruzi. Kasmera. 2000; 28:1-17. [ Links ]
24. Hermann E, Truyens C, Vega C, Even J, Rodriguez P, Berthe A. Congenital transmission of Trypanosoma cruzi is associated with maternal enhanced parasitemia and decreased production of interferon gamma in response to parasite antigens. J Infect Dis. 2004; 189:1274-81. [ Links ]
25. Raghupathy R. Pregnancy: success and failure within the Th1/Th2/Th3 paradigm. Semin Immunol. 2001; 13:219-27. [ Links ]
26. Bittencourt AL. Possible risk factors for vertical transmission of Chagasdisease. Rev Inst Med Trop Sao Paulo 1992; 34:403-8. [ Links ]
27. Sorni P., Bolsi FL. Embarazo y parasitismo por Trypanosoma cruzi. Med (Buenos Aires). 1979; 39:193-7. [ Links ]
28. Moreno E, Méndez M, Alarcón M, Araujo S, Lugo de Yarbuh A. Reactivación de la infección chagásica en ratas Wistar gestantes. Kasmera. 2005; 33:51-63. [ Links ]
29. Reimer C, Black C, Phillips D, Logan L, Hunter E, Pender B, McGrew B. The specificity of foetal IgM: antibody or anti-antibody. Ann New York Acad Sci 1976; 174: 77-93. [ Links ]
30. Basombrío MA, Nasser J, Segura MA. The transmission of Chagas `disease in Salta and the detection of congenital cases. Medicina (Buenos Aires). 1999; 59:143-6. [ Links ]
31. Junqueira ACV, Chiari E, Wincker P. Comparison of the polymerase chain reaction with two classical parasitological methods for the diagnosis of Chagas´ disease in an endemic region of north-eastern Brasil. Trans R Soc Trop Med Hyg. 1996; 90:129-32. [ Links ]
32. Ladzdins J. The southern cone initiative. TDR News WHO. 2001; 65:11. [ Links ]
33. Salomone O, Basquiera A. Trypanosoma cruzi in persons without serologic evidence of disease. Emerg Infect Dis. 2003; 9:1558-62. [ Links ]
34. Cummings KL, Tarleton RL. Rapid quantization of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol. 2003; 129:53-9. [ Links ]
35. Schijman AG, Altech J, Burgos JM, Biancardi M, Bisio M, Levin MJ, Freilij H. A etiological treatment of congenital Chagas´disease diagnosed and monitored by the polymerase chain reaction. J Antimicrob Chemother. 2003; 52:441-9. [ Links ]
36. Aguero F, Verdun RE, Frasch AC, Sanchez DO. A random sequencing approach for the analysis of the Trypanosoma cruzi genome: general structure, large gene and repetitive DNA families, and gene discovery. Genome Res. 2000; 10:1996-2005. [ Links ]
37. Marcon GE, Andrade PD, de Albuquerque DM, Wanderley JS, de Almeida EA, Guariento ME, Costa SC. Use of a nested polymerase chain reaction (N-PCR) to detect Trypanosoma cruzi in blood samples from chronic chagasic patients and patients with doubtful serologist. Diagn Microbiol Infect Dis. 2002; 43:39-43. [ Links ]












 uBio
uBio