Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.30 n.2 Caracas dez. 2010
Purificación de una fracción de antígenos de tripomastigotes de Trypanosoma cruzi para el diagnóstico de la enfermedad de Chagas
Mariolga Berrizbeitia a,b,*, María Figuera c, Tomás Hermoso d, Brian Ward e, Alicia Jorquera f, María de los Ángeles Narváez d, Del Valle Guilarte c, Momar Ndao e
a Postgrado en Biología Aplicada, Núcleo de Sucre, Universidad de Oriente (UDO).
b Instituto de Investigaciones en Biomedicina y Ciencias Aplicadas, UDO.
c Departamento de Bioanálisis, Núcleo de Sucre, UDO.
d Instituto de Medicina tropical, Universidad Central de Venezuela.
e National Reference Centre for Parasitology, Montreal General Hospital, McGill University, Montreal, Québec.
f Centro de Investigaciones en Ciencias de la Salud, Núcleo de Anzoátegui, UDO
* Correspondencia: E-mail: mberriz@yahoo.com
Resumen: Los antígenos excretados/secretados por las formas tripomastigotes de T. cruzi (antígenos TESA) pertenecen a la familia de las transialidasas, las cuales son responsables de la transferencia de ácido siálico exógeno a moléculas aceptadoras en la superficie de los tripomastigotes. En el presente trabajo se purifican varias proteínas de los antígenos TESA utilizando cromatografía de afinidad con resina de sefarosa B4-concanavalina A, con la intención de ser utilizados en el diagnóstico de la enfermedad de Chagas. El buffer de elución contenía una mezcla de α-D-manopiranósido y α-D-glucopiranósido. Se realizó electroforesis unidimensional en gel con poliacrilamida para identificar las bandas purificadas y la prueba de inmunoelectrotransferencia para visualizar las bandas reactivas con el pool de sueros de individuos con infección por T. cruzi. El gel teñido con azul de Coomassie coloidal permitió visualizar 3 bandas de aproximadamente 220, 170, y 20 kDa. La inmunoelectrotransferencia utilizando un pool de sueros positivos, confirmados para la infección por T. cruzi, reveló 5 bandas inmunogénicas de 220, 120, 85, 50 y 32 kDa mientras que el revelado con diaminobenzidina permitió observar las bandas de 220, 120, 85, 50 32 y 20 kDa. Asimismo las bandas purificadas no fueron reconocidas en la inmunoelectrotransferencia por el pool de sueros confirmados como negativos. Estos resultados sugieren el potencial de estas proteínas purificadas de TESA para ser usadas como nueva herramienta para el diagnóstico de la enfermedad de Chagas.
Palabras clave: antígenos TESA, tripomastigotes de T. cruzi, sefarosa B4-concanavalina A, cromatografía de afinidad
Purification of a trypomastigote antigen fraction from Trypanosoma cruzi for Chagas disease diagnosis
Abstract: Trypanosoma cruzi excreted/secreted antigens (TESA) belong to the transialidase family, which are responsible for the transfer of exogenous sialic acid to accepting molecules at the trypomastigote surface. In the present study we purified several proteins from TESA antigens using affinity chromatography with sepharose B4-concanavalin A resin, with the purpose of using them for Chagas disease diagnosis. The elution buffer contained a mixture of α-D-manopiranosid and α-D-glucopiranosid. A unidimensional electrophoresis in polyacrilamide gel to identify the purified bands, and an immunoelectrotransference test with a pool of sera from T. cruzi infected individuals to visualize the reactive bands were carried out. The colloidal Coomassie blue stained gel allowed visualizing 3 bands of approximately 220, 170 and 20 kDa. The immunoelectrotransference using a pool of positive sera with confirmed T. cruzi infection showed 5 immunogenic 220, 120, 50 and 32 kDa bands, while a developing with diaminobenzidine showed 220, 120, 85, 50, 32 and 20 kDa bands. The purified bands were not recognized in an immunoelectrotransference test when a pool of confirmed negative sera was used. These results suggest the potential of these TESA purified proteins for using them as a new tool for Chagas disease diagnosis.
Keywords: TESA antigens, T. cruzi trypomastigotes, sepharose B4-concanavalin A, affinity chromatography
Recibido 20 de noviembre de 2010; aceptado 16 de diciembre de 2010
Introducción
La Organización Mundial de la Salud ha enfatizado la necesidad de emplear antígenos definidos para mejorar el serodiagnóstico de la enfermedad de Chagas. Muchos grupos han utilizado antígenos recombinantes sintéticos y bioquímicamente purificados [1-5]. Para el diagnóstico de esta parasitosis, los antígenos deben cumplir con varios criterios: a) Estar presentes en aislados de T. cruzi provenientes de diferentes áreas endémicas y ausentes en otros agentes infecciosos; b) Ser altamente inmunogénicos en poblaciones con diferentes perfiles genéticos, independientemente de la fase clínica de la enfermedad de Chagas y c) Ser estables y de fácil manipulación para garantizar la reproducibilidad en pruebas de control de calidad [6].
La técnica serológica ideal para el diagnóstico de la enfermedad de Chagas debe ser fácil de realizar, rápida, confiable y poseer una elevada sensibilidad y especificidad. Muchas preparaciones antigénicas se han utilizado para el diagnóstico serológico de esta infección. De estas preparaciones, los antígenos excretados/secretados de las formas tripomastigotes de T. cruzi (antígenos TESA) han demostrado poseer excelente sensibilidad y especificidad para el diagnóstico de esta enfermedad [7-8]. La caracterización de algunas de estas proteínas ha sido descrita, mostrando que muchas son miembros de la familia transialidasa (TS), las cuales se encuentran en la superficie celular de la forma tripomastigote de T. cruzi [9]. Las TS son glicoproteínas abundantes en mucina altamente glicosilada, con azúcares unidos a residuos de serina y tirosina; éstas catalizan la transferencia del ácido siálico desde las células hospederas glicoconjugadas hasta las moléculas de mucina localizadas sobre la membrana de la superficie del parásito [10-11].
Se ha demostrado que las TS y el ácido-siálico participan en las interacciones parásito- hospedero y median las etapas iniciales de la invasión de los tripomastigotes en las células hospederas [10]. La TS posee una región N-terminal donde radica un dominio catalítico y una región C-terminal, ambas regiones estimulan la respuesta celular de los linfocitos B en pacientes con la enfermedad de Chagas en fase aguda y crónica [12]. La región C-terminal es altamente inmunogénica y la mayor parte de la respuesta inmune contra el parásito durante la fase aguda de la infección con T. cruzi se restringe a este dominio, lo que resulta en la producción de anticuerpos contra antígenos en la fase aguda [10].
Debido a la alta inmunogencidad de las proteínas TESA, diversos trabajos han demostrado que son excelentes para el diagnóstico de la enfermedad de Chagas, habiendo sido utilizadas en diferentes formatos como ELISA y Western Blot [7-9, 13-15]. La sensibilidad reportada en trabajos previos es del 100%, sin embargo, se ha demostrado que estos antígenos en el formato de ELISA presentan problemas con la especificidad, principalmente con sueros provenientes de individuos con leishmaniasis [7, 15]. El presente trabajo tiene la finalidad de continuar con la ampliación de los conocimientos acerca de las proteínas TESA y su potencial como antígenos de diagnóstico; se estableció como objetivo la purificación de los antígenos TESA de T. cruzi (cepa Tulahuen) por cromatografía de afinidad, utilizando una columna de sefarosa B4-concanavalina A, como un método alternativo de purificación no descrito anteriormente para estos antígenos. Asimismo, se quiso demostrar la utilidad de estas proteínas purificadas como futuras herramientas en el inmunodiagnóstico de la enfermedad de Chagas.
Materiales y métodos
Antígenos TESA de T. cruzi: Una preparación de antígenos totales de TESA (cepa Tulahuen), para la realización de la presente investigación, fue donada por el National Reference Centre for Parasitology, McGill University (Canadá).
Muestras de suero utilizadas en el estudio: Para evaluar la reactividad antigénica de las proteínas purificadas de TESA por cromatografía de afinidad en la prueba de inmunoelectrotransferencia, se incluyó un pool de sueros (n=50) de referencia confirmados como positivos para la infección por T. cruzi por tres técnicas serológicas diferentes (ELISA, inmunofluorescencia indirecta y hemaglutinación indirecta). Igualmente, se utilizó un pool de sueros provenientes de individuos sanos (n=50), confirmados como seronegativos por las mismas pruebas serológicas mencionadas previamente. Todos los sueros fueron donados por el Laboratorio de Referencia Nacional de Diagnóstico de Chagas (Maracay, estado Aragua, Venezuela).
Purificación de los antígenos TESA por cromatografía de afinidad usando una resina de sefarosa B4-concanavalina A: Se siguió el protocolo descrito por el inserto de la casa comercial (Amersham Biosciences, Piscataway, NJ). Se tomaron 1,50 mL de resina de sefarosa B4-concanavalina A y se lavaron en un tubo estéril (15 mL) con 10 volúmenes de agua destilada y luego con 30 volúmenes del buffer de cromatografía (20 mM Tris-HCl; 0,50 M NaCl; 1 mM MgCl2; mM CaCl2; pH 7,4). Posteriormente, la resina fue empaquetada en una columna de 5 cm de alto y 1 cm de diámetro. Los antígenos TESA a purificar se diluyeron 1:1 v/v con el buffer de cromatografía y se pasaron 3 veces por la resina. Finalmente, se lavó la resina nuevamente con 10 volúmenes del buffer de cromatografía para eliminar las proteínas no enlazadas a ésta. Para la elución de la proteína fijada a la resina se utilizaron 5 volúmenes de una mezcla de 0,30 M de metil-a-D-manopiranósido y metil-a-D-glucopiranósido en el buffer de cromatografía. La elución se llevó a cabo mediante un cromatógrafo Biologic Dou Flow (Biorad®, Hércules). Se recolectaron fracciones de 1 mL. La concentración de las proteínas purificadas fue determinada por el método de Bradford [16].
Electroforesis de las proteínas purificadas de TESA: La electroforesis en gel de poliacrilamida (SDS-PAGE), se utilizó para dar seguimiento al proceso de purificación de las proteínas, mediante la determinación de los patrones de bandas de polipéptidos en las distintas fracciones obtenidas en la separación cromatográfica. Para ello, se realizó el análisis electroforético unidimensional de las diferentes fracciones obtenidas, en base al método descrito por Laemmli [17]. La separación electroforética se llevó a cabo en geles de 7,5% y 10% de poliacrilamida de un espesor de 0.8 mm, preparados en el laboratorio según el protocolo descrito en el manual de Mini Protean 3® (BioRad®, Hércules). La electroforesis se llevó a cabo por 1 h en buffer de corrida (25 mM Tris, 192 mM glicina, 0.1% SDS, pH 8,3) a un voltaje constante de 100 V, utilizando marcadores preteñidos de amplio rango de peso molecular (BioRad®), en cada corrida electroforética, para estimar el peso de las bandas. Para la visualización de las proteínas de TESA purificadas se tiñeron los geles con azul de Coomassie coloidal siguiendo el protocolo descrito por Neuhoff et al. [18]. Posteriormente los geles fueron sumergidos en una solución de ácido acético 10% y glicerol 5% para su conservación.
Inmunodetección antigénica de las proteínas purificadas de TESA: Mediante un ensayo de inmunoelectrotransferencia, se analizó la capacidad de las proteínas de TESA purificadas por cromatografía de afinidad de ser reconocidas por un pool de sueros de individuos con infección por T. cruzi (control positivo). Se concentraron (10 veces) las proteínas purificadas de TESA empleando un equipo concentrador Speedvac SC210A (Savant) con bomba de vacío UVS400 Universal (Vacuum System). Se valoraron las proteínas separadas por electroforesis utilizando las técnicas de electrotransferencia e inmunodetección de acuerdo al método descrito por Towbin et al. [19]. Las proteínas separadas previamente por electroforesis se transfirieron a membranas de nitrocelulosa. La transferencia se realizó por una hora a 4ºC en 25 mM Tris, 192 mM glicina y 20% v/v metanol (pH 8,3), a una corriente constante de 0.25 A, según el protocolo descrito en el manual de Mini TransBlot® (BioRad®). Las membranas fueron bloqueadas durante toda la noche, a 4ºC en PBS pH 7,4 conteniendo 5% de leche descremada (Carnation, Nestle) y 0,1% de Tween 20 (solución bloqueadora-PBST). Posteriormente, las membranas se incubaron con un pool de sueros controles positivos y negativos para la infección por T. cruzi (titulo 1:400) en PBST durante 2 h a temperatura ambiente. Transcurrido este tiempo, las membranas se lavaron en PBST 4 veces por 5 min cada vez e incubaron por 2 horas con anticuerpo de cabra anti-IgG humano conjugado con peroxidasa de rábano (Perkin-Elmer Life Science, Boston, MA), en una dilución 1:4000 (para el revelado con diaminobencidina y 1:2000 (para el revelado con luminol), en la solución bloqueadora PBST. Se repitieron los cuatro lavados con PBST y los inmunocomplejos fueron revelados utilizando diaminobenzidina (Sigma, USA) y luminol (West Pico Chemiluminescent supersignal, Thermo, USA). Los resultados de quimioluminiscencia fueron analizados y leídos en un equipo de imagen molecular Chemidoc XRS system (BioRad®).
Resultados
Purificación de las proteínas de TESA por cromatografía de afinidad con resina de sefarosa B4-concanavalina A: Se midió la absorbancia de las proteínas totales de TESA antes (0, 846 DO) y después (0,246 DO) de pasar las proteínas de TESA 3 veces por la resina. Los resultados indican que el 71% de las proteínas de TESA se unieron a la resina de sefarosa B4-concanavalina A. Asimismo, la concentración de los antígenos TESA, antes de ser sometidos al proceso de purificación, fue de 319,62 µg/mL. Luego del proceso de purificación utilizando la resina de sefarosa B4-concanavalina A el rendimiento proteico disminuyó considerablemente (1,22 µg/mL). Se eluyeron un total de 6 fracciones (1 mL cada tubo). Las proteínas eluidas fueron estables a -80°C por un período de 5 meses.
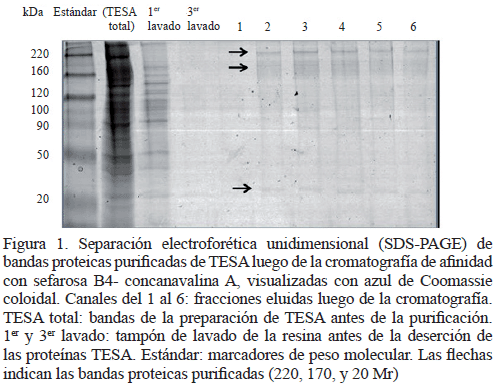
Electroforesis unidimensional de las proteínas purificadas de TESA por cromatografía de afinidad: En la figura 1 se compara el patrón de proteínas de la preparación no purificada de TESA con las distintas fracciones eluidas (canales 1-6) de TESA luego de la cromatografía de afinidad, en un gel de poliacrilamida (SDS-PAGE) al 10%. En los canales 2-6, se observan tres bandas de polipéptidos de aproximadamente 220, 170 y 20 kDa. Este resultado demuestra la eficiencia del proceso de purificación de las proteínas totales de TESA, ya que el número de bandas visualizadas en las diferentes fracciones se redujeron considerablemente al compararlas con el TESA total.
Inmunodetección antigénica de las fracciones purificadas de TESA: Cuando se utilizó el cromógeno diaminobenzidina se evidenció que el control positivo reconoció las bandas proteicas de aproximadamente 220, 120, 85, 50, 32 y 20 kDa (Figura 2). La figura 3, presenta los resultados del patrón de reconocimiento de cinco bandas de proteínas (220, 120, 85,50, y 32 20 Kda) eluidas por cromatografía de afinidad y detectadas por el control positivo mediante quimioluminiscencia. Una banda proteica de 170 kDa identificada en el SDS-PAGE unidimensional, resultó no inmunogénica en la inmunoelectrotransferencia. Igualmente la banda de 20 kDa fue visualizada con diaminobenzidina pero no con el reactivo de luminol. Con ambos sistemas de revelado (diaminobenzidina y luminol) el pool de suero sin infección por T. cruzi (control negativo) no reconoció las bandas proteicas purificadas en la prueba de inmunoelectrotransferencia.
Discusión
En el presente trabajo se presenta un método alternativo de purificación para los antígenos TESA que garantiza su estabilidad proteica; sin embargo, el método utilizado no garantizó suficiente rendimiento proteico (0,38%). La intención de sustituir los extractos de los parásitos por proteínas purificadas de los mismos representa una alternativa para aumentar la sensibilidad y especificidad de los análisis; pero estas purificaciones resultan difíciles en cuanto a practicidad, debido a que las cantidades proteicas obtenidas son relativamente bajas [20]. La resina de sefarosa concanavalina A es ampliamente utilizada para la purificación de sustancias glicosiladas y con esta técnica, se pueden utilizar gran variedad de protocolos que describen el uso de diferentes buffers de equilibrio y elución, lo cual demuestra la tolerancia de esta técnica a diferentes condiciones. Aunque la mayoría de los solutos son fácilmente eluidos, en algunos casos ciertas glicoproteínas se unen tan fuertemente a las resinas que las técnicas para su elución resultan inefectivas [21]. Esta afirmación podría sustentar los resultados de la presente investigación, que demostraron que el rendimiento proteico después de la purificación fue bajo.
La baja eficiencia de la purificación con la resina de sefarosa-concanavalina A, también ha sido descrita por otros autores. Soper y Aird [21] utilizaron esta resina para la purificación de la fosfodiesterasa (PDE) del veneno de la serpiente Agkistrodon piscivorus leucostoma. Estos autores afirman que la PDE tiene gran afinidad por la resina, por lo que en los experimentos de purificación iniciales fallaron en obtener cantidades suficientes de ésta. Por lo tanto, los autores proponen una técnica simple para mejorar la elución de los solutos, que consiste en incluir de 4-6 pausas de 5-10 minutos durante la elución proteica. Igualmente, se recomienda utilizar concentraciones de los azúcares en el buffer de elución menores de 250 mM para metil-glucósido y de 500 mM para metil-manósido a un pH ácido (pH 4,0), así como evitar el uso de NaCl en el buffer de elución. En nuestro ensayo, la utilización de un buffer que contenía una concentración elevada de la mezcla de los azúcares (0,3M) y NaCl 0,5 M, a un pH de 7,4 y la no aplicación de las pausas durante el proceso de purificación pudieron haber influenciado en el bajo rendimiento del proceso.
Un bajo rendimiento proteico en procesos de purificación de proteínas de T. cruzi para el diagnóstico de la enfermedad de Chagas, también ha sido registrado en otros trabajos. Silber et al. [22] purificaron la glicoproteína LLGP-67 kDa a través de la cromatografía de afinidad con eritrocitos humanos desialidados, basándose en su interacción específica con los residuos de galactosa exhibida en la superficie de los eritrocitos; sin embargo, la cantidad de proteínas recuperadas para realizar el diagnóstico de la enfermedad de Chagas fue baja. Otras investigaciones han logrado un buen rendimiento proteico en sus intentos de obtener antígenos purificados para el diagnóstico de la enfermedad de Chagas. Scharfstein et al. [23] purificaron la glicoproteína Gp25 enlazada a iodo 125 (125I-Gp 25) por medio de la cromatografía de afinidad con concanavalina A, obteniendo un buen rendimiento proteico. Sin embargo, el método de diagnóstico empleado (radioinmunoprecipitación) utiliza compuestos radioactivos, lo cual es inapropiado para las pruebas de diagnóstico de rutina, ya que representa un alto riesgo de contaminación radioactiva. Berrizbeitia et al. [7] obtuvieron un mejor rendimiento antigénico de las proteínas TESA purificadas utilizando la resina de bromuro de cianógeno, con lo cual la obtención de proteínas purificadas fue de 190 µg/mL a partir de una concentración inicial de 850 µg/mL.
Las proteínas TESA, están clasificadas como glicoproteínas; en el presente trabajo se demostró que éstas presentan residuos de glucosa y manosa, ya que se logró la purificación con una resina de sefarosa B4-concanavalina A utilizando un buffer de elusión que contenía una mezcla de ambos azúcares. En un estudio anterior, Berrizbeitia et al. [7], purificaron 6 bandas de TESA utilizando una columna de bromuro de cianógeno (220, 170, 80, 60, 35, 25 kDa), las cuales fueron visualizadas en electroforesis unidimensional con tinción de plata; sin embargo, las proteínas no mostraron estabilidad en el buffer de elución (glicina 0,10 M, pH 2,5), experimentando degradación después de dos meses de almacenamiento a -70°C. Este problema fue resuelto dializando el eluato en buffer fosfato salino (PBS, pH 7,4) pero el rendimiento proteico se redujo apreciablemente. Por lo tanto, en el presente trabajo decidimos emplear otra alternativa de purificación de TESA que garantizara su estabilidad proteica.
Proponemos que las proteínas purificadas de TESA pueden ser utilizadas para el diagnóstico de la infección por T. cruzi, ya que el pool de sueros provenientes de individuos confirmados como positivos para esta infección reconoció las bandas proteicas purificadas en la inmunoelectrotransferencia. No hubo una concordancia perfecta entre las bandas reveladas con diaminobenzidina y luminol, pues el revelado con diaminobenzidina (DAB) permitió observar la banda de 20 kDa que no fue visualizada con luminol. Consideramos que la fuerte reacción observada en la inmunotinción utilizando el reactivo luminol que no nos permitió una mayor exposición de la placa radiográfica a la membrana de nitrocelulosa, ocasionó posiblemente el no revelado de esta banda de bajo peso molecular. Por otra parte, debe considerarse que distintos trabajos afirman que el cromógeno DAB posee una sensibilidad débil, mientras que el reactivo de luminol cuenta con una alta sensibilidad, con un rango de detección desde los 10 a 12 ρg, además de poseer gran afinidad por las moléculas proteicas [24-25].
Las proteínas purificadas de TESA no fueron reconocidas por el pool de suero proveniente de controles sin infección por T. cruzi. Estos hallazgos demuestran el gran potencial de estas proteínas para el diagnóstico de la enfermedad de Chagas. La banda proteica de 170 kDa identificada en el SDS-PAGE unidimensional, resultó no inmunogénica; sin embargo, tanto el revelado con DAB como el de luminol ocasionaron una fuerte reacción en una banda de aproximadamente de 220 kDa, lo cual demuestra que esta proteína es altamente inmunogénica. Diversos trabajos, han mostrado la utilidad de las proteínas de TESA con pesos moleculares por encima de 150 kDa, las cuales son específicas para T. cruzi y no presentan reacciones cruzadas con Leishmania sp. [8, 14]. En esta investigación se demostró la reactividad de la proteína de 85 kDa hacia el pool de sueros con infección por T. cruzi. Este patrón de reacción coincide con lo reportado por Berrizbeitia et al [7], quienes encontraron que un pool de sueros de pacientes chagásicos reconoció las bandas de 85 y 220 kDa purificadas de TESA utilizando una resina de bromuro de cianógeno.
En este trabajo se ofrece una nueva alternativa de purificación de los antígenos TESA que no había sido descrita previamente; igualmente, se demuestra la estabilidad de las proteínas eluidas, ya que su reactividad se mantuvo estable durante su almacenamiento (aproximadamente 5 meses). El rendimiento proteico obtenido con esta técnica de purificación fue bajo y poco práctico para considerar su utilización de forma rutinaria con fines de diagnóstico, como por ejemplo, en la prueba de ELISA, donde se requiere una cantidad considerable de antígeno para la sensibilización de la microplaca [26]. Sin embargo, una vez demostrado el reconocimiento antigénico de las proteínas purificadas de TESA sólo por el pool de sueros de individuos con infección por T. cruzi y su estabilidad con este tipo de purificación (resina de sefarosa B4-concanavalina A), se podría secuenciar las proteínas para iniciar la obtención de péptidos sintéticos o la clonación de las mismas, para así obtener un rendimiento antigénico suficiente que permita obtener la cantidad de antígeno necesario para las pruebas serológicas de diagnóstico de la enfermedad de Chagas.
Agradecimientos
Este trabajo fue financiado por FONACIT (Misión Ciencias, proyecto Nº 2007001425) y por la Comisión de Investigación, Núcleo de Sucre, Universidad de Oriente (proyecto Nº CI-2-040102-1417-08) y a la Licda. Mehudy Medina por la donación de los sueros confirmados para infección por T. cruzi en el Laboratorio de Referencia Nacional de Inmunodiagnóstico para la Enfermedad de Chagas, (Maracay , estado Aragua).
Referencias
1. Affranchino JL, Ibanez CF, Luquetti AO, Rassi A, Reyes MB, Macina RA, et al. Identification of a Trypanosoma cruzi antigen that is shed during the acute phase of Chagas disease. Mol Biochem Parasitol. 1989; 34: 221-8. [ Links ]
2. Goldenberg S, Krieger M, Lafaille J, Almeida E, Oelemann W. Use of Trypanosoma cruzi antigens in the immunological diagnosis of Chagas disease. Mem Inst Butantan. 1991; 53: 71-6. [ Links ]
3. Krieger MA, Almeida E, Oelemann W, Lafaille JJ, Pereira JB, Krieger H et al. Use of recombinant antigens for the accurate immunodiagnosis of Chagas disease. Am J Trop Med Hyg. 1992; 46: 427-34. [ Links ]
4. Umezawa ES, Bastos SF, Camargo ME, Yamauchi LM, Santos MR, Gonzalez A et al. Evaluation of recombinant antigens for serodiagnosis of Chagas disease in South and Central America. J Clin Microbiol. 1999; 37: 1554-60. [ Links ]
5. Franco da Silveira F, Umezawa E, Luquetti A. Chagas disease: recombinant Trypanosoma cruzi antigens for serological diagnosis. Trends Parasitol. 2001; 17: 286-91. [ Links ]
6. Zingales B, Gruber A, Ramalho CB, Umezawa ES, Colli W. Use of two recombinant proteins of Trypanosoma cruzi in the serological diagnosis of Chagas disease. Mem Inst Oswaldo Cruz. 1990; 85: 519-22. [ Links ]
7. Berrizbeitia M, Ndao M, Bubis J, Gottschalk M, Ache A, Lacouture S, et al. Purified excreted-secreted antigens from Trypanosoma cruzi trypomastigotes as tools for diagnosis of Chagas disease. J Clin Microbiol. 2006; 44: 291-6. [ Links ]
8. Umezawa ES, Shikanai-Yasuda MA, Stolf AM. Changes in isotype composition and antigen recognition of anti-Trypanosoma cruzi antibodies from acute to chronic Chagas disease. J Clin Lab Anal. 1996; 10: 407-13. [ Links ]
9. Kesper N, de Almeida KA, Stolf A, Umezawa ES. Immunoblot analysis of trypomastigote excreted-secreted antigens as a tool for the characterization of Trypanosoma cruzi strains and isolates. J Parasitol. 2000; 86: 862-7. [ Links ]
10. Schenkman S, Eichinger D, Pereira ME, Nussenzweig V. Structural and functional properties of Trypanosoma trans-sialidase. Annu Rev Microbiol. 1994; 48: 499-523. [ Links ]
11. Frasch AC. Functional diversity in the trans-sialidase and mucin families in Trypanosoma cruzi. Parasitol Today. 2000; 16: 282-6. [ Links ]
12. Umezawa ES, Nascimento MS, Kesper N, Coura JR, Borges-Pereira J, Junqueira AC et al. Immunoblot assay using excreted-secreted antigens of Trypanosoma cruzi in serodiagnosis of congenital, acute, and chronic Chagas disease. J Clin Microbiol. 1996; 34: 2143-7. [ Links ]
13. Berrizbeitia M, Ndao M, Bubis J, Gottschalk M, Ache A, Lacouture S et al. Field evaluation of four novel enzyme immunoassays for Chagas disease in Venezuela blood banks: comparison of assays using fixed-epimastigotes, fixed-trypomastigotes or trypomastigote excreted-secreted antigens from two Trypanosoma cruzi strains. Transfus Med. 2006; 16: 419-31. [ Links ]
14. Nakazawa M, Rosa DS, Pereira VR, Moura MO, Furtado VC, Souza WV et al. Excretory-secretory antigens of Trypanosoma cruzi are potentially useful for serodiagnosis of chronic Chagas disease. Clin Diagn Lab Immunol. 2001; 8: 1024-7. [ Links ]
15. Umezawa ES, Nascimento MS, Stolf AM. Enzyme-linked immunosorbent assay with Trypanosoma cruzi excreted-secreted antigens (TESA-ELISA) for serodiagnosis of acute and chronic Chagas disease. Diagn Microbiol Infect Dis. 2001; 39: 169-76. [ Links ]
16. Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 1976; 72: 248-54. [ Links ]
17. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227: 680-5. [ Links ]
18. Neuhoff V, Arold N, Taube D, Ehrhardt W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 1988; 9: 255-62. [ Links ]
19. Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 1979; 76: 4350-4. [ Links ]
20. Marcipar IS, Welchen E, Roodveldt C, Marcipar AJ, Silber AM. Purification of the 67-kDa lectin-like glycoprotein of Trypanosoma cruzi, LLGP-67, and its evaluation as a relevant antigen for the diagnosis of human infection. FEMS Microbiol Lett. 2003; 220: 149-54. [ Links ]
21. Soper AS, Aird SD. Elution of tightly bound solutes from concanavalin A Sepharose. Factors affecting the desorption of cottonmouth venom glycoproteins. J Chromatogr A. 2007; 1154: 308-18. [ Links ]
22. Silber AM, Marcipar IS, Roodveldt C, Cabeza Meckert P, Laguens R, Marcipar AJ. Trypanosoma cruzi: identification of a galactose-binding protein that binds to cell surface of human erythrocytes and is involved in cell invasion by the parasite. Exp Parasitol. 2002; 100: 217-25. [ Links ]
23. Scharfstein J, Luquetti A, Murta AC, Senna M, Rezende JM, Rassi A et al. Chagas disease: serodiagnosis with purified Gp25 antigen. Am J Trop Med Hyg. 1985; 34: 1153-60. [ Links ]
24. Mills EL, Rholl KS, Quie PG. Luminol-amplified chemiluminescence: a sensitive method for detecting the carrier state in chronic granulomatous disease. J Clin Microbiol. 1980; 12: 52-6. [ Links ]
25. Peacock CS, Thompson IW, Van Noorden S. Silver enhancement of polymerised diaminobenzidine: increased sensitivity for immunoperoxidase staining. J Clin Pathol. 1991; 44: 756-8. [ Links ]
26. Crowther J. The ELISA guidebook. New York: Springer-Verlag. 2000. [ Links ]












 uBio
uBio