Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. v.30 n.2 Caracas dez. 2010
Detección molecular mediante RT-PCR de calicivirus y enterovirus en niños menores de 6 años con síndrome diarreico
Natalie Wildermann a, Leticia Porto-Espinoza a,*, Reyna Moronta b, Mariangela Bracho c, Luciana Costa d, Diana Callejas a,d
a Laboratorio Regional de Referencia Virológica,
b Cátedra Biología Celular y Genética, Departamento de Biología, Facultad de Humanidades y Educación,
c Laboratorio de Virología, Centro de Investigaciones del Agua, Facultad de Ingeniería
d Cátedra de Virología, Escuela de Bioanálisis, Facultad de Medicina. La Universidad del Zulia. Maracaibo, Estado Zulia.
* Correspondencia: E-mail: letiporto@yahoo.com
Resumen: Mundialmente, la diarrea es una de las causas más importantes de morbi-mortalidad en la población. En Venezuela, se reportan anualmente cerca de 480.000 consultas y 706 fallecimientos a causa de diarreas, de las cuales el 32% se registran en el Zulia. Entre los virus con capacidad patogénica involucrados en cuadros diarreicos se encuentran los calicivirus y enterovirus. Con el objetivo de evaluar la prevalencia de estos agentes virales en el municipio Maracaibo, se colectaron 150 muestras de heces diarreicas de niños menores de 6 años, en las que se analizó la presencia de calicivirus y enterovirus mediante RT-PCR. Se observó una mayor prevalencia de infección por enterovirus (31,3%), lo que indica la existencia de posibles problemas de higiene y/o contaminación del agua. Además, se evidenció disminución de la infección por enterovirus con el aumento de la edad, posiblemente por la adquisición de anticuerpos por exposiciones previas al virus. La prevalencia de calicivirus en la población fue baja (3,0%), considerándolos así casos aislados. La ausencia de este virus durante el primer año de vida se ve favorecida por la protección inmunitaria que confiere la alimentación con leche materna. El presente estudio indica que los enterovirus son agentes etiológicos importantes de diarreas en la población infantil estudiada.
Palabras clave: calicivirus, enterovirus, RT-PCR, niños, síndrome diarreico
Calicivirus and enterovirus molecular detection through RT-PCR in children under 5 years old with diarrheal syndrome
Abstract: Worldwide, diarrhea is one of the most important morbility-mortality causes in the general population. In Venezuela, there are annual reports of around 480,000 consultations and 706 deaths due to diarrhea, 32% of which are registered in Zulia State. Calicivirus and enterovirus are among the viruses with pathogenic capacity involved in diarrheal episodes. With the purpose of evaluating the prevalence of these viruses at the Maracaibo Municipality, we collected 150 diarrheal feces samples from children under 5 years old, and calicivirus and enterovirus presence was determined through RT-PCR. There was a greater prevalence of enterovirus infections (31.3%), which indicates the probable existence of hygiene problems and/or water contamination. There was also evidence of a decrease of enterovirus contamination with age, possible due to the development of antibodies during previous exposure to the virus. Calicivirus prevalence in this population was low (2.9%), and they were considered as isolated cases. Absence of this virus during the first year of life is favored by the immunological protection conferred by maternal breast-feeding. The present study indicates that enteroviruses are important diarrheal etiologic agents in the child population studied.
Keywords: calicivirus, enterovirus, RT-PCR, children, diarrheal syndrome
Recibido 5 de marzo de 2010; aceptado 16 de diciembre de 2010
Introducción
La diarrea es considerada una de las principales causas de preocupación sanitaria, debido a su alto índice de morbi-mortalidad, especialmente en los países subdesarrollados donde los más afectados son los niños menores de 5 años [1,2]. Los brotes de enfermedades diarreicas durante las edades tempranas pueden generar deficiencias en el desarrollo físico y mental, lo cual puede traer graves consecuencias a largo plazo en el estado de salud y productividad en la etapa adulta [3]. Para el año 2008, se reportaron cerca de 10 millones de casos de diarrea infantil a nivel mundial, y una mortalidad promedio anual de 1,87 millones de niños [4].
En Venezuela, las estadísticas epidemiológicas ubican a la diarrea en el segundo lugar de mayor ocurrencia en la población con un porcentaje del 15 a 20% de los reportes semanales de enfermedades, siendo los niños menores de 5 años los más afectados. Las estadísticas del 2008 del Ministerio para el Poder Popular para la Salud (MPPS) reportaron 472.332 consultas y 706 fallecimientos a causa de diarreas en el país [5].
El Zulia es el estado con mayor número de reportes de diarrea (más del 32%). En el 2008 se registraron semanalmente entre 1.900 y 8.600 casos, y en el 2006, un total de 231 muertes a lo largo del año [6,7]. Sin embargo, los estudios publicados sobre la etiología de los mismos son escasos en dicho estado, factores que son sumamente importantes para establecer medidas de control acordes a la situación socio-económica de la población en estudio.
Entre los virus que poseen capacidad patogénica en cuadros diarreicos de origen infeccioso se encuentran los rotavirus (grupos A, B y C), adenovirus (serotipos 40 y 41), calicivirus (tipos Norwalk, tipos Sapporo), enterovirus (ECHO, coxsackie) y astrovirus [8,9].
Los calicivirus y enterovirus son transmitidos principalmente por vía fecal-oral, debido al contacto directo con personas enfermas o por medio del consumo de alimentos y aguas contaminados [10]. Los calicivirus se distribuyen en numerosos países alrededor del mundo; sin embargo, se ha determinado que la infección en niños menores de 5 años es mayor en países subdesarrollados [11]. De manera similar, las epidemias por enterovirus prevalecen en zonas socioeconómicamente pobres y en condiciones de sobrepoblación [12].
Durante las últimas décadas se han desarrollado nuevas técnicas moleculares que permiten la detección de virus cuya replicación en cultivos celulares es nula o muy pobre, como es el caso de los calicivirus, algunos enterovirus y otros virus gastroenteríticos [8]. Actualmente, el método más específico y exacto en la identificación de virus es la Reacción en Cadena de la Polimerasa (PCR por sus siglas en inglés) y la Retrotranscripción Reversa-PCR (RT-PCR). La efectividad de estas técnicas radica en su especificidad y sensibilidad para la detección del genoma de diversos agentes virales [13].
Dada la alta incidencia de diarreas en el estado Zulia, en la presente investigación se propuso emplear la técnica molecular RT-PCR para detectar la presencia de calicivirus y enterovirus en muestras de heces en niños menores de 6 años con síndrome diarreico del municipio Maracaibo, para determinar algunos de los patógenos involucrados, aportando de esta manera datos que pudieran ser de utilidad para futuras investigaciones relacionadas con virus causantes de enfermedades gastrointestinales.
Pacientes y métodos
Recolección y almacenamiento de muestras: El material de estudio estuvo constituido por heces de 150 pacientes de ambos sexos con edades comprendidas entre cero y seis años, con una media de edad de 1 año, asistidos en los siguientes centros de salud del municipio Maracaibo, estado Zulia: Hospital Universitario, Servicios Médicos de La Universidad del Zulia, Ambulatorio San Jacinto, Ambulatorio El Norte, Ambulatorio de Cujicito y Laboratorio Soré Gutiérrez, entre los meses de septiembre de 2008 y junio de 2009 por presentar síndrome diarreico.
El protocolo fue aprobado por los comités de ética de los centros de salud participantes. Los padres o tutores legales de todos los pacientes pediátricos dieron su consentimiento informado por escrito según las Normas del Código de Bioética y Bioseguridad [14]. Todos los procedimientos fueron realizados siguiendo los lineamientos establecidos en la Declaración de Helsinki para investigación en humanos [15].
Procesamiento de muestras: Se realizó una suspensión de las muestras fecales al 10%. Para ello, se agitó en agua libre de nucleasas aproximadamente 0,1 gr de heces sólidas ó 100µL de heces líquidas. Luego de 10 minutos, se centrifugó a 10.000 g por 10 minutos a 4ºC y el sobrenadante se guardó a -20ºC hasta su utilización [16].
Extracción de ARN viral: El ARN viral de las muestras de heces de los pacientes fue extraído mediante la técnica por columnas, utilizando el kit QIAamp Viral RNA (Qiagen® Alemania, 2008). Como control positivo de calicivirus para la extracción se utilizó una muestra de agua residual urbana proveniente de la planta de tratamiento Maracaibo Sur donde en trabajo previo se comprobó la presencia de calicivirus por RT/PCR y secuenciación [17] y para enterovirus la vacuna antipoliomielítica oral (Novartis Argentina, S.A.), las cuales fueron gentilmente suministradas por el Laboratorio de Virología Ambiental del Centro de Investigación del Agua de la Universidad del Zulia. Como control negativo se empleó agua libre de nucleasas (Promega Corp. USA, 2005).
Retrotranscripción de ARN viral: Se realizó la transcripción reversa del ARN de enterovirus y calicivirus mediante el kit ImProm-II Reverse Transcription System (Promega Corp. USA, 2005), siguiendo el protocolo sugerido por el fabricante: Random primers (0,01µL), buffer de reacción ImPromII 5X (4µL), cloruro de magnesio (3µL), mezcla de dNTP`s (1µL), inhibidor de la ribonucleasa RNasin (0,5µL), transcriptasa reversa (1µL), agua libre de nucleasa (5,49µL), ARN extraído (5µL), volumen total (20µL). Una vez preparados, los tubos de reacción se incubaron a temperatura ambiente por cinco minutos (5). Luego, se colocaron en un termociclador GeneAmp® PCR System 2400, Applied Biosystems (Perkin Elmer, USA 2006), empleando el siguiente perfil térmico: (1) 42°C por 60; (2) 99°C por 5. Una vez culminado el ciclo, se colocaron las muestras con ADN complementario (ADNc) a 4°C hasta su utilización.
Amplificación por PCR: Para la reacción de amplificación se utilizaron 5µL de ADNc, el kit PCR Master Mix (Promega Corp. USA, 2005) y los iniciadores para enterovirus con concentración de 10µM cada uno, Ent1: 5´CGGTACCTTTGTACGCCTGT3´ y Ent2: 5´ATTGTCACCATAAGCA
GCCA3´ descritos por Pina y col. [18], estos iniciadores flanquean la región comprendida entre los nucleótidos 64 y 597 de coxsackievirus B4, dentro de la región no codificante del extremo 5 y su especificidad fue evaluada frente a 24 cepas de enterovirus (echovirus tipo 2, 5, 6, 7, 9, 11, 15, 18, 19, 21, 25, 27, 29 30; coxsackievirus tipo A9, B1, B2, B3, B4, B5, B6; poliovirus tipo 1, 2, 3), pudiéndose detectar todos ellos por PCR [19]. Para calicivirus se emplearon NW1: 5´CAAATGACAGAATCCTTC3´ y NW2: 5´GAGAAATATGACATGGATTGC3´, descritos por De León y col. [20,21].
Las reacciones de amplificación se llevaron a cabo en un termociclador GeneAmp® PCR System 2400, Applied Biosystems (Perkin Elmer, USA 2006), empleando los siguientes parámetros de PCR estandarizados para cada virus:
- Calicivirus [20]: (1) desnaturalización a 94°C por 3; (2) alineamiento y amplificación de la secuencia deseada: 40 ciclos a 95°C por 130, 55°C por 130 y 72°C por 130; (3) extensión final: 72°C por 7; (4) almacenamiento: 4°C hasta su uso.
- Enterovirus [18]: (1) 94°C por 2; (2) 30 ciclos a 92°C por 130, 55°C por 130 y 72°C por 2; (3) 72°C por 10; (4) 4°C hasta su uso.
Visualización de resultados: Se prepararon geles de agarosa al 2% teñidos con bromuro de etidio (0,5 µg/mL), y se empleó amortiguadorr TBE 1X para la corrida. Como marcador de peso molecular se utilizó el DNA Molecular Weigth Marker VIII (19-1114 bp) (Roche Applied Science) de carga Blue/Orange Loading Dye (Promega). Las condiciones de corrida de electroforesis fueron las siguientes: 100 V, 500 Amp, 250 Power, durante 45. Una vez culminada la corrida se observaron las bandas mediante un transiluminador UV Pro y se registraron los resultados fotográficamente.
Análisis estadístico: Se realizó un análisis porcentual de las variables consideradas para la determinación de la prevalencia por grupos etarios y sexo en los individuos estudiados. Así mismo, se hizo uso del programa GraphPad Prism 5.02 (Graphpad Software) para la determinación de la media (![]() ) y desviación estándar (σ), tabla de contingencia y test Chi cuadrado (Χ2). Se consideraron significativos valores p<0.05 con un índice de confianza de 95%.
) y desviación estándar (σ), tabla de contingencia y test Chi cuadrado (Χ2). Se consideraron significativos valores p<0.05 con un índice de confianza de 95%.
Resultados y discusión
De las 150 muestras de heces colectadas, en 83 (55,3%) se determinó la presencia de bacterias y parásitos enteropatogenos que pudieran estar relacionados con el establecimiento de la diarrea, por lo que fueron las 67 (44,7%) restantes las seleccionadas para llevar a cabo la detección de la presencia de enterovirus y calicivirus.
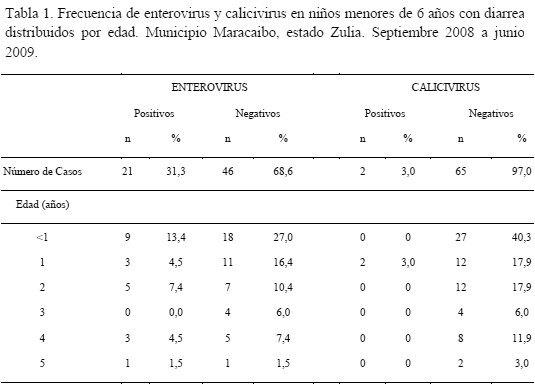
Con la metodología utilizada se confirmó la efectividad de amplificación de los primers empleados para la secuencia de la región 5-NTR de enterovirus, observando bandas bien definidas de los casos positivos (Figura 1-a). Así mismo, los resultados para calicivirus revelaron bandas definidas de la región que codifica para el Gen de la ARN Polimerasa (Figura 1-b). Estos últimos iniciadores amplifican principalmente los virus tipo Norwalk, lo que limita la detección de otros grupos de calicivirus, como los sapovirus [22,23].
Los resultados indican una mayor frecuencia de infección de enterovirus con un 31,3% (N=21) y, una baja proporción de casos positivos para calicivirus (3,0%; N=2) Tabla 1. Estos valores son comparables con los encontrados por otros autores [24] en la comunidad de Nazareth (estado Zulia), donde se obtuvo un 47,08% de positividad para enterovirus, y 0% para calicivirus.
La relación de los enterovirus como agentes etiológicos de las enfermedades gastrointestinales no ha sido evaluada a profundidad como otros virus entéricos. Sin embargo, investigaciones recientes realizadas principalmente en países en vías de desarrollo, indican que el estudio de la presencia de estos virus en niños con síndrome diarreico es de suma importancia [7,25]. En esta investigación se detectó la presencia de enterovirus como posible agente etiológico de diarrea en el 31,3% de las muestras de heces analizadas, lo que pone en evidencia la circulación del virus en la población estudiada.
Existe la posibilidad de que los casos positivos puedan deberse a la presencia de partículas virales de la vacuna antipoliomielítica en las heces. A pesar que la poliomielitis se encuentra erradicada en Venezuela desde 1989 [26], los planes de inmunización nacional aún administran la Vacuna Polio Oral (VPO) y la Vacuna Inactivada de la Polio (VPI), en niños menores de 5 años. La VPO posee poliovirus atenuados de los tipos 1, 2 y 3, y pueden generar efectos secundarios como diarrea, fiebre y exantemas. El virus es excretado por vía fecal durante las primeras cuatro semanas, lo cual favorece su detección en las muestras de niños con diarrea. Sin embargo, es necesaria la futura secuenciación de las muestras de heces positivas, para establecer si la fuente viral proviene de virus salvajes o virus vacunal [27].
Por otro lado, existen razones que apoyan la idea de que la población en estudio pudo estar expuesta a enterovirus infecciosos y por tanto, que éste sea el agente etiológico causante de la diarrea. En trabajos previos llevados cabo en la ciudad de Maracaibo, se ha demostrado la presencia no sólo del genoma de enterovirus, sino también de enterovirus infecciosos del tipo echovirus, coxsackivirus y poliovirus humano 1 cepa Sabin (vacunal) en un elevado porcetaje de muestras de agua para consumo humano (19,2%), agua para la irrigación de cultivos (55%), agua recreacional (45%) y de alimentos (29%), lo que indica que la población de estudio pudo estar expuesta a la infección con enterovirus por cualquiera de estas vías [28-30].
El bajo porcentaje de muestras de heces diarreicas positivas para la presencia de calicivirus (2,9%) detectadas en esta investigación, se asemejan a resultados obtenidos en Venezuela por Pujol y col. [31] y Castellanos [24], quienes detectaron 0,4% y 0% de prevalencia de calicivirus, respectivamente. Por lo tanto, se puede mencionar que estos virus no han sido agentes etiológicos predominantes en los casos evaluados de niños con gastroenteritis, debido a la limitante de los cebadores utilizados, los cuales sólo detectan calicivirus tipo Norwalk y no los sapovirus que son agentes importantes de diarrea en infantes. En contraste, en otros países latinoamericanos se ha determinado que los calicivirus son agentes etiológicos importantes de enfermedades gastroenteríticas, registrando prevalencias entre 10 y 35% de infección por dicho virus [25,32].
Además, se presume que las condiciones climáticas de la zona (Maracaibo) podrían desfavorecer el establecimiento e infección por estos virus en los pacientes estudiados. Aunque en numerosos estudios se ha demostrado la presencia de calicivirus a lo largo de todo el año, este comportamiento epidemiológico estacional también ha sido observado en países tropicales como Brasil, donde la mayor prevalencia se detecta durante los meses más frescos [33].
En relación a la distribución de infección de los virus de acuerdo a la edad, se determinó un menor porcentaje de infección por enterovirus en los niños menores de 1 año 13,4% y de calicivirus en los niños de 1 año con un 3,0% (tabla 1). Los análisis de Chi cuadrado indican que la presencia de casos positivos de enterovirus (p=0,6) y calicivirus (p=0,17) no está significativamente asociada a la edad. Sin embargo, los resultados señalan una disminución tanto en la presencia de diarrea en los pacientes, como en los casos positivos de infección de enterovirus, a medida que aumenta la edad. La baja prevalencia relativa del virus en los niños mayores podría deberse a la adquisición de memoria inmunitaria por exposiciones previas a enterovirus, conllevando a que éstos sean menos propensos a sufrir enfermedades gastrointestinales, debido a la presencia de anticuerpos contra las mismas, comportamiento que ha sido observado también en estudios similares [34-36].
Así mismo, se presume que la presencia de enterovirus, principalmente en los niños menores a 6 meses, puede estar muy relacionada a la excreción de antígenos de la vacuna antipoliomielítica, la cual es administrada en tres dosis: a los 2, 4 y 6 meses de edad [26]. Estudios previos han determinado que, tanto la cantidad de viriones como la duración de la excreción fecal de los mismos, es mayor en pacientes no inmunizados o con pocas inmunizaciones previas, por lo que la presencia del virus en las muestras disminuye conforme aumenta la edad [37].
La baja presencia de calicivirus observada durante el primer año de edad, se puede atribuir a la inmunidad protectora que le confiere la leche materna al neonato, por el alto contenido de oligosacáridos protectores (lacto-N-difucohexaosa, LDFH-I) contra la infección causada por estos virus [38]. En esta investigación se establece que los niños menores de 2 años de edad presentan una mayor prevalencia de calicivirus, resultados que concuerdan con los reportados por otros investigadores [39], donde se indica que los niños de un año fueron más propensos a adquirir infecciones por calicivirus que el resto de los grupos etarios [33].
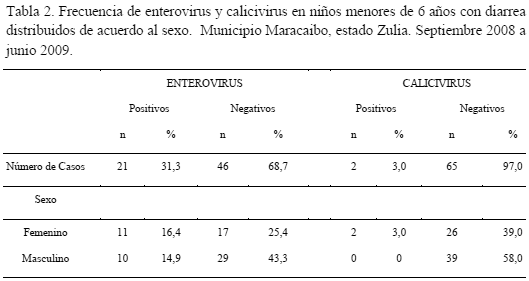
En la tabla 2 se evidencia la presencia de enterovirus en niños menores de 6 años y ocurren con frecuencias similares en ambos sexos. Para el caso de infecciones causadas por calicivirus, se observa una mayor prevalencia en el sexo femenino; sin embargo, el bajo número de casos positivos detectados no permite establecer diferencias significativas entre ambos sexos.
En conclusión, estos resultados muestran el posible papel de los enterovirus como agentes etiológicos de diarreas en niños menores de 6 años del municipio Maracaibo, estado Zulia.
Agradecimientos
Los autores agradecen al Consejo de Desarrollo Científico y Humanístico de la Universidad del Zulia, por su cofinanciamiento para desarrollar la presente investigación a través del proyecto CONDES Nº CC-0895-08.
Referencias
1. Kosek M, Bern C, Guerrant R. The global burden of diarrhoeal disease, as estimated from studies published between 1992 y 2000. Bull World Health Organ. 2003; 81 (3): 197-204. [ Links ]
2. Pérez W, Melogno A, Píriz M, Pastorino H, Pereira M, Pinchak C, y col. Diarrea aguda infantil. Admisión hospitalaria en menores de tres años. Año 2005. Arch Pediatr Urug. 2007; 78 (2): 94-8. [ Links ]
3. Guerrant R, Kosek M, Moore S, Lorntz B, Brantley R, Lima A. Magnitude y impact of diarrheal diseases. Arch Med Res. 2002; 33 (4): 351-5. [ Links ]
4. Boschi-Pinto C, Velebit L, Shibuya K. Estimating Child Mortality Due To Diarrhoea In Developing Countries. Bull World Health Organ. 2008; 86 (9): 710-7. [ Links ]
5. Ministerio del Poder Popular para la Salud (MPPS). Boletín Epidemiológico Semanal. Semana Epidemiológica No. 53. Gobierno Bolivariano de Venezuela. Año LVII. 2009. pp 22. [ Links ]
6. Ministerio del Poder Popular para la Salud (MPPS). Anuario de Mortalidad 2006. Gobierno Bolivariano de Venezuela. 2007-a. pp. 366. [ Links ]
7. Rincón W, Acuero E, Serrano E, Quintero M, Beauchamp S. Enteroparásitos asociados a diarrea aguda en niños menores de 12 años de edad. Kasmera. 2006; 34 (1): 31-9. [ Links ]
8. Atmar R, y Estes M. Diagnosis Of Noncultivable Gastroenteritis Viruses, The Human Caliciviruses. Clin Microbiol Rev. 2001; 14(1):15-37. [ Links ]
9. Buesa Gómez, J, López-Yújar, P, Rodríguez Díaz, J. 2009. Diagnóstico De Las Infecciones Víricas Gastrointestinales. Control Calidad SEIMC. Departamento de Microbiología, Facultad de Medicina y Hospital Clínico Universitario, Universidad de Valencia. Tomado de:: http://www.seimc.org/control/revi_viro/rotavir.htm. Acceso 07 de febrero de 2010. [ Links ]
10. Murray P, Rosenthal K, Kobayashi G, Pfaller M. Microbiología Médica. 4ta. Edición. Madrid, España: Editorial Mosby; 2002. [ Links ]
11. Manrique F, Billon Y, Tigne D, Bello S, Ospina J. Agentes causantes de Diarrea en Niños Menores de 5 Años en Tunja, Colombia. Rev Salud Publica. 2006; 8(1): 88-97. [ Links ]
12. Muir P, Kammerer U, Korn K, Mulders M, Poyry T, Weissbrich B, Kyolf R, Cleator G, van Loon A. Molecular Typing of Enteroviruses: Current Status y Future Requirements. Clin Microbiol. 1998; 11: 202-27. [ Links ]
13. Lönnrot M, Sjöroos M, Salminen K, Maaronen M, Hyypiä T, Hyöty H. Diagnosis of Enterovirus y rhinovirus infections by RT-PCR & time-resolved fluorometry with lanthanide chelate labeled probes. J Med Virol. 1999; 59 (3): 378–84. [ Links ]
14. Briceño E, Pérez E; Villalón M, Aguilera M, Feliciangeli D, Godoy J y col 2008. Código de Bioética y Bioseguridad, Capitulo 1 y 2. Ministerio de Ciencia y Tecnología (FONACIT). 3ra. Edicion. Venezuela. [ Links ]
15. World Medical Association. Ethical principles for medical research involving human subjects. Declaration of Helsinki. Oct 2008. En: http://www.wma.net/e/policy/b3.htm. Acceso 03 de marzo de 2010. [ Links ]
16. Yan H, Yagyu F, Okitsu S, Nishio O, Ushijima H. Detection of Norovirus (GI, GII), Sapovirus y Astrovirus in fecal samples using reserve transcription single-round multiplex PCR. J Virol Methods. 2003; 114 (1): 37-44. [ Links ]
17. García D. Identification of Human and Animal Enteric viruses for determination of sources of fecal contamination in the environment. Trabado de Grado para optar al Título de Master Specialite Microbiologie, Universidad Pierre et Marie Curie, Francia. 95pp. 2009. [ Links ]
18. Pina S, Puig M, Lucena F, Jofre J, Girones R. Viral Pollution in the Environment and in Shellfish: Human adenovirus detection by PCR. Appl Environ Microbiol. 1998; 64(9): 3376-82. [ Links ]
19. Puig M, Jofre J, Lucena F, Allard A, Wadell G, Girones R. Detection of adenoviruses and enteroviruses in polluted waters by nested PCR amplification. Appl Environ Microbiol. 1994; 0(8):2963-70. [ Links ]
20. De León R, Matsui S, Baric R, Herrmann J, Blacklow N, Greenberg H, Sobsey M. Detection of Norwalk virus in stool specimens by reverse transcriptase-polymerase chain reaction and nonradioactive oligoprobe. J Clin Microbiol. 1992; 30(12):3151–7. [ Links ]
21. Griffin D, Gibson Ch, Lipp E, Riley K, Paul III J, Rose J. Detection of Viral Pathogens by Reverse Transcriptase PCR and of Microbial Indicators by Standard Methods in the Canals of the Florida Keys. Appl Environ Microbiol. 1999; 65 (9): 4118–25. [ Links ]
22. Sair A, D´Spuza D, Jaykus L. Human Enteric Viruses as causes of foodborne disease. Comp Rev Food Sci Food Safety. 2002; 1: 73-89. [ Links ]
23. Griffin D, Donaldson K, Paul J, Rose J. Pathogenic Human Viruses in Coastal Waters. Clin Microbiol Rev. 2003; 16 (1):129-43. [ Links ]
24. Castellanos M. Incidencia de Adenovirus y Calicivirus en niños menores de 5 años de la comunidad de Nazareth del Municipio Mara – Estado Zulia. Trabajo de Grado para optar al grado de Magíster Scientiarum en Microbiología. División de Estudios para Graduados, Facultad de Ciencias. La Universidad del Zulia; 2008. [ Links ]
25. Gutiérrez M, Urbina D, Matiz A, Puello M, Mercado M, Parra M, y col. Comportamiento de la diarrea causada por virus y bacterias en regiones cercanas a la zona ecuatorial. Colomb Med. 2005; 36 (3):6-14. [ Links ]
26. Castillo de Febres O, Sabatela L, Betancourt de Manrique A, Martón A, De Izaguirre J, Carrizo J, Natera I. Esquema de Inmunización en Pediatría. Recomendaciones para Venezuela. Arch Venez Pueri Pediatr. 2002; 65(1):40-2. [ Links ]
27. Gutiérrez M, Matiz A, Trespalacio A, Panra M, Mercado M. Diversidad de los virus causantes de diarrea aguda en zonas altas del trópico. Rev Latinoam Microbiol. 2006; 48 (1):17-23. [ Links ]
28. Bracho M. ¿Existen bacterias, virus y parásitos en el agua potable de la ciudad de Maracaibo?. Trabajo de Grado para optar al título de Magister Scietiarum en Microbiología. División de Estudios para Graduados, Facultad de Ciencias. La Universidad del Zulia; 2004. [ Links ]
29. Oliveros C, León D, Martínez M, Bracho M, Ludert J, García M, Botero L. Detección de Enterovirus y Calicivirus en las playas APUZ, Caimare chico, San Carlos y Quisiro del Sistema del Lago de Maracaibo. Rev Ciencias. 2006; 14(2):74-81. [ Links ]
30. Bracho M, Montiel M, Botero L. Virus Entéricos, Bacterias Entero patógenas y Organismos Indicadores de Contaminación en Camarones y en el Agua y el Sedimento de sus Bancos Naturales de Producción. Rev Ciencias. 2009; 17(1):14-24. [ Links ]
31. Pujol F, Vasquez G, Rojas A, Fuenmayor M, Loureiro C, Perez-Schael I, Estes M, Liprandi F. Norwalk virus infection in Venezuela. Ann Trop Med Parasitol. 1998; 92 ( 2): 205-11. [ Links ]
32. Parashar U, Li J, Cama R, DeZalia M, Monroe S, Taylor D, Figueroa D, Gilman R, Glass R. Human caliciviruses as a cause of severe gastroenterites in peruvian children. J Infect Dis. 2004; 190(6):1088-92. [ Links ]
33. Victoria M, Carvalho F, Heinemann L, Leite J, Miagostovich M. Prevalence and molecular epidemiology of noroviruses in hospitalized children with acute gastroenteritis in Rio de Janeiro, Brazil. Pediatr Infect Dis J. 2004; 26 (7): 602-6. [ Links ]
34. Liste M, Natera I, Suarez J, Pujol F, Liprandi F, Ludert J. Enteric Virus Infections and Diarrhea in Healthy and Human Immunodeficiency Virus-Infected Children. J Clin Microbiol. 2000; 38(8):2873-7. [ Links ]
35. Moyo S, Gro N, Kirsti V, Matee M, Kitundu J, Maselle S, Langeland N, Myrmel H. Prevalence of enteropathogenic viruses and molecular characterization of group A rotavirus among children with diarrhea in Dar es Salaam Tanzania. BMC Public Health. 2007; 7: 359-68. [ Links ]
36. Centers for Disease Control y Prevention (CDC), 2009. Noroviruses: Technical Fact Sheet. 4pp. En: http://www.cdc.gov/ncidod/dvrd/revb/enterovirus/non-polio_entero.htm. Acceso 03 de octubre de 2009. [ Links ]
37. Fine P, Carneiro I. Transmissibility and Persistence of Oral Polio Vaccine Viruses: Implications for the Global Poliomyelitis Eradication Initiative. Am J Epidemiol.1999; 150 (10): 1001-21. [ Links ]
38. Morrow A, Ruiz-Palacios G, Altaye M, Jiang X, Meinzen-Derr J, Farkas T, Chaturvedi P, Pickering L, Newburg D. Human milk oligosaccharides are associated with protection against diarrhea in breast-fed infants. J Pediatr. 2004; 145 (3): 297-303. [ Links ]
39. Chikhi-Brachet R, Bon F, Toubiana L, Pothier P, Nicolas J, Flahault A, Kohli, E. Virus Diversity in a Winter Epidemic of Acute Diarrhea in France. J Clin Microbiol. 2002; 40 (11): 4266-72. [ Links ]












 uBio
uBio