Revista de la Sociedad Venezolana de Microbiología
versão impressa ISSN 1315-2556
Rev. Soc. Ven. Microbiol. vol.33 no.2 Caracas dez. 2013
Efecto de medios de cultivo preparados con agua de mar sobre indicadores sanitarios en aguas marinas de balnearios de Chichiriviche, estado Falcón, Venezuela
Jackeline Cortez, Yassellis Ruiz, Luís Medina*, Oscar Valbuena
Centro de Investigaciones Microbiológicas Aplicadas, CIMA-UC, Facultad de Ciencias de la Salud, Universidad de Carabobo, Valencia, Venezuela.
* Correspondencia: E-mail: cima.uc@gmail.com
Resumen:
Debido a su uso por humanos y para preservar la salud pública, los ambientes marinos recreacionales, deberían cumplir requisitos de calidad fisico-química y microbiológica. Sin embargo, actividades antropogénicas, tales como agricultura, ganadería, industriales, turísticas y domésticas, pueden descargar aguas servidas en playas marinas. La metodología vigente para evaluar la carga bacteriana de aguas recreacionales, no pareciera satisfactoria, particularmente en la detección de microorganismos patógenos debido a la presencia, en aguas marinas, de bacterias viables pero no cultivables (VBNC). Este estudio evaluó la carga bacteriana de aerobios mesófilos, coliformes totales/fecales y enterococos, en playas de Chichiriviche, Falcón, Venezuela y el efecto de concentraciones de agua marina sobre las densidades bacterianas. Las determinaciones se efectuaron en agar nutritivo, Mac Conkey y KF, preparados con agua destilada (MAD) o con agua de mar 10% v/v, (MAM). La carga bacteriana se incrementó entre 20 y 47 veces cuando los medios de cultivo se suplementaron con agua de mar. Las diferencias en las cargas bacterianas entre MAD y MAM, para aerobios mesófilos, coliformes totales y fecales fueron estadísticamente significativas (p≤0,05). El oxígeno disuelto y pH, en ambos medios presentaron valores permisibles.
Palabras clave: balneabilidad, agua de mar, VBNC, coliformes totales y fecales, enterococos.
Effect of culture media prepared with sea water over health indicators in sea water of the Chichiriviche resort, Falcon State, Venezuela
Abstract:
Due to their use by humans and to preserve public health, recreational marine environments should fulfill physico-chemical and microbiological quality prerequisites. Nevertheless, anthropogenic activities such as agriculture, cattle raising, industrial, touristic and domestic, can discharge contaminated water at marine beaches. The present methods for evaluating the bacterial load of recreational waters does not appear satisfactory, especially concerning the detection of pathogenic microorganisms due to the presence, in marine waters, of viable but not cultivable bacteria (VNCB). This study evaluated the bacterial load of mesophilic aerobials, total and fecal coliforms, and enterococci at the Chichiriviche beaches, Falcon State, Venezuela, and the effect of marine water concentrations over the bacterial densities. The determinations were done in nutrient, Mac Conkey and KF agar prepared with distilled water (MAD) or with sea water (MSW). The bacterial load increased between 27 and 47 times when the culture media were supplement with sea water. The differences of the bacterial loads between MAD and MSW for mesophilic aerobials, total and fecal coliforms were statistically significant (p≤0.05). Dissolved oxygen and pH presented permissible values in both media.
Keywords: balneability, sea water, VNCB, total and fecal coliforms, enterococci.
Recibido 13 de noviembre de 2012; aceptado 10 de julio de 2013
Introducción
El hábitat preponderante del planeta lo constituyen los ambientes marinos, ocupando aproximadamente el 72% de su superficie [1]. La fuente más común de contaminación en aguas y sedimentos marinos proviene de actividades antropogénicas realizadas en tierra, las cuales incluyen descargas industriales, agrícolas y aguas domésticas servidas, problemática común en todos los países, independientemente de su nivel de desarrollo social y económico [2-4]. Tal práctica se debe fundamentalmente a dificultades logísticas y económicas asociadas al tratamiento adecuado de las aguas luego de su uso [5]. En el área del Caribe la causa más común de contaminación marina proviene de aguas domésticas servidas, originadas en centros poblados, actividades turísticas y agrícolas. Para disminuir, eliminar y controlar tal contaminación se ha adoptado un protocolo de procedimientos que intenta regular las fuentes de contaminación establecidas en tierra (Control of Land Based Source of Marine Pollution, LBS protocol) promulgado en Cartagena [6]. A los mares ingresan constantemente bacterias, algunas con diversos grados de patogenicidad para el hombre, animales y plantas, conociéndose de forma insuficiente el destino de estas bacterias una vez que ingresan al medio marino [4]. El tiempo de permanencia de bacterias potencialmente patógenas, en aguas y sedimentos marinos es relativamente largo, abarcando meses [7,8]. La situación se agrava pues las bacterias, al incursionar en estos ambientes, pueden entrar en un estado fisiológico de latencia conocido como viable pero no cultivable (VBNC, por su siglas en ingles), el cual se caracteriza por su incapacidad de formar colonias en medios de cultivo sólidos, permaneciendo viables y expresando su patogenicidad en ambientes permisibles [5,9,10] y en algunos casos, perdiendo características típicas para su identificación tradicional [11]. Esta condición fisiológica es inducida por condiciones estresantes del ambiente donde habitan los microorganismos, tales como alta salinidad (osmolaridad), cambios bruscos y bajas temperaturas, escasez de nutrientes, pH, incidencia de luz visible y ultravioleta, infección por bacteriófagos, predación por protozoarios, pudiéndose presentar cambios morfológicos en las bacterias, aumento de expresión de factores de virulencia, modificaciones superhelicoidales de plásmidos, modificaciones en la población de ribosomas y acumulación intracelular de solutos de bajo peso molecular [12-18]. La condición VBNC puede alterar e interferir con la detección de microorganismos en los ambientes evaluados [5,9,19], lo cual podría exponer a los usuarios de aguas recreacionales a riesgos de salud ocasionados por la presencia de coliformes totales y fecales, Salmonella y Vibrio cholerae [2,20]. La condición VBNC, en bacterías, ha sido descrita en aguas y arenas marinas tropicales, antárticas, ríos, lagunas y cuevas [2,5,8,9,21-23]. La metodología actual aprobada por los entes encargados de supervisar la calidad de las aguas, recomiendan la utilización de medios de cultivo sólidos (agar Mac Conkey, agar KF, agar nutritivo), para la detección y cuantificación de coliformes totales y fecales, enterococos y aerobios mesófilos, respectivamente [24]. Estos medios contienen bajas concentraciones salinas y a algunos de ellos se le adicionan sustancias que los convierten en medios restrictivos para los grupos bacterianos, en condiciones de temperatura establecidas. El ambiente marino por su relativa alta salinidad, su variable temperatura, escasez de nutrientes, entre otros, constituye un hábitat estresante y restrictivo, provocando, en la población bacteriana asociada a él, cambios subletales y estructurales que establecen situaciones no aptas para su cuantificación (incapacidad de sustentar la división celular y no formar colonias), cuando son transferidas a medios de cultivo in vitro, sólidos o líquidos. Existen reportes que indican que bacterias entéricas humanas, VBNC, pueden formar colonias en medios no selectivos y que bacterias típicas del medio marino (aguas, sedimentos y plantas), no asociadas a animales, pueden mimetizar las características de coliformes en placas de agar suplementado con sales biliares, lo cual interfiere con la determinación de la carga bacteriana en este último grupo [25,26]. En el presente estudio se determinó el crecimiento de bacterias aeróbicas mesófilas, coliformes (totales y fecales) y enterococos, en muestras de agua de mar provenientes de cuatro playas de Chichiriviche, estado Falcón, Venezuela, en medios de cultivo (agar nutritivo, agar Mac Conkey y agar KF) siguiendo el método estándar (preparados en agua destilada) y una modificación de tal método (medios suplementados con agua de mar), con el objeto de comparar el efecto del agua de mar en los medios de cultivo y su influencia sobre la carga bacteriana.
Materiales y métodos
Área de estudio y muestreo: El estudio se realizó en la zona costera de Chichiriviche, municipio Iturriza, estado Falcón, Venezuela. Las muestras se recolectaron en cuatro balnearios de la zona: playa Norte, playa Sur (Fábrica de Cemento), Puerto Adentro (playa Los Cocos) y Plaza de Los Niños. El muestreo se efectuó una vez al año, en agosto, por dos años consecutivos (2006 y 2007). En playa Norte y playa Sur, por ser los balnearios de mayor superficie, se recolectaron muestras en 6 puntos de las playas, en Puerto Adentro y Plaza de Los Niños 4 y 3 muestras, respectivamente. Las muestras se recogieron a 14 m de la orilla de las playas, a un metro de profundidad y en horas de la mañana. La situación geográfica de los puntos de muestreo se estableció con un equipo GPS y se detallan en la figura 1.
Toma de muestras: Las muestras se recolectaron en botellas de vidrio ámbar de 3,8 L de capacidad, esterilizadas, dejando una cámara de aire de 2,5 cm, cerradas herméticamente y trasladadas al laboratorio, sobre hielo, procesándose en un lapso no mayor a las 8 h después de haber sido recolectadas [24].
Determinación de parámetros fisicoquímicos: La temperatura, pH y oxígeno disuelto, se determinaron in situ, usando un termómetro digital, un medidor de pH (Checher by Hanna) y un medidor de oxígeno (Dissolved oxygen/°C meter, DO 100 series, OAKTON®), respectivamente.
Viabilidad de cultivos bacterianos en presencia de agua de mar: La viabilidad de las bacterias presentes en las muestras de agua de mar de Chichiriviche, se evaluó en agar Mac Conkey (HIMEDIA, M083) y agar KF (Kennel fecal, Merck 10707), mediante la técnica de membrana filtrante. A tales efectos se procedió de la siguiente manera: una muestra compuesta de agua de mar, preparada al mezclar volúmenes iguales de las aguas marinas provenientes de las cuatro playas en estudio, se diluyó con agua destilada estéril a concentraciones finales de 10, 20, 30, 40, 50, 60, 70, 80 y 90% v/v; posteriormente se prepararon placas de agar Mac Conkey y KF, utilizándose las diferentes diluciones de agua de mar (10-90%) y la mezcla compuesta sin diluir (100%), esterilizándose los medios a 121 ºC, 15 libras de presión durante 15 min. Volúmenes de 100 mL de diferentes diluciones de agua de mar (sin esterilizar) se filtraron a través de membranas de ésteres de celulosa, de 47 mm de diámetro y 0,45 μm de diámetro de poro (Advantec, Toyo Roshi Kaisha, Japón). Las membranas se incubaron sobre placas de agar Mac Conkey a 37 y 44 ºC para la determinación de coliformes totales (CT) y fecales (CF) respectivamente y en agar KF a 37 ºC para los enterococos (E). El contaje de colonias se realizó, luego de 24 a 48 h de incubación, en un contador de colonias (Colony Counter 560 Suntex), en las membranas que contenían entre 20 y 80 colonias. Luego de considerar las diluciones, se calculó el número de colonias por 100 mL de agua de mar sin diluir. Para efectos comparativos, estas experiencias se repitieron con medios preparados con agua destilada.
Determinación de la carga bacteriana en aguas marinas: La determinación de la carga bacteriana de las muestras de agua de mar se realizó usando el método de vertido en placa para los mesófilos aerobios (AM) y la técnica de concentración por filtración sobre membrana para CT, CF y E. Para efectos de comparación, las determinaciones también se realizaron de acuerdo a la técnica estándar (sin agua de mar). Los datos referentes a las determinaciones en presencia de agua de mar se reportan bajo la denominación de técnica modificada y se compararon con los resultados obtenidos por la técnica estándar.
Aerobios mesófilos (método vertido en placa): Alícuotas estudio, se cultivaron en placas de Petri, con 15 mL de agar nutritivo (HIMEDIA, M088) preparado con la mezcla de agua de mar a una concentración final del 10% v/v (técnica modificada) o preparado con agua destilada (técnica estándar), incubándose en estufa a 37 °C y luego de 24 h, se determinó la carga bacteriana. Tomando en consideración los volúmenes ensayados se calculó la carga bacteriana en UFC/100 mL de agua de mar.
Coliformes (método concentración por filtración sobre membranas): Volúmenes de agua de mar pura o diluida, con agua destilada estéril, se filtraron a través de membranas de ésteres de celulosa, de 47 mm de diámetro y 0,45 μm de diámetro de poro (Advantec, Toyo Roshi Kaisha, Japón). Para estas determinaciones se procedió de la siguiente manera: con la técnica estándar, 100 mL de agua de mar pura se filtraron, a vacío reducido, y la membrana se incubó sobre una placa de agar Mac Conkey, preparado con agua destilada estéril. Con la técnica modificada, agua de mar se diluyó con agua destilada estéril, a concentraciones finales de 1, 5 y 10% v/v, filtrándose 100 mL de cada dilución, luego la membrana se incubó sobre una placa de agar Mac Conkey, preparado con agua de mar al 10% v/v. Las placas se incubaron a 37 °C (CT) y 44 °C (CF) durante 24 h. El recuento de colonias (UFC/100 mL) se realizó, en las membranas que contenían entre 20 y 80 colonias, en un contador automatizado de colonias.
Enterococos (método de concentración por filtración fue similar al descrito para coliformes, pero las membranas de celulosa se incubaron en placas de agar KF, a 37 °C durante 48 h.
Identificación de cepas bacterianas. Las colonias obtenidas mediante filtración sobre membranas se sembraron en placas de agar infusión cerebro corazón (HIMEDIA, BHI; M210I) conteniendo cantidades decrecientes de agua de mar (7, 4 y 1%), cultivándose por 24 h a 37 ºC, con la finalidad de aclimatar las cepas a los medios de cultivo estándar y para su posterior identificación mediante pruebas bioquímicas tradicionales (oxidasa, catalasa) y galerías API D32GN, siguiendo las indicaciones del fabricante, leyéndose en un equipo Mini API (Biomérieux modelo INS005039).
Análisis estadístico: Se utilizó la prueba estadística no paramétrica de Mann-Whitney, para determinar la existencia de diferencias significativas entre los resultados obtenidos con la técnica estándar y la técnica modificada. Los cálculos se efectuaron empleando el programa SPSS versión 12.
Resultados
Parámetros fisicoquímicos: Los valores promedios y desviaciones estándar de los parámetros determinados en las playas evaluadas se detallan en la tabla 1. El promedio de temperatura para cada playa osciló entre 26,4 °C (playa Plaza de Los Niños) y 31,5 °C (playa Sur), con un valor promedio para el muestreo I de 29,1 °C, mientras que para el muestreo II los valores mínimo, máximo y promedio fueron 30,0 (playa Sur); 34,4 (playa Norte) y 31,5 °C, respectivamente. Los valores de pH, a excepción del registrado en la playa Plaza de Los Niños en el muestreo I, el cual fue de 10,1, se ubicaron en el intervalo permisible según el Decreto 883 (6,5-8,5), registrándose valores comprendidos entre 7,9 (playa Sur) y 8,5 (playa Puerto Adentro). La variación de pH en el muestreo II no superó 0,05 unidades, y su valor promedio fue de 8,2. En el muestreo I la variación de pH fue mayor, alcanzando valores de hasta 2 unidades (playa Sur respecto a playa Plaza de Los Niños), obteniéndose un promedio de 8,7, ligeramente superior al máximo permitido. La concentración de oxígeno disuelto, en todos los casos, superó el valor límite mínimo permisible (>5 mg/L). Los valores mínimo y máximo detectados fueron 5,3 y 9,2 mg/L en Plaza de Los Niños y los promedios para los muestreos I y II fueron 5,9 y 8,4 mg/L, respectivamente.
Viabilidad bacteriana en medios sólidos suplementados con agua de mar: El efecto que ejerce el agua de mar sobre la carga bacteriana (UFC/100 mL), se reporta en la tabla 2. En el caso de CT se evidenció una estimulación a concentraciones de agua de mar de 10-50% v/v, obteniéndose un valor máximo de 13.800 UFC/100 mL, en el sistema a 10%, mientras en el sistema control (0% de agua de mar) la carga bacteriana fue de 5.400 UFC/100 mL Para CF las cargas bacterianas fueron de 10.200 y 8.000 UFC/100 mL, en los medios al 10% y 0%, respectivamente; en el caso de E, se alcanzaron valores de 58.800 UFC/100 mL en presencia de agua de mar 10% y en su ausencia se obtuvieron valores de 4.280 UFC/100 mL.
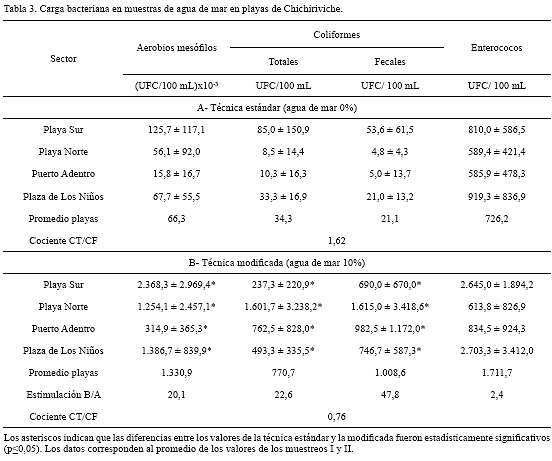
Carga bacteriana en las muestras de aguas de mar. Después de constatar que el agua de mar, incorporada a una concentración del 10 % v/v a los medios de cultivo, ejerció un efecto estimulatorio sobre la viabilidad microbiana, se procedió a determinar la carga bacteriana correspondiente a AM, CT, CF y E, en las aguas recolectadas en las playas seleccionadas, utilizando en la técnica modificada el 10% de agua de mar para formular los medios de cultivo. En las tabla 3 se observan los valores promedios de la carga bacteriana (UFC/100 mL) y sus respectivas desviaciones estándar, bajo condiciones definidas como técnica estándar y técnica modificada. Además, se incluye el promedio para cada grupo bacteriano en cada playa, la respectiva estimulación sobre la carga bacteriana y el cociente CT/CF. En ambos muestreos, se observó un incremento de la carga bacteriana en los grupos microbianos estudiados, cuando los medios de cultivo se suplementaron con agua de mar 10% v/v. El incremento en la carga bacteriana, en AM, CT y CF, expresada por la estimulación, se ubicó en el intervalo de 20-48, siendo los CF el grupo que mostró el mayor índice de estimulación, 47,8 y el grupo E el menor índice (2,4). En la tabla 3 se muestra que con la técnica estándar la proporción de CT/CF es mayor que 1, mientras que con la técnica modificada la proporción fue inferior a 1. El análisis estadístico Mann-Whitney reveló que en AM, CT y CF, las diferencias observadas en las cargas bacterianas, promedio y en los muestreos individuales, entre las dos técnicas fueron significativas, (p≤0,05). Aunque, para E las diferencias promedio no fueron estadísticamente significativas, el análisis individual de los muestreos I (2006) y II (2007) indicaron diferencias significativas en el muestreo I pero no en el II (datos no mostrados). Debe notarse que, de 16 comparaciones realizadas entre la técnica estándar y la modificada (tabla 3), en 12 de ellas (las correspondientes a AM, CT y CF), las diferencias entre las cargas bacterianas resultaron estadísticamente significativas. La excepción ocurrió en el grupo E. Un aspecto a resaltar es que los CT predominaron sobre los CF cuando se determinaron por la técnica estándar, pero la situación se invirtió con la técnica modificada. De acuerdo a la técnica estándar, las cargas bacterianas para CT y CF fueron 34,3 y 21,1 UFC/100 mL (CT/CF=1,62), respectivamente, mientras que en la técnica modificada tales valores fueron 770,7 y 1008,6 UFC/100 mL (CT/CF=0,76), respectivamente.
Cepas bacterianas identificadas en muestras de agua de mar: Las cepas bacterianas detectadas se pudieron ubicar en cuatro grupos de acuerdo a su presencia/ausencia en las muestras de agua evaluadas. En el primer grupo, Escherichia coli y Enterococcus faecalis se identificaron en ambos muestreos y en todas las playas. El segundo grupo, detectado en 3 de las 4 playas estudiadas, estuvo constituido por Enterobacter cloacae, Enterobacter aerogenes y Pseudomonas aeruginosa. El tercer grupo, constituido por Klebsiella pneumoniae, Pseudomonas putida, Pseudomonas fluorescens y Vibrio alginolyticus, se detectó en 2 de las 4 playas. Finalmente, en el cuarto grupo y con una única presencia en las playas, se detectaron Serratia ficaria, Serratia odorifera, Enterococcus faecium, Klebsiella oxytoca, Klebsiella terrigenas, Comamonas sp, Chryseobacterium meningosepticum, Alcaligenes faecalis y Aeromonas sobria.
Discusión
Las características físicoquímicas determinadas en balnearios de Chichiriviche (tabla 1), cumplen con las especificaciones vigentes del Decreto 883 en términos de pH y oxígeno disuelto [27]. Esto indica que las aguas costaneras no contienen materiales que tiendan a modificar la acidez ni la cantidad de oxígeno de las aguas, situación que puede originarse por la presencia de cantidades inapropiadas de materia orgánica disuelta/suspendida en el agua. La diferencia en la concentración de oxígeno detectada en los dos muestreos podría significar variaciones de la flora acuática marina al tiempo de la recolección de las muestras, lo cual ocurrió con un año de diferencia. En términos generales la incorporación de agua de mar a los medios de cultivo (agar Mac Conkey y KF), a concentración final de 10% v/v, generó mayor carga bacteriana en los tres grupos bacterianos evaluados (tabla 2), obteniéndose valores de estimulación de 2,6, 1,3 y 13,7 para CT, CF y E respectivamente. La estimulación detectada podría implicar la recuperación de la capacidad de sustentar la división celular y la formación de colonias, por las poblaciones bacterianas cultivadas en presencia de agua de mar, y no a cantidades diferentes de organismos inicialmente sembrados en los medios de cultivo. Así, las diferencias detectadas en la carga bacteriana, entre los medios estándar y modificado, se debe probablemente a la condición VBNC de las bacterias provenientes de medios marinos y su posterior transferencia a medios de cultivo menos estresantes y restrictivos donde puede reiniciarse la división celular, situación que está bien demostrada por otros autores [5,12,14,15,19,20]. Pareciera que el agua de mar al 10% de alguna manera disminuyera las condiciones restrictivas de los medios de cultivo usualmente empleados para el cultivo de AM, CT y CF potenciando la división celular. Una posibilidad sería que la presencia de cationes bivalentes (Ca y Mg, fundamentalmente), incorporados por el agua de mar, disminuyese los niveles de sales biliares al formar quelatos insolubles, reduciendo las propiedades restrictivas del medio de cultivo y permitiendo la proliferación de bacterias VBCN o la proliferación de bacterias típicas del ambiente marino que simulan la morfología típica de CF [1,5]. Existen reportes que indican la existencia de bacterias no fecales, típicas de ambientes marinos, incluidos suelos, vegetación y aguas, con capacidad de duplicación en las condiciones experimentales de laboratorio usadas para el cultivo de CF [25,26,28]. Un factor que podría estar implicado en la elevada proliferación bacteriana en medios suplementados con agua de mar, es la presión osmótica. Así, las bacterias podrían estar reprimidas en el ambiente marino debido a la relativamente alta presión osmótica, y al transferirse a medios con menor presión osmótica, podrían incrementar su tasa de división celular, favoreciéndose particularmente los CF. Otra posibilidad, sería la presencia de sustancias no identificadas presentes en el agua de mar, que induciría la duplicación bacteriana. El efecto estimulante del agua de mar al 10 % ha sido reportado cuando CT, CF y E, obtenidos de agua costaneras de mar, se cultivaron en medio BHI [29]. Los datos tienden a indicar que el aumento en la población viable bacteriana se ejerce independientemente del medio de cultivo empleado para crecer estos grupos bacterianos, pues se detectó en agar nutritivo, agar Mac Conkey, agar KF y medio BHI, todos suplementados con agua de mar. Las cepas bacterianas detectadas en las playas estudiadas, con la excepción de Comamonas sp, habitan en el intestino de humanos y de diversas especies animales (mamíferos, aves, batracios, peces e insectos) y en plantas [30]. Usualmente pueden encontrarse en ambientes terrestres, marinos y estuarianos con variable salinidad. En general causan infecciones en humanos, animales y plantas, siendo también responsables del envenenamiento de alimentos, particularmente, pescados y mariscos [27,30]. El decreto 883 de la República de Venezuela de fecha 18-12-95, establece los niveles máximos permisibles para CT y CF, en términos del número más probable (NMP) de bacterias por 100 mL de muestra, para aguas destinadas a balnearios, deportes acuáticos, pesca deportiva, comercial y de subsistencia, incluyéndolas en el tipo 4 [27]. En el subtipo 4A, aguas de contacto humano total, se establece un máximo de 1000 NMP y 200 NMP para CT y CF respectivamente. Los valores reportados en este estudio indican que la carga bacteriana se incrementa por factores de 20, en el menor de los casos (AM y CT) alcanzando valores de 47 (CF) cuando los medios de cultivo son suplementados con agua de mar. Sin embargo, es difícil una comparación entre los valores permisible oficiales establecidos y expresados como NMP y los obtenidos en este trabajo, expresados en UFC/100mL. Aunque valores para E no han sido establecidos en la legislación venezolana, la Agencia de Protección Ambiental de Estados Unidos (USEPA) y la Comunidad Europea (EEC) consideran como niveles permisibles máximos 35 y 100 microorganismos por 100 mL, respectivamente [31]. La carga microbiana correspondiente al grupo E en las playas evaluadas superó ampliamente los niveles señalados en estos países y adicionalmente, superó la obtenida para CT y CF, en ambos muestreos. Esta particularidad ha sido también reportada en playas de Tucacas, estado Falcón, sugiriendo que los enterococos pudiesen ser los mejores indicadores de contaminación fecal en aguas marinas, debido a su mayor tolerancia a la salinidad y luz solar [32]. En estudios realizados en el lago de Maracaibo la carga bacteriana de E. coli fue alta en las áreas de mayor salinidad, lo cual podría estar de acuerdo con los resultados mostrados en este estudio [33]. Las elevadas cargas bacterianas detectadas con la técnica modificada debería constituir un llamado de alerta, para los organismos encargados de supervisar la calidad de las aguas marinas recreacionales [20]. Esta situación ha sido reportada en múltiples estudios, citados en la bibliografía consultada, lamentablemente no ha sido considerada por los entes respectivos. Consecuentemente, por las dificultades en el aislamiento y crecimiento, en cultivos puros, de la mayor parte de los procariotas marinos, la búsqueda de medios de cultivo que permitan el crecimiento en el laboratorio de estos organismos, parece pertinente [34-36]. Por lo tanto, deberían de tomarse las previsiones inherentes para la determinación de la carga bacteriana y viabilidad en ambientes marinos, lo cual probablemente involucrará la aprobación de nuevas tecnologías [11,19]. En conclusión, los datos presentados en este estudio demuestran que en muestras de agua de mar costaneras, la carga bacteriana expresada como UFC/100 mL, en bacterias AM, CT y CF se incrementa significativamente, cuando estos grupos bacterianos son cultivados en agar nutritivo y Mac Conkey suplementados con agua de mar a una concentración final de 10% v/v.
Referencias
1. Orozco-Barrenetxe C, Pérez-Serrano A, González-Delgado MN, Rodríguez-Vidal FJ, Alfayate-Blanco MM. Contaminación Ambiental. Una visión desde la Química. Madrid, España: Thomson Editores Spain Paraninfo S.A.; 2004. [ Links ]
2. Aydin A, Kahraman T, Aydin H. The microbiological and physico-chemical parameters with trace metal pollution of coastal water in Dardanelles and Thracian Sea. J Anim Veterin Adv. 2010; 8:1077-82. [ Links ]
3. Hernroth B, Lothigius A, Bölin I. Factors influencing survival of enterogenic Escherichia coli, Salmonella enterica (serovar Thyphimurium) and Vibrio parahaemolyticus in marine environments. FEMS Microbiol Ecol. 2010; 71:272-80. [ Links ]
4. Belkin S, Colwell RR. Ocean and health: Pathogens in the marine environment. USA: Springer Editor; 2010. [ Links ]
5. Smith JJ, Howinton JP, Mc Feters GA. Survival, physiological response, and recovery of enteric bacteria exposed to a polar marine enviroment. Appl Environ Microbiol. 1994; 60:2977- 84. [ Links ]
6. United Nations Environment Programme (UNEP). The Caribbean Environment Programme. Marine and coastal issues, wasterwater, sewage and sanitation. Technical Report No. 20. Environmental problems affecting the marine and coastal environmentin the wider Caribbean region. 1993. Technical Report No. 33. Regional overview of land-based sources of pollution in the wider Caribbean region. 1994. [ Links ]
7. Acuña AJ, Torres CF, Pucci GN, Pucci DH. Evaluación del tiempo de vida de bacterias potencialmente patógenas en sedimentos marinos. Rev Soc Ven Mirobiol. 2011; 31:124-9. [ Links ]
8. Campbell JW, Watson A, Watson C, Ball H, Pirkle R. Escherichia coli, other coliform and environmental chemoheterotrophic bacteria in isolated water pools from six caves in northern Alabama and northerwestern Gerogia. J Cave and Karst Studies. 2011; 73:75-82. [ Links ]
9. Seeligmann CT, Mirande V, Fracanna BC, Silva C, Aulet O, Cecilia M, Bingztrin N. Phytoplankton linked viable non culturable Vibrio cholerae O, (VNC) from rivers in Tucumam, Argentina. Plankton Res. 2008; 30:367-77. [ Links ]
10. Gourmelon M, Pommepuy M, Touati D, Cormier M. Survival of Escherichia coli exposed to visible ligth in seawater: analysis of rpoS-dependent effects. Can J Microbiol. 1997; 43:1036-43. [ Links ]
11. Ben Abdallah F, Chaieb K, Snoussi M, Bakhrouf A, Gaddour K. Phenotypic variations and molecular identification of Salmonella enterica serovar Thyphimurium cells under starvation in seawater. Curr Microbiol. 2007; 55:485-91. [ Links ]
12. Darcan C, Özkanga R, Idil O, Flint KP. Viable but non culturable state of Escherichia coli related to EnvZ under the effect of pH, starvation and osmotic stress in seawater. Pol J Microbiol. 2009; 58:307-17. [ Links ]
13. Nystrom T, Flardh K, Kjelleberg S. Response of multiplenutrient starvation in marine Vibrio sp CCUG 15956. J Bacteriol. 1990; 172:7085-97. [ Links ]
4. López-Torres AJ, Prieto L, Hozen TC. Comparison of the in situ survival and activity of Klebsiella pneumoniae and Escherichia coli in tropical marine environments. Microbiol Ecol. 1988; 15:41-57. [ Links ]
15. Xu HS, Robert N, Singleton FL, Attwel RW, Grimes DJ, Colwell RR. Survival and viability of non culturable Escherichia coli and Vibrio cholera in the estuarine and marine environments. Microbiol Ecol. 1982; 8:313-23. [ Links ]
16. Couter A. Plasmid DNA supercoiling and survival in longterm cultures of Escherichia coli: Role of NaCl. J Bacteriol. 2003; 185:5324-27. [ Links ]
17. Flardh K, Cohen PS, Kjelleberg S. Ribosome exist in large excess over apparent demand for proteín synthesis during carbon starvation in marine Vibrio sp strain CCUG 15956. J Bacteriol. 1990; 174:6780-8. [ Links ]
18. Gauthier MJ, Le Rudulier D. Survival in seawater of Escherichia coli cells grown in marine sediments containing glycine betaine. Appl Environ Microbiol. 1990; 56:2915-8. [ Links ]
19. Luna GM, Vignaroli C, Rinaldi C, Pusceddu A, Nicoletti L, Gabellini M, Danovaro R, Biavasco F. Extraintestinal Escherichia coli carrying virulence genes in coastal marine sediments. Appl Environ Microbiol. 2010; 78:5659-68. [ Links ]
20. Rowan NJ. Defining established and emerging microbiol risks in the aquatic environments: Current knowledge, implications and outlooks. Int J Microbiol. 2011; ID 262832 (15 p). [ Links ]
21. Vignaroli C, Luna GM, Rinaldi C, Di Cesare A, Danovaro R, Biavasco F. New sequence types and multiple resistance among pathogenic Escherichia coli isolates from coastal marine sediments. Appl Environ Microbiol. 2012; 78:3916-22. [ Links ]
22. González M, Villalobos LB, Vásquez-Suárez A, Grau C, Gil H. Aerobios mesófilos, coliformes fecales, Clostridium en ostras, Laguna Grande del Obispo Sucre, Venezuela. Rev Cient FCV-LUZ. 2011; 21:80-7. [ Links ]
23. Halliday E, Gast RJ. Bacteria in beach sand: an emerging challenge in protecting coastal water quality and bath-health. Environ Sci Technol. 2011; 45:370-9. [ Links ]
24. Clesceri LS, Greenberg AE, Eaton AD, editors. Standard methods for the examination of water and wastewater 20th edition. Washington DC, USA: APHA American Public Health Association; 1998. [ Links ]
25. Ferguson D, Signoretto C. Enviromental persistance and naturalization of fecal indicator organisms. In: Hagedorn C, Blanch AR, Harwood VI, editors. Microbial source tracking: Methods, applications and case studies 1st ed. Germany: Springer; 2011. p 379-97. [ Links ]
26. Hackney CR, Ray B, Speck ML. Repair detection procedure for enumeration of fecal coliforms and enterococci from sea food and marine environments. Appl Environ Microbiol. 1979; 37:947-53. [ Links ]
27. Decreto 883. Normas para la clasificación y control de la calidad de los cuerpos de agua y vertidos o efluentes líquidos. Gaceta Oficial de la República de Venezuela. 1995; No. 5.021. Extraordinaria, 18-12-95. [ Links ]
28. Wagner-Döbler I, Biebl H. Environmental biology of marine Roseobacter lineage. Ann Rev Microbiol. 2006; 60:255-80. [ Links ]
29. Cortez J. Evaluación bacteriológica y físico-química de las aguas recolectadas procedentes de balnearios ubicados en Chichiriviche, estado Falcón, Venezuela. Tesis de Maestría. Post Grado en Medicina Veterinaria. Facultad de Ciencias Veterinarias, Universidad Central de Venezuela. Maracay, Venezuela; 2009. [ Links ]
30. Holt J, Krieg N, Sneath PH, Staley JT, Williams ST. Bergeys Manual of Determinative Bacteriology. 9a ed. Philadelphia, USA: Lippincott, Williams & Wilkins; 2000. [ Links ]
31. Salas H. History and application of microbiological water quality standards in marine environmente. Water Sci Technol. 1986; 18:1-23. [ Links ]
32. Herrera A, Suárez P. Indicadores bacterianos como herramientas para medir la calidad ambiental del agua costera. Interciencia. 2005; 30:171-8. [ Links ]
33. Boscán L, Capote F, Farías J. Contaminación salina del lago de Maracaibo: Efectos en la calidad y aplicaciones de sus aguas. Bol Centro Invest Biol. 1973; 9:11-31. [ Links ]
34. Rappé MS, Giovannoni SJ. The uncultured microbial majority. Ann Rev Microbiol. 2003; 57:360-94. [ Links ]
35. Rappé M, Connon SA, Vergin KL, Giovannoni SJ. Cultivation of the ubiquitous SAR11 marine bactorioplankton. Nature. 2002; 418:630-3. [ Links ]
36. Button DK, Schut F, Quang R, Martin R, Robertson BR. Viability and isolation of marine bacteria by dilution culture: theory, procedure and initial results. Appl Environ Microbiol. 1993; 59:881-91. [ Links ]












 uBio
uBio