Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro v.17 n.2 Barquisimeto abr. 2005
CAMBIOS EN EL CONTENIDO DE FÓSFORO EN EL SUELO SUPERFICIAL POR LA CONVERSIÓN DE SABANAS EN PINARES
Ismael Hernández-Valencia1 y Montserrat Bautis1
RESUMEN
Se evaluaron los cambios en fracciones de P, la actividad de fosfatasas ácidas y la adsorción de fosfatos producidos por el establecimiento de una plantación de pinos en suelos de sabanas, ácidos y arenosos. Luego de 24 años, se encontró un incremento en el contenido de materia orgánica y su fracción ligera en el suelo superficial que influyó en una mayor capacidad para adsorber fosfatos. Dentro de las fracciones químicas y microbiológicas, sólo hubo un incremento significativo del Po moderadamente lábil (Po-NaOH) que en valor absoluto fue pequeño e indica que el establecimiento de pinares ha tenido bajo impacto sobre las distintas fracciones del P. La relación Pi biodisponible/Po mostró una mayor deficiencia de P en el pinar, y en consecuencia un ciclaje más rápido de éste para satisfacer los requerimientos nutricionales del ecosistema. Sin embargo, esta deficiencia de Pi biodisponible no se correlacionó con una mayor actividad de las fosfatasas ácidas. Este hallazgo apoya estudios previos en donde se ha determinado que en suelos pobres en Po, la actividad de fosfatasas ácidas es una buena medida de la mineralización potencial, pero no de la mineralización real de Po.
Palabras clave adicionales:
Pinus caribea, oxisol, fraccionamiento de P, actividad fosfatásica, adsorción de PChanges in phosphorus content in the topsoil by the conversion of savanna to pine forest
ABSTRACT
We assessed the changes in P fractions, acid phosphatase activity, and phosphate sorption by the establishment of a pine forest on an acidic, sandy savanna soil. After 24 years, it was found an increase in organic matter and its light fraction content in the topsoil, which in turn influenced the phosphate sorption capacity. Among the different chemical and microbiological P fractions, only the organic moderately labile pool (Po-NaOH) showed a small but significant increase and indicates that the establishment of the pine forest has had a low impact on the different P fractions. The bioavailable Pi/Po ratio showed a higher P deficiency for the pine forest and consequently a more rapid cycling to satisfy P requirements in this ecosystem. However, P deficiency did not correlate with phosphatase activity. This finding supports previous studies where it has been determined that phosphatase activity is a good indicator of potential mineralization, but not for real Po mineralization rates.
Additional key words: Pinus caribea, oxisol, P fractionaction, phosphatase activity, P sorption
INTRODUCCIÓN
Por su extensión y por el desarrollo de diversas actividades agrícolas, pecuarias y forestales, las sabanas representan un aporte sustancial en las economías de países como Brasil, Colombia y Venezuela (Thomas y Ayarza, 1999). Ello justifica el cúmulo de investigaciones realizadas sobre los diferentes sistemas de producción que se encuentran en estos ecosistemas, con el fin de determinar cuales generan no sólo una mayor productividad y rentabilidad, sino también una mayor sostenibilidad ecológica. En Venezuela, en el año de 1969, la Compañía Nacional de Reforestación (CONARE) implementó un programa de desarrollo forestal al sur del estado Monagas, donde se introdujeron plantaciones de pino caribe (Pinus caribea Morelet. var. Hondurensis Barr & Golf.) en sabanas con suelos arenosos y ácidos que anteriormente eran dedicados a la ganadería extensiva y a cultivos de subsistencia. La selección de esta especie se basó en sus bajos requerimientos nutricionales, tolerancia a la sequía y en la posibilidad de dar un uso más rentable de la tierra, ya que permitía la producción de pulpa de papel y madera para la creciente demanda nacional. Luego de más de 30 años, la superficie boscosa de pinos alcanza más de 610.000 ha, lo que la convierte en la plantación monoespecífica tropical más grande (Cedeño et al., 2001) y existen planes para incorporar nuevas áreas en los próximos años. Este cambio en el uso de la tierra amerita una evaluación para determinar el efecto de la introducción de pinares, en la que los suelos constituyen uno de los componentes de mayor importancia dentro del ecosistema.
En los suelos ácidos de sabanas, la deficiencia de fósforo ha sido reconocida como una de las limitaciones más importantes para la producción vegetal (San José y García-Miragaya, 1981; Goedert, 1983) y se genera por la alta reactividad de los fosfatos inorgánicos con los oxihidróxidos de hierro y aluminio (Fontes y Leed, 1996). Bajo estas condiciones, el P orgánico puede constituir una fuente importante de P disponible para las plantas que usualmente no es considerado en los análisis rutinarios de fertilidad (Beck y Sánchez, 1994). Se ha demostrado que los cambios en el uso de la tierra pueden provocar modificaciones en el ciclaje de materia orgánica y nutrimentos, y por lo tanto en la disponibilidad del fósforo para las plantas (Lilienfein et al., 2002). En el caso del P, el uso de métodos de fraccionamiento es una herramienta útil para determinar el capital de P en el suelo, pero especialmente la cuantía de diferentes reservorios con disponibilidad inmediata, a mediano y a largo plazo para las plantas. Los cambios que se producen sobre las diferentes fracciones bajo un tipo de manejo particular permiten establecer en cual de estos compartimientos han ocurrido las transformaciones más importantes, como afectan la fertilidad fosfórica y en consecuencia la sostenibilidad de la práctica evaluada. En el presente estudio se evaluaron los efectos producidos en los contenidos de P por el cambio de uso de sabanas a pinares sobre suelos arenosos y ácidos a través del uso del método de fraccionamiento de P, junto con otros indicadores químicos, físicos y biológicos de fertilidad.
MATERIALES Y MÉTODOS
El estudio fue realizado en la plantación de pinos perteneciente a CVG-Proforca ubicada en la localidad de Uverito, estado Monagas, Venezuela (8º, 30´N, 62º, 38´W). Este desarrollo forestal está localizado en una planicie de sedimentos aluviales, cuyos suelos fueron identificados como Psammentic Haplustox, francosa fina silícica, de muy fuerte a fuertemente ácidos, de baja fertilidad natural (Cuadro 1). La precipitación media anual del área de estudio es de 1300 mm y la temperatura media anual de 26,1º C. La vegetación silvestre corresponde a una sabana, la cual se encuentra dominada por la gramínea Trachyogon plumosus, mientras que el componente leñoso es disperso y está representado por Curatella americana.
. Características físicas y químicas de los suelos de sabana y pinar en los primeros 10 cm de suelo mineral (n=6)
| Parámetro | Sabana | Pinar |
| Densidad aparente (g∙cm-3) | 1,5 a | 1,5 a |
| Arena (g∙kg-1 de suelo) | 950 a | 949 a |
| Limo (g∙kg-1 de suelo ) | 10,0 b | 11,0 b |
| Arcilla (g∙kg-1 de suelo) | 40,0 c | 40,0 c |
| pH | 5,2 a | 4,8 b |
| C orgánico (g∙kg-1 de suelo) | 3,3 a | 5,1 b |
| N (mg∙g-1 de suelo) | 0,15 a | 0,22 b |
| Al (cmol+∙kg-1 de suelo) | 0,35 a | 0,37 a |
| H (cmol+∙kg-1 de suelo) | 0,16 a | 0,21 b |
| Mg (cmol+∙kg-1 de suelo) | 0,08 a | 0,05 b |
| K (cmol+∙kg-1 de suelo) | 0,03 a | 0,04 a |
| Ca (cmol+∙kg-1 de suelo) | 0,09 a | 0,09 a |
| Na (cmol+∙kg-1 de suelo) | 0,04 a | 0,03 a |
| CIC (cmol+∙kg-1 de suelo) | 0,75 a | 0,77 a |
Medias dentro de una misma fila seguidas por una misma letra no son significativamente diferentes (t student, P≤0,05).
Para el estudio se ubicaron dos parcelas de 0,2 ha separadas entre si por 50 m, de las cuales una se encontraba en una sabana y la otra en un rodal de pinos (Pinus caribea Morelet. var. Hondurensis Barr & Golf.) establecido hace 24 años. El rodal de pino no recibió fertilización, excepto las plántulas durante su desarrollo en el umbráculo, las cuales recibieron una dosis por planta de 0,3 g de fosfato de amonio, 0,6 g de sulfato de amonio, 0,6 g de cloruro de potasio y 0,3 g de sulfato de magnesio. En cada parcela fueron tomadas seis muestras de suelo al azar con un muestreador tipo Uhland en los primeros 10 cm de profundidad correspondiente al horizonte A. Una porción de las muestras fue secada al aire para los análisis de materia orgánica, pH, textura, nutrimentos, fraccionamiento de P y adsorción de fosfatos, mientras que la otra fue refrigerada a 4 ºC para los análisis de fósforo microbiano y actividad fosfatásica. Los parámetros seleccionados se evaluaron en el suelo superficial, ya que estudios previos mostraron que en zonas más profundas del perfil no se detectaron diferencias en las características físicas y químicas (Campos, 1999; Bautis, 1999). Por otra parte, el suelo superficial recibe los mayores aportes de materia orgánica y posee la mayor actividad biológica, lo cual permite evidenciar mejor en el corto plazo, los cambios en el uso de la tierra.
Cuadro 2. Distribución de las fracciones de P en los primeros 10 cm del suelo mineral
| Fracción | Sabana | Pinar | ||
| μg P∙g-1 de suelo | % | μg P·g-1 de suelo | % | |
| Pi-resina | 0,7 a | 0,9 | 0,6 a | 0,8 |
| Pi-NaHCO3 0,5M | 7,3 a | 9,8 | 6,3 a | 8,1 |
| Pi-NaOH 0,1M | 3,1 a | 4,2 | 3,4 a | 4,3 |
| Pi-HCl-concentrado | 1,6 a | 2,1 | 1,9 a | 2,4 |
| Pi-residual | 42,7 a | 57,2 | 41,3 a | 52,8 |
| Pi total | 55,4 a | 74,2 | 53,5 a | 68,4 |
| Po-NaHCO3 0,5M | 4,0 a | 5,4 | 4,7 a | 6,0 |
| Po-NaOH 0,1M | 4,1 a | 5,5 | 8,6 b | 11,0 |
| Po-HCl-concentrado | 11,1 a | 14,9 | 11,4 a | 14,6 |
| Po total | 19,2 a | 25,8 | 24,7 b | 31,6 |
| P total | 74,6 a | 100 | 78,2 a | 100 |
| Pi biodisponible(*)/Po | 0,42 a |
| 0,27 b |
|
Medias dentro de una misma fila seguidas por una misma letra no son significativamente diferentes (t Student, P≤0,05).(*): Σ Pi-resina + Pi-NaHCO
3Análisis químico de suelo
Las siguientes determinaciones fueron realizadas: pH (agua 1: 2,5), materia orgánica por digestión húmeda (Walkley y Black), clase textural de acuerdo al sistema USDA (Bouyucos), densidad aparente, Al+3, H+, Ca+2, Mg+2, K+ y Na+ intercambiables (extracción con acetato de amonio 1N a pH 7) y N total (Kjehldal). Las determinaciones antes mencionadas se encuentran descritas por Anderson e Ingram (1992). Adicionalmente, se tomaron al azar 4 muestras de suelo en las profundidades de 0-10, 20-30, 40-50, 60-70 y 80-90 cm para cada tratamiento, con el fin de determinar el contenido de P total a través de la digestión con una mezcla binaria de H2SO4 y H2O2 concentrados (Anderson e Ingram, 1992). El P en la muestra digerida fue determinado por el método de Murphy y Riley (1962).
Fósforo en la hojarasca y la fracción ligera de la materia orgánica del suelo
Diez muestras de la hojarasca para cada tipo de vegetación fueron tomadas al azar en áreas de 1 m2. De las muestras de suelo se obtuvo una alícuota de 300 g de las cuales se extrajo la fracción ligera de la materia orgánica del suelo (FL) por el método de flotación en agua. Las muestras de fracción ligera y hojarasca fueron secadas durante tres días a 80° C y pesadas. Luego se determinó el contenido de P total, previa digestión con una mezcla binaria de H2SO4 y H2O2 concentrados (Anderson e Ingram, 1992).
Fraccionamiento de fósforo
Las diferentes fracciones del fósforo orgánico (Po) y fósforo inorgánico (Pi) en el suelo mineral fueron determinados con la metodología de Hedley et al. (1982), modificado por Tiessen y Moir (1993). De cada una de las muestras se colocaron 2 g del material (<0,43 mm) en un tubo de polipropileno y se sometieron durante 16 horas de agitación a la siguiente secuencia de extractantes: resina de intercambio aniónico en 15 mL de agua destilada, 15 mL de NaHCO3 0,5 M a pH 8,5, 15 mL de NaOH 0,1 M a pH 13 y 15 mL de HCl concentrado y caliente, finalmente el residuo fue digerido a 360 °C durante 3 horas con una mezcla de 3 mL de H2SO4 (2 mL) y H2O2 (1mL) concentrados. En una alícuota de los extractos de NaHCO3, NaOH y HCl caliente y concentrado se determinó el contenido de Pi mientras que en otra se determinó el P total, luego de una digestión con persulfato de amonio y ácido sulfúrico para convertir todo el Po en Pi. Así, el Po en cada fracción se calculó como la diferencia entre el Pi de la muestra en la cual se realizó la digestión y el Pi en la muestra en donde no se realizó.
La concentración de P en cada extracto fue determinada a través del método de Murphy y Riley (1962). Este fraccionamiento permite estimar el contenido de formas disponibles para las plantas o lábiles, el cual consiste en Pi en solución o adsorbido a hierro y aluminio en la matriz de intercambio (resina-Pi, NaHCO3-Pi), el Po de rápida mineralización (NaHCO3-Po), el P orgánico e inorgánico moderadamente disponible o lábil asociado a fosfatos cristalinos o amorfos de hierro y aluminio (NaOH-Pi y NaOH-Po) y las formas más estables (HCl-Pi, HCl-Po, P-residual) que contiene una mezcla de fosfatos de muy baja disponibilidad para las plantas asociados a Pi ocluido o a minerales primarios (p.e. Pi-Ca) y Po en la materia orgánica particulada y/o protegido por la celulosa.
La fracción extraíble con HCl 1M, con la cual se obtiene el Pi asociado a fosfatos de calcio (Hedley et al., 1982) y que precede a la extracción con HCl concentrado y caliente fue obviada en este trabajo, ya que se ha demostrado que en suelos ácidos muy meteorizados los tenores de esta fracción son muy bajas o están ausentes (Tiessen y Moir, 1993).
Fósforo en la biomasa microbiana y actividad de fosfatasas ácidas
El P de la biomasa microbiana (P-BM) fue estimado con el método de fumigación-extracción con cloroformo (Hedley et al., 1982). El contenido de P microbiano se calculó como la diferencia entre las muestras fumigadas y no fumigadas luego de la extracción de P con NaHCO3 0,5M y tomando un porcentaje de recuperación un factor de 0,37 (Hedley et al., 1982). La actividad de la enzima fosfatasa ácida fue medida como la conversión de P-nitrofenil fosfato (P-PNP) a P-nitrofenol (PNP), luego de 30 minutos de incubación de 1 g de suelo a 37 °C en una solución Buffer Universal con pH 6,5 (Tabatabai y Bremmer, 1962).
Capacidad de adsorción de fósforo
Para evaluar la capacidad de adsorción de P del suelo del pinar y la sabana se tomaron por triplicado 2 g de suelo, los cuales se equilibraron con 30 mL de KCl 0,01N como fuerza iónica y con concentraciones crecientes de P de 1, 2, 3, 4, 5, 8, 16 y 32 ug∙mL-1 en la forma de KH2PO4 (Walbridge et al., 1991). Para inhibir la actividad microbiana durante el proceso de adsorción se añadieron 0,5 mL de cloroformo previo a la adición de fosfato. Las muestras fueron agitadas durante 30 minutos a las 0, 12 y 24 horas. Al final del período de equilibrio las suspensiones fueron centrifugadas y filtradas y el P de la solución fue medido con el método de Murphy y Riley (1962). Para estimar la capacidad de adsorción de P, los datos se ajustaron a la forma lineal de la ecuación de Langmuir (Fox y Kamprath, 1970):
C/(x/m) = C/b + 1/kb
donde C es la concentración de P en la solución de equilibrio, x/m la cantidad de P adsorbida por unidad de masa de suelo, b el máximo de adsorción de fosfato y k una constante relacionada con la energía de enlace.
Análisis estadísticos
Se realizaron comparaciones de media entre las variables evaluadas tanto en la sabana como en el pinar con la prueba de t de student (P≤0,05) contenida en el programa Statistic versión 5.1. Este mismo programa también sirvió para determinar los coeficientes de correlación entra las variables estudiadas, así como el ajuste de los datos de adsorción de las isotermas de Langmuir a través de regresiones lineales.
RESULTADOS
Características químicas del suelo
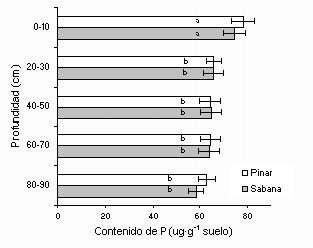
En el pinar se produjo un aumento significativo en el contenido de carbono orgánico, N total y una reducción del contenido de Mg++ intercambiable en los primeros 10 cm del suelo mineral (Cuadro 1). El incremento en 24 años del contenido de carbono orgánico fue de 2,7 t∙ha-1 que equivale a 4,7 t∙ha-1 de materia orgánica. Asociado al mayor contenido de materia orgánica y H+ y menor contenido de Mg++ cambiable, el pH disminuyó de 5,4 a 4,8 unidades mientras que el resto de los cationes cambiables mantuvo tenores similares entre los tratamientos evaluados (Cuadro 1). La concentración de P total en el suelo superficial mineral no varió entre tratamientos al presentar valores entre 74,6-78,2 μg∙g-1 de suelo (Cuadro 2), inferiores a los encontrados en otros oxisoles tropicales (Neufeldt et al., 1999; Lilienfein et al., 2002; Cardoso et al., 2003) y que pudiera estar relacionado con el alto contenido de arena que favorece una menor capacidad de retener fosfatos, así como su lavado del perfil. Por otra parte, la concentración de P total fue superior en la profundidad de 0-10 cm respecto al resto de las profundidades, pero no se encontraron diferencias significativas entre profundidades y tratamientos a partir de los 20 cm (Figura 1).
Figura 1. Variación del contenido de P total a diferentes profundidades en el suelo. Barras corresponden a la desviación estándar. Letras diferentes indican medias diferentes.
Fraccionamiento de fósforo
Tanto en el pinar como en la sabana, los suelos mostraron un predominio de formas recalcitrantes (> 60% como P extraíble con HCl concentrado y caliente y Pi-residual) con muy baja capacidad de mineralización o solubilización (
Cuadro 2). Las fracciones con disponibilidad inmediata para las plantas como el Pi-resina y Pi-NaHCO3, acumularon entre 10-11% del P total, en concentraciones (6,9-7,0 μg·g-1 de suelo) que se pueden considerar satisfactorios sσlo para cultivos con bajas exigencias de P. El establecimiento de pinares sólo produjo un aumento en la fracción de Po-NaOH y en consecuencia del Po total mientras que el resto no evidenció cambios significativos, incluyendo el P total del suelo. En apoyo a este resultado sólo se obtuvo una correlación positiva entre en el contenido de Po total y el Po extraído con NaOH (r de Pearson = 0,985; P≤0,01). Por su parte, la fracción ligera de la materia orgánica incrementó de 1,3 a 2,6 g FL∙g-1 de suelo por el establecimiento de pinares, así como el P total contenido en dicha fracción de 1,1 a 2,6 mg P∙kg–1 de suelo (Cuadro 3).Uno de los detalles evidentes del desarrollo del pinar fue la presencia de un manto de hojarasca, el cual constituye un horizonte de acumulación de materia orgánica y eventualmente de P. En efecto, las cantidades de P total acumuladas en la hojarasca del pinar fueron cuatro veces mayores a las de la hojarasca de la sabana (
Cuadro 4). Sin embargo, el P acumulado en la hojarasca de pinos representó apenas el 0,4% y en el caso de la sabana el 0,1% del acumulado en los primeros 10 cm de suelo mineral, lo que establece claramente que su contribución en el capital de P del suelo es muy baja.Cuadro 3. Contenido de fracción ligera, fósforo en la fracción ligera, fósforo microbiano y actividad de fosfatasas ácidas
| Parámetro | Sabana | Pinar |
| Fracción ligera (g FL∙kg-1 de suelo) | 1,3 a | 2,6 b |
| P en la fracción ligera (mg P∙kg-1 de suelo) | 1,1 a | 2,6 b |
| P microbiano (μg P g-1 de suelo) | 4,3 a | 3,2 a |
| Actividad de fosfatasas ácidas (μg PNP∙h-1∙g-1 de suelo) | 43,8 b | 36,1 a |
Medias dentro de una misma fila seguidas por una misma letra no son significativamente diferentes (P≤0,05) por la prueba de t de Student.
Fósforo microbiano y actividad de fosfatasas ácidas
El P en la biomasa microbiana no mostró diferencias entre tratamientos y los valores obtenidos (3,2-4,3 µg·g-1 de suelo,
Cuadro 3) se encuentran dentro del intervalo de valores reportados para otras sabanas venezolanas (López-Hernández et al., 2004). Por su parte, la actividad de fosfatasas ácidas se redujo en el pinar hecho que concuerda con lo encontrado por Renz et al. (1999) para pinares en el cerrado brasileño. El análisis de correlación no mostró relación alguna entre el P de la biomasa microbiana y la actividad de fosfatasas, así como de éstas con las diferentes fracciones de P.Cuadro 4. Contenidos de P total en la hojarasca y los primeros 10 cm de suelo mineral (kg·ha-)
|
| Sabana | Pinar |
| P total hojarasca | 0,1 a | 0,4 b |
| P total suelo mineral (0-10 cm) | 111,8 a | 117,3 a |
Medias dentro de una misma fila seguidas por una misma letra no son significativamente diferentes (P≤0,05) por la prueba de t de Student.
Isotermas de adsorción de P
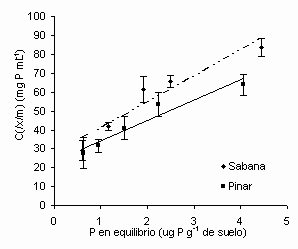
Los datos de adsorción de P se ajustaron satisfactoriamente al modelo lineal de Langmuir hasta concentraciones en equilibrio inferiores a 4,4 ppm tal como fue observado por López-Hernández et al. (1983) para la misma localidad. Los máximos de adsorción fueron de 70 µg P·g de suelo-1 para la sabana y de 90 µg P·g de suelo-1 para el pinar, siendo significativamente superior en este último caso (
Cuadro 5, Figura 2). Los valores de máxima adsorción se encuentran dentro del intervalo de 10-301 µg P·g-1 de suelo, determinados para otros suelos arenosos y ácidos (López-Hernández et al., 1983; Tiessen et al., 1994). Adicionalmente, se encontró una correlación positiva entre la capacidad máxima de adsorción de P y el contenido de carbono orgánico (r de Pearson = 0,873, P≤0,05). . Ecuaciones de Langmuir para la adsorción de P
| Tipo | Ecuación | R2 | Máxima adsorción de P (mg·g-1 de suelo) | Constante de energía de adsorción (ml·mg-1 de P) |
| Sabana | C/x/m = 13,8C + 27,3* | 0,91** | 0,07 a | 0,57 a |
| Pinar | C/x/m = 11,7C + 23,1* | 0,96** | 0,09 b | 0,44 b |
Medias dentro de una misma fila seguidas por una misma letra no son significativamente diferentes (t Student, P≤0,05).
* La ecuación de Langmuir fue calculada para valores de adsorción correspondientes a concentraciones de P en equilibrio menores a 4,5 ppm
** Valores estadísticamente significativos (t Student, P≤0,05)
Figura 2. Isotermas de adsorción de Langmuir. Barras corresponden a la desviación estándar.
DISCUSIÓN
La aforestación de sabanas implica una modificación en los patrones de producción de materia orgánica y de ciclaje de nutrimentos. Si bien, los pinares presentan bajos requerimientos nutricionales en comparación con otras especies de uso agrícola y forestal, la demanda de éstos para la producción de materia orgánica es mucho mayor respecto a la vegetación de sabana. Adicionalmente, los tejidos de Pinus caribea y otras especies del género poseen una alto contenido de compuestos recalcitrantes (Barnola et al., 1997) que afectan la actividad microbiológica y en consecuencia la mineralización del carbono y otros nutrimentos contenidos en los restos vegetales (Martins et al., 1999). Dentro de los cambios más notorios observados en este trabajo, está el incremento de carbono orgánico del suelo de 3,3 a 5,1 g C·kg-1 de suelo. Ello representa la incorporación de 2,7 t C·ha-1 en 24 años, valor que contrasta con el obtenido por Neufteldt et al. (1999a) y Lilienfein et al. (2002) quienes encontraron luego de 8 y 20 años, respectivamente, que el establecimiento de Pinus caribea en oxisoles arcillosos del cerrado brasileño no afectó el contenido de carbono orgánico del suelo.
Los datos del fraccionamiento mostraron un incremento de la fracción de Po-moderadamente lábil (Po-NaOH de 4,1 a 8,6 μg P·g-1
de suelo) y consecuentemente de Po total (19,2 a 24,7 μg P·g-1 de suelo) del pinar. En valor absoluto el cambio fue relativamente pequeño, razón por la cual no generó diferencias significativas en el contenido de P total de ambos tratamientos (Cuadro 2) y permite concluir que después de 24 años, el desarrollo forestal con pinares en Uverito ha tenido un impacto bajo sobre los diferentes reservorios de P. En comparación con otros pinares establecidos en oxisoles tropicales, Lilienfein et al. (2002) observaron después de 20 años una reducción en las fracciones más recalcitrantes como son el P residual y el extraíble con HCl caliente y concentrado mientras que las fracciones restantes mantuvieron concentraciones similares incluyendo el P total. En otro estudio, Neufeldt et al. (1999b) encontraron tras 8 años un incremento en las fracciones extraíble con NaOH, P residual y P total, pero igualmente una disminución en el P extraíble con HCl concentrado y caliente. Como puede observarse los cambios sobre el almacenamiento de carbono, y las fracciones de P del suelo son variables y están condicionados por el tiempo, así como por las características climáticas, edáficas y de manejo de la plantación.En suelos con baja disponibilidad de P, las plantas y los microorganismos compiten por el P presente en la solución del suelo. Ello favorece un rápido ciclaje a través de los procesos de mineralización e inmovilización, y en donde el Po constituye una fuente importante para suplir estas demandas (Tiessen et al., 1994). Neufteldt et al. (1999b) señalan que bajo fertilización, la competencia por P disminuye produciéndose un aumento proporcional en el contenido de P disponible y una reducción en la tasa de recambio del Po. Por esta razón, sugieren que la relación Pi biodisponible (Pi-resina + Pi-NaHCO3 + Pi-NaOH)/Po permite comparar las deficiencias de P bajo diferentes manejos o condiciones texturales de los suelos. Para este estudio, la citada relación muestra que la deficiencia es mayor en el caso del pinar (
Cuadro 2), lo cual apunta también a un ciclaje más rápido del P para satisfacer las demandas del pinar que son superiores a los de la sabana.La hojarasca del pinar concentró mayor cantidad de P total respecto a la sabana aunque en ambos casos su cuantía fue muy baja (0,1-0,4 %) respecto al acumulado en el suelo mineral superficial. Tiessen et al. (1994) y Chacón (2002) demostraron que el mantillo humificado contiene la mayor cantidad de P del suelo en bosques sobre suelos arenosos y oligotróficos del sur de Venezuela y que el ciclaje de éste es esencial para la nutrición fosfórica. Evidentemente, las diferencias están relacionadas con la fuerte deficiencia de P en estos suelos que han favorecido en el tiempo el establecimiento de mecanismos eficientes de incorporación nutrimentos y su posterior conservación en la vegetación, como son la capitalización de éstos en la materia orgánica y la presencia de una estera de raíces y microorganismos simbiontes que reducen las pérdidas por lixiviación y mejoran la absorción de los nutrientes por las plantas. A este respecto es importante mencionar que en Uverito las plántulas de pino son inoculadas con las ectomicorrizas Pisolthus tintoreus y Telephora terrestris con el fin de alcanzar una mejora en la nutrición mineral y sobrevivencia de las plántulas (Gross et al., 2004).
Junto al incremento de la materia orgánica también se observó un aumento de su FL y el P asociado a ella. La FL es una fracción de la materia orgánica que se encuentra parcialmente descompuesta con tamaños entre 0,25-2,00 mm y una vida media entre 8 y 50 años, razón por la cual se le considera un compartimiento de lenta mineralización que suple de nutrimentos en el mediano y largo plazo (Parton et al., 1987). Phiri et al. (2001) encontraron una correlación entre el de P de la fracción ligera y el P extraíble con NaHCO3, lo que demostraría que un aumento del P en la fracción ligera favorece también su disponibilidad inmediata. No obstante, en nuestro caso el aumento de P en la fracción ligera en el pinar no fue acompañado con un aumento en el P extraíble con la resina de intercambio o NaHCO3, pero si con el extraíble en NaOH.
El P-BM no manifestó diferencias entre tratamientos, observación que coincide con el estudio de Campos (1999) para el C y N microbiano en la misma localidad y fecha de muestreo aunque se encontraron mayores contenidos de C y N en el pinar. Por otra parte, la actividad de las fosfatasas ácidas fue menor en el pinar (
Cuadro 3) pese a que las relaciones C/Po y Pi biodisponible/Po favorecieran una mayor actividad de esta enzima (McGill y Cole, 1981). Renz et al. (1999) encontraron un comportamiento igual para el establecimiento de pinares en el cerrado brasileño y además demostraron una mejor correlación entre la actividad microbiológica y la actividad de fosfatasas ácidas, que entre el contenido de formas de P "biodisponibles" y la actividad de fosfatasas ácidas. Por su parte, Campos (1999) mostró que la actividad microbiológica evaluada a través de la respiración basal y edáfica disminuyó en los rodales de pino posiblemente por las características de la materia orgánica y el pH más ácido que presentó el suelo, situación que pudiera justificar la reducción en la actividad de fosfatasas observada en este trabajo. Con base a los resultados en el cerrado brasileño y la capacidad que tienen las enzimas para acumularse y estabilizarse en las partículas minerales del suelo y en la materia orgánica, Renz et al. (1999) concluyen que en suelos pobres en Po, la actividad de fosfatasas ácidas no es un buen indicador de la mineralización real de P pero si de su capacidad potencial para mineralizar fosfomonoésteres disponibles.La adsorción de P aumentó en el pinar (
Figura 2, Cuadro 5) muy probablemente asociado al incremento de la materia orgánica y a la formación de complejos organominerales y complejos minerales amorfos de hierro y aluminio que incrementan las superficies reactivas a los iónes fosfato (Appelt et al., 1975). La materia orgánica también puede tener el efecto contrario, ya que genera una mayor competencia y desplazamiento del P de los sitios de adsorción, con el consecuente aumento de su concentración en la solución del suelo (Nziguheba et al., 1998). En primera aproximación, estos resultados sugieren que bajo el uso forestal aumenta la capacidad para retirar fosfatos de la solución del suelo; sin embargo, no se encontraron diferencias significativas en el tenor de las formas inorgánicas lábiles (Pi-resina y Pi-NaHCO3) (Cuadro 2) que pudieran mantenerse similares a las de la sabana, gracias a la mineralización de Po o al proceso inverso de desorción de P lábil, aspecto que no fue evaluado en este trabajo. Chacón (2002) demostró en suelos arenosos de la Gran Sabana de Venezuela, que una mayor adsorción de P está acompañada también por una mayor desorción y que ambos procesos están relacionados directamente con el contenido de carbono orgánico, entre otras variables. En todo caso, el proceso de desorción no restituye todo el P adsorbido en la matriz de intercambio, tal como ha sido demostrado por Okajima et al. (1983) y Barros et al. (2005). Estos últimos autores encontraron en oxisoles del cerrado brasileño que el coeficiente de partición que describe la distribución instantánea del P lábil entre las fases sólidas y líquidas del suelo (Kd) es por lo general menor para la desorción que la adsorción y que esta diferencia se acentúa con el aumento en el contenido de arcillas en el suelo.CONCLUSIONES
Luego de 24 años de establecimiento, los pinares produjeron un incremento en el contenido de materia orgánica en el suelo superficial que influyó en un mayor contenido de la fracción ligera y en una mayor capacidad para adsorber fosfatos. Dentro de las fracciones químicas y microbiológicas sólo hubo un incremento del Po moderadamente lábil (Po-NaOH), que en valor absoluto fue pequeño e indica que durante el período evaluado el establecimiento de pinares ha tenido muy bajo impacto sobre las distintas fracciones del P. La relación Pi/Po biodisponible muestra que hay una mayor deficiencia de P en el pinar y en consecuencia un ciclaje más rápido de éste para satisfacer los requerimientos nutricionales de este ecosistema. Sin embargo, esta deficiencia de Pi biodisponible no se correlacionó con la actividad de las fosfatasas ácidas, que por el contrario se redujo en el pinar. Este hallazgo apoya estudios previos en donde se manifiesta que en suelos pobres en Po la actividad de fosfatasas ácidas es una medida del potencial de mineralización, pero no de la capacidad real de mineralización del Po.
LITERATURA CITADA
1.Anderson, J.M. y J.S.I. Ingram. 1992. Tropical Biology Soil Fertility: A Handbook of Methods. 2nd Edic. Oxford. U.K. CAB International. 221 p. [ Links ]
2.Appelt, H., N.T. Coleman y P.F. Pratt. 1975. Interactions between organic compounds, minerals and ions in volcanic-ash-derived soils: Effects of organic compounds on the adsorption of phosphate. Soil Sci. Soc. Am. Proc. 39: 628-630. [ Links ]
3.Barnola, L. F., M. Hasegawa y A. Cedeño. 1997. Mono and sesquiterpene variation in Pinus caribea and its relationship to Atta laevigata herbivory. Biochem. Syst. Ecol. 22(5): 437-445. [ Links ]
4.Bautis, M. 1999. Cambios en la fertilidad fosfórica inducidos por el establecimiento de plantaciones de pinos en suelos de sabanas en Uverito, Estado Monagas. Trabajo Especial de Grado. Escuela de Biología. UCV. 88 p. [ Links ]
5.Barros, N.F., Filho y N.B. Commerdford. 2005. Phosphorus sorption, desorption and resorption by soils of the brazilian cerrado supporting ecucalypt. Biomass and Bioenergy 28: 229-236. [ Links ]
6.Beck, M.A. y P.A. Sánchez. 1994. Soil phosphorus fractions dynamics during 18 years of cultivation on a Typic paleudult. Soil Sci. Soc. Am. J. 58: 1424-1431. [ Links ]
7.Campos, A. 1999. Efecto de la siembra de Pinus caribea L. en fracciones de la materia orgánica de un suelo de sabana. Uverito-Edo. Monagas. Trabajo Especial de Grado. Escuela de Biología. UCV. 84 p. [ Links ]
8.Cardoso, I.M., P. Van der Meer, O. Oenema, B. H. Janssen y T. W. Kuyper. 2003. Análisis of 31 PNMR in oxisols under agroforestry and convencional coffee systems in Brazil. Geoderma 112: 51-70. [ Links ]
9.Cedeño, L., C. Carrero, W. Franco y L.A. Torres. 2001. Sphaeropsis sapinea asociado con quema del cogollo, muerte regresiva y cáncer en troncos, ramas y raíces del pino Caribe en Venezuela. Interciencia 26(2): 210-215. [ Links ]
10.Chacón, N. 2002. Dinámica del fósforo en un gradiente bosque-sabana en la Gran sabana, Sur de Venezuela. Trabajo de Grado. IVIC. 184 p. [ Links ]
11.Fontes, M.P.F. y S.B. Leed. 1996. Phosphate adsorption by clays from brazilian oxisols: Relationships with specific area and mineralogy. Geoderma 72: 37-51. [ Links ]
12.Fox, R.L. y E.J. Kamprath. 1970. Phosphate sorption isotherms for evaluating the phosphate requirements of soils. Soil. Soc. Am. Proc. 34: 902-907. [ Links ]
13.Goedert, W.J. 1983. Management of the cerrado soils of Brazil: A review. J. Soil Sci. 34: 405-428. [ Links ]
14.Gross, E., L.T. Casagrande y F.H. Caetano. 2004. Ultraestructural study of ectomycorrhizas on Pinus caribea Morelet. Var Hondurensis, Barr & Golf seedlings. Acta Bot. Bras. 18(1): 1-7. [ Links ]
15.Hedley, M.J., J.W.B. Stewart y B.S. Chahuan. 1982. Changes in inorganic and organic soil phosphorus fractions induced by cultivation and by laboratory incubations. Soil Sci. Soc. Am. Proc. 46: 970-976. [ Links ]
16.Lilienfein, J., W. Wilcke, M.A. Ayarza, L. Vilela, S. do Cardo Lima y W. Zech. 2002. Chemical fractionation of phosphorus, sulfur and molybdenum in Brazilian savannah Oxisols under different land use. Geoderma 96: 31-46. [ Links ]
17.López-Hernández, D., I. Coronel y L. Álvarez. 1983. Uso de las isotermas de adsorción para evaluar los requerimientos de fósforo. I: Isoterma de adsorción de los suelos. Turrialba 3: 169-180. [ Links ]
18.López-Hernández, D., Y. Araujo, A. López, I. Hernández-Valencia y C. Hernández. 2004. Changes in the soil properties and in earthworm populations as induced by organic long-term fertilization on a sandy savanna soil in venezuelan amazonia. Soil Science 169: 188-194. [ Links ]
19.McGill, W.B. y C.V. Cole. 1981. Comparative aspects of C, N, S and P cycling through soil during pedogenesis. Geoderma 26: 267-286. [ Links ]
20.Martins, A., S. Azevedo y L. Carvalho. 1999. Dynamics of leaf litter structural compounds in C. sativa and P. pinaster forest ecosystems during decomposition processes: Interactions with soil organic matter and nutrient release: Acta Hort. 494: 161-166. [ Links ]
21.Murphy, J. y J.P. Riley. 1962. A modified single solution method for the determination of phosphate in natural waters. Anal. Chim. Acta: 27: 31-36. [ Links ]
22.Neufteld, H., V.S. Dimas, V.S. Resck, M.A. Ayarza y W. Zech. 1999a. Soil organic matter in the oxisol of the brazilian cerrado. In: Thomas, R. y M. A. Ayarza (eds.). Sustainable and Management for the Oxisol of the Latin American Savannas. CIAT. Cali. Colombia. pp. 89-109. [ Links ]
23.Neufeldt, H., J. E. Da Silva, M. A. Ayarza, M. y W. Zech 1999b. Phosphorus fractions under different land-use systems in oxisols of the Brazilian cerrado. In: Thomas, R. y M. A. Ayarza (eds.). Sustainable Land Management for the Oxisol of the Latin American savannas. CIAT. Cali. Colombia. pp. 146-158. [ Links ]
24.Nziguheba, G., Ch. A. Palm, R. J. Ubres y P. C. Smithson. 1998. Soil phosphorus fractions and adsorption as affected by organic and inorganic sources. Plant and Soil 198 (2): 159-168. [ Links ]
25.Okajima, H., H. Kubota y T. Sakuma. 1983. Hysteresis in phosphorus sorption and desorption process of soils. Plant Nutr. 29: 271-283. [ Links ]
26.Parton, W., D. Schimel, C. Cole, y D. Ojima. 1987. Analysis of factor controlling soil organic matters levels in Great Plains grasslands. Soil Sci. Soc. Am. J. 51: 1173-1179. [ Links ]
27.Phiri, S., E. Barrios, I.M. Rao y B.R. Singh. 2001. Changes in soil organic matter and phosphorus fractions under planted fallow and crop rotation system on a Colombian volcanic-ash soil. Plant and Soil 231(2): 211-223. [ Links ]
28.Renz, T.E., H. Neufeldt, M.A. Ayarza, V. Dimas, S. Resck y W. Zech. 1999. Acid phosphatase: An indicator of phosphorus mineralization or of microbial activity? A case study from the brazilian cerrado. In: Thomas, R. y M. A. Ayarza (eds.). Sustainable and Management for the Oxisol of the Latin American Savannas. CIAT. Cali. Colombia. pp. 173-186. [ Links ]
29.San José, J.J. y J. García-Miragaya. 1981. Factores ecológicos operacionales en la producción de materia orgánica de las sabanas. Bol Soc. Ven. Cienc. Nat. 36: 347-374. [ Links ]
30.Tabatabai, M.A. y J. M. Bremmer. 1962. Use of p-nitrophenylphosphate for assay of soil phosphatase activity. Soil Biol. Biochem. 1: 301-307. [ Links ]
31.Thomas, R. y M.A. Ayarza. 1999. Sustainable and Management for the Oxisol of the Latin American Savannas. CIAT. Cali. Colombia. 231 p. [ Links ]
32.Tiessen, H. y J.O. Moir. 1993. Characterization of available P by sequential extraction. In: Carter, M. R. (ed.). Soil Sampling and Methods of Analysis. Boca Ratón, Fl. CRC Press. pp. 75-86. [ Links ]
33.Tiessen, H., P. Chacón y E. Cuevas 1994. Phosphorus and nitrogen status in soils and vegetation along a troposequence of dystrophic rainforest on the upper Río Negro. Oecologia 99: 145-150. [ Links ]
34. Walbridge, M.R., C.J. Richardson y W.T. Swank 1991. Vertical distribution of biological and geochemical phosphorus subcycles in two southern Appalachian soils. Biogeochemistry 13: 61-85. [ Links ]