Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro v.17 n.3 Barquisimeto sep. 2005
Daños tóxicos en tejidos vegetales sensibles producidos por aguas contaminadas con arsénico en Zimapán, Hidalgo, México
Francisco Prieto-García1, María de los Ángeles Lechuga1, M. A. Méndez-Marzo2,
Enrique Barrado E.3 y Judith Callejas H.1
1 Centro de Investigaciones Químicas. e-mail: prietog@uaeh.reduaeh.mx
2 Centro de Investigaciones Biológicas. Universidad Autónoma del Estado de Hidalgo, Carretera Pachuca-Tulancingo. Pachuca, Hidalgo. México
3 Dpto. de Química Analítica. Facultad de Ciencias. Universidad de Valladolid. Valladolid, España
RESUMEN
Los estudios realizados en la última década en las aguas de los pozos, norias y manantiales del municipio de Zimapán, estado de Hidalgo, México, han mostrado un incremento del contenido de arsénico que rebasa los límites máximos permisibles por la Norma Oficial Mexicana. En este estudio se analizó el contenido de arsénico en muestras del agua y se utilizaron plantas de haba (Vicia faba L.) en un bioensayo para evaluar el daño genotóxico con el uso de esta agua mediante la prueba de inducción de micronúcleos en las células. Se utilizó como control el agua de un pozo de similares características del municipio de Pachuca, pero con contenidos de arsénico por debajo de los límites de detección. Se comprobó que el agua de la región presenta altas concentraciones de arsénico y que los efectos genotóxicos que pueden provocar se manifiestan por el incremento de la inducción de micronúcleos en las células meristemáticas de las raíces de plantas sensibles. Así mismo, se observó que el efecto citotóxico es capaz de enmascarar el efecto genotóxico.
Palabras clave adicionales: Bioacumulación, bioensayos, Vicia faba, toxicidad
Toxic damages in susceptible plant tissues caused by arsenic polluted waters in Zimapán, Hidalgo State, México
ABSTRACT
Studies made in the last decade in waters of wells, chain dumps and springs of the municipality of Zimapán, Hidalgo State, Mexico, have shown an increase in the arsenic content that surpasses the maximum limit established by the Mexican Official Norms. In this study the arsenic content was evaluated in water samples, and Vicia faba plants were used in a bioassay to assess the genotoxic damage when using this water by means of the micronuclei induction test. A well water of similar characteristic from the municipality of Pachuca, but with low arsenic content, was used as a control test. The results showed that the water of this region presents high arsenic levels and can cause genotoxic effects by the induction of micronuclei in the meristematic root cells of susceptible plants. It was also shown that the citotoxic effects can mask the genotoxic effects on the plant.
Additional key words: Bioaccumulation, bioassays, Vicia faba, toxicity
Recibido: Septiembre 27, 2005
Aceptado: Diciembre 23, 2005
INTRODUCCIÓN
La acumulación de los metales pesados en los tejidos vegetales puede llegar a producir daños genotóxicos en sus células y de esta manera logran incorporarse al hombre a través de la cadena alimentaria (Pérez, 2004). En el caso de la población de Zimapán, en el estado de Hidalgo, México se ha comprobado la existencia de agua contaminada con arsénico (Núñez, 1999; Prieto et al., 2005), lo cual pudiera estar ocasionando daños citogenéticos a los vegetales usados para el consumo humano.
Un sistema que ha demostrado ser versátil y eficiente para evaluar el daño citogenético en las plantas se basa en el uso de células meristemáticas de la raíz de haba (Vicia faba L.) debido a su fácil manejo, mantenimiento relativamente económico y a la presencia de pocos cromosomas (Valencia, 1992). Estos cromosomas tienen buen tamaño para realizar un estudio citológico a la vez que se conocen perfectamente los tiempos de cada una de las etapas de su ciclo celular (duración total de 19,3 horas a 19 °C); esto, aunado a que en los meristemos apicales hay una gran cantidad de células indiferenciadas en división, favorece los estudios de citotoxicidad (Evans y Scott, 1964).
La posibilidad de estudiar el daño geno y citotóxico que puede producir el arsénico, presente en suelos y aguas en la región de Zimapán, sugiere la idea de utilizar bioensayos que permitan su estudio en células meristemáticas. El objetivo de este trabajo fue evaluar el efecto citotóxico y genotóxico que puede provocar la presencia de arsénico en tejidos vegetales sensibles utilizando para ello la raíz de plantas de haba.
MATERIALES Y MÉTODOS
Inicialmente se realizó una serie de muestreos sistemáticos y representativos durante un año para evaluar los niveles medios de concentración de arsénico en aguas recolectadas en los diferentes pozos municipales de la población de Zimapán (estado de Hidalgo, México) así como en el distribuidor general de abastecimiento de agua a la población. El agua utilizada para analizar los daños genotóxicos fue colectada directamente del distribuidor general. Así mismo, se colectó y evaluó el agua en el municipio de Pachuca (sin presencia de arsénico) la cual se utilizó como muestra control.
La determinación de arsénico en las muestras de agua se realizó mediante absorción atómica por generación de hidruros, según metodología señalada en Prieto et al. (2005).
El efecto genotóxico del arsénico fue evaluado en las raíces de haba (Vicia faba), variedad Minor, considerando este cultivo como un sistema de bioensayo para analizar la aparición de aberraciones cromosómicas que ocurren a través de la formación de micronúcleos. Las raíces se expusieron al agua de Zimapán (con alto contenido de As) y a los lotes de control con agua del municipio de Pachuca (sin presencia de As).
Se seleccionaron 20 semillas grandes y de tamaño similar de haba y se sumergieron en agua corriente durante 24 horas con el objeto de reblandecer la testa. Luego fueron colocadas entre dos capas de algodón en una bandeja de aluminio sin luz, protegidas de contaminantes (polvo) y lo suficientemente húmedas para favorecer su germinación hasta que aparecieron las radículas. Posteriormente se eliminó la testa para evitar la contaminación por hongos. Cuando las raíces alcanzaron de 4 a 5 cm de longitud (entre 2 y 3 días) se separaron en dos lotes: un lote control y un lote problema para su tratamiento con el agua contaminada. Se eligieron las plantas con las raíces más grandes y se colocaron en la superficie de un vaso de precipitado de 250 mL de capacidad, cubierto con papel aluminio, permitiendo que a través de un orificio las raíces quedaran sumergidas en el agua durante 6 horas. Una vez tratadas las raíces se procedió a la preparación de las laminillas realizando un corte de 2 mm del meristemo apical, el cual fue fijado en una solución de etanol-ácido acético (3:1). Para la tinción los meristemos apicales se colocaron en etanol 70 % para deshidatar la célula de la raíz. Se agregó HCl 5M a los meristemos apicales (hidrólisis) para eliminar la pared celular y facilitar la entrada del colorante. El exceso de HCl fue eliminado mediante lavado con agua destilada. La tinción se realizó con aceto-orceína por 40 minutos, colorante de tipo básico, que tiene más afinidad por las estructuras celulares de carácter ácido como son los cromosomas. Se utilizó ácido acético al 45 % para eliminar el exceso de colorante.
Los meristemos fueron colocados sobre un portaobjetos y se maceraron para obtener la consistencia requerida para hacer las observaciones microscópicas a través de la técnica denominada squash, la cual permite que las células no estén unas sobre otras y lo más dispersas posible lo que permite que sean fácilmente observadas a nivel microscópico. Durante la hidrólisis, el tejido se colocó en un portaobjetos, se maceró con una navaja de un sólo filo y luego de la tinción se colocó un cubreobjetos para realizar el aplastamiento en monocapa o squash.
En campos al azar, a nivel de microscopio, se observaron 1000 células en interfase, tanto en el lote control como en el lote problema, para determinar la incidencia de micronúcleos, los cuales permiten mostrar el daño genotóxico inducido a través de los rompimientos cromosómicos y cromosomas con el centrómero inactivado. Las diferencias entre ambos lotes fueron analizadas mediante una prueba de diferencia de proporciones (Spigel, 1970).
En caso de no encontrar daño genotóxico por micronúcleos debido a que el compuesto fuese más tóxico que mutágeno, se evaluó el daño a través de un índice mitótico, el cual constituye un criterio para evaluar el daño fisiológico que provocan diversos agentes xenobióticos al producir inhibición de la división celular mediante un efecto citotóxico (Davidson, 1960; Haber y Forrad, 1964; Burholt y Van´t Hof, 1972). Este índice se obtuvo discriminando el número de células en división entre el número total de células y se comparó con el lote control, analizando las diferencias a través de una prueba de c2. De seis preparaciones obtenidas para el lote control se analizó el número de células en división en 1000 células por cada una y se promedió el resultado. Para el lote donde se utilizó el agua de Zimapán, se obtuvieron 21 muestras, de las cuales también se analizaron 1000 células en cada una y se promedió en forma similar al lote control.
RESULTADOS Y DISCUSIÓN
Los resultados de los análisis de agua de los pozos y distribuidor general fueron reportados en un trabajo previo (Prieto et al., 2005) y en todos los casos exceden al valor máximo permisible de As (0,025 mg·L-1). El agua proveniente del municipio Pachuca presentó una concentración de arsénico inferior a 0,008 mg·L-1, es decir, sin problemas del contaminante.
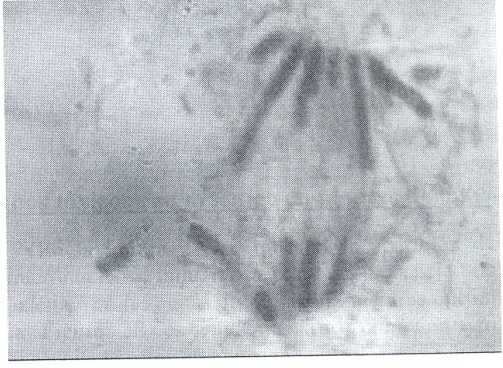
En la Figura 1 se muestra un rompimiento de un cromosoma anafásico en haba, inducido por el tratamiento con el agua de Zimapán a las células meristemáticas de la raíz, el cual es el mecanismo con que el arsénico induce la formación de micronúcleos. Éstos son alteraciones observables desde la etapa de anafase que se originan a través de rompimientos cromosómicos y/o por la no segregación de cromosomas debido a una inactivación de su centrómero.
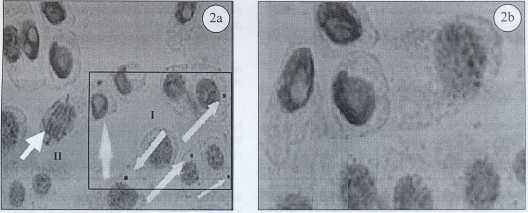
En la Figura 2A se muestra la aparición de micronúcleos inducidos por la presencia de arsénico en las aguas de Zimapán mientras que en la Figura 2B es evidente la disminución y/o ausencia de éstos en el grupo control. En la Figura 2A también se observa la inducción de probables micronúcleos en anafase.
Figura 1. Fragmento cromosómico observable en una anafase de haba el cual se transformará en un micronúcleo en telofase
En el Cuadro 1 se presenta la frecuencia de células en división, la distribución de éstas por etapa del ciclo celular y el número de micronúcleos encontrados en las muestras. Se observa que la frecuencia de micronúcleos en los grupos con agua contaminada difiere con respecto al grupo control. Estas diferencias fueron significativas según la prueba de c2 indicando el efecto mutagénico de arsénico.
Es conocido que algunos compuestos orgánicos químicos pueden ser más tóxicos que mutagénicos logrando inhibir la división celular a través de efectos citotóxicos (Valencia, 1992).
Cuadro 1. Frecuencias de células en división y los micronúcleos encontrados en los grupos estudiados
| Lote | Frecuencias | Células en división por etapa del ciclo celular | Micronúcleos | ||||
| Interfase | Profase | Metafase | Anafase | Telofase | |||
| Sin As (control) | 55/1000 | 15 | 19 | 1 | 15 | 4 | 1 |
| Con As | 37/1000 | 7 | 7 | 4 | 4 | 4 | 11+ |
+ Positivo según la prueba de c2 con un 95 % de confiabilidad
Para discernir sobre la presencia de probables efectos citotóxicos que pudieran encubrir la capacidad mutagénica del arsénico se evaluó el índice mitótico. Se obtuvo una reducción de 2,7 veces (la relación entre 46/1000 y 17/1000) de la división celular o índice mitótico en las plantas tratadas con agua contaminada con respecto a las del grupo control (Cuadro 2). Dicha reducción fue positiva estadísticamente y capaz de encubrir al efecto mutagénico.
Figura 2. Microfotografía de raíces de Vicia faba germinadas en aguas diferentes: 2a) En aguas de Zimapán, donde se observa la presencia de micronúcleos indicados por las flechas en el área I; la flecha en el área de II indica la inducción de probables micronúcleos en etapa de anafase. 2b) En aguas de Pachuca, donde se puede apreciar la ausencia de micronúcleos
Para determinar si existían diferencias en cuanto a las etapas del ciclo celular entre los grupos evaluados, partiendo de la base que se detectó un efecto citotóxico significativo, se desglosó la frecuencia de aparición de cada una de las sub-etapas. Como se puede ver en el Cuadro 3, no hubo diferencias estadísticas entre el grupo control y el tratado con agua de Zimapán. Inicialmente se puede observar que en ambos la mayoría de las células en división están en interfase y profase, existiendo un segundo pico de expresión en anafase, lo que sugiere un comportamiento similar entre los dos grupos y que están coordinados independientemente del tratamiento. Esto no permite especificar en que
momento del ciclo celular estuvo actuando el efecto citotóxico.
La prueba estadística de c2 mostró igual proporción de células en las etapas de interfase, profase y anafase para ambos casos.
Cuadro 2. Frecuencia de células meristemáticas de haba en división (índice mitótico) en ambos grupos de estudio
| Lote | Células totales | Células en división | Índice mitótico |
| Sin As (control) | 6000 | 278 | 46/1000 |
| Con As | 21000 | 363 | 17/1000+ |
+ Positivo según la prueba de c2, con un 95 % de confiabilidad
Cuadro 3. Frecuencia observada de células meristemáticas de haba con respecto a cada una de las etapas del ciclo celular en ambos grupos bajo estudio
| Lote | Frecuencia de células en división | Interfase | Profase | Metafase | Anafase | Telofase |
| Sin As (control) | 46/1000 | 15 | 20 | 1 | 9 | 1 |
| Con As | 17/1000 | 4 | 6 | 0 | 6 | 1 |
CONCLUSIONES
El agua de Zimapán presenta una alta concentración de arsénico que puede ocasionar daños genotóxicos mediante la inducción de micronúcleos a nivel celular. Por otra parte, el efecto genotóxico puede ser enmascarado por el efecto citotóxico.
LITERATURA CITADA
1. Burholt, D.R. y J. Vant Hof. 1972. Cell population Kinetic of Pisum root meristem cell during and after a mitotic inhibitory exposure to protracted gamma irradiation. Int. J. Radiat. Biol. 21: 307-319. [ Links ]
2. Davidson, D. 1960. Meristem initial cell in irradiated roots of Vicia faba. Ann. Bot. 24: 287-295. [ Links ]
3. Evans, H.J. y D. Scott. 1964. Influence of DNA synthesis on the production of cromatid aberrations by X-rays and maleic hydrazide in Vicia faba. Genetics 49: 17-38. [ Links ]
4. Haber, A.H. y D.E. Forrad 1964. Further studies of gamma-irradiated wheat and their relevance to use of mitotic inhibition for developmental studies: Amer. J. Bot. 51: 151-159. [ Links ]
5. Núñez, B.J. 1999. Evaluación hidrológica de la cuenca de Zimapán y sus implicaciones con la presencia de arsénico. Tesis. Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo, México. 115 p. [ Links ]
6. Pérez M., F. 2004. Lixiviación y precipitación de arsénico en aguas y lodos de pozos en el distribuidor general de Zimapán, Hidalgo. Tesis. Universidad Autónoma del Estado de Hidalgo. Pachuca, Hidalgo, México. 184 p. [ Links ]
7. Prieto, F., J. Callejas, M. de los Á. Lechuga, J. Gaytán y E. Barrado. 2005. Acumulación en tejidos vegetales de arsénico proveniente de aguas y suelos de Zimapán, estado de Hidalgo, México. Bioagro 17(3): 129-137. [ Links ]
8. Spiegel, M.R. 1970. Theory and Problems of Statistics Editorial. Schaum New York. pp 181-183. [ Links ]
9. Valencia-Quintana, P.R. 1992. Efecto de los insecticidas carbámicos Metomil y Oxamil sobre los cromosomas de las células meristemáticas de la raíz de Vicia faba. Tesis. Universidad Nacional Autónoma de México. México, D.F. 87 p. [ Links ]