Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro v.20 n.2 Barquisimeto ago. 2008
Identificación y caracterización de leifsonia xyli subsp. xyli como patógeno de la caña de azúcar (saccharum sp.) en la región centro occidental de Venezuela
Nancy Contreras1, Odaliz Jiménez2, Marianela Bonilla1, Herman Nass3
1 Posgrado de Fitopatología, Decanato de Agronomía, Universidad Centroccidental Lisandro Alvarado. e-mail: ncontreras@ucla.edu.ve; nelabonilla@hotmail.com
2 Dpto. de Fitotecnia, Decanato de Agronomía Universidad Centroccidental Lisandro Alvarado. Apdo. 400. Barquisimeto. Venezuela. e-mail: odalizjimenez@ucla.edu.ve
3 Instituto Nacional de Investigaciones Agrícolas (INIA), Estación Local Yaritagua. Yaritagua estado Yaracuy. Venezuela. e-mail: hnass@inia.gob.ve
RESUMEN
Dado que en campos experimentales y comerciales de caña de azúcar en los estados Lara y Yaracuy se observaron tallos delgados, de apariencia raquítica y en cortes longitudinales coloración rojiza en los haces fibrovasculares, el objetivo de este trabajo fue identificar y caracterizar el agente causante, a partir de aislamientos en extracto de levadura, dextrosa y carbonato de calcio (YDC). Para las pruebas de patogenicidad se inocularon esquejes sanos mediante inyección de la suspensión bacteriana en el tallo en la región nodal. Los aislamientos originaron colonias color blanco crema, mucoides, circulares, de bordes enteros, consistencia gelatinosa y aspecto brillante. Vistas al microscopio óptico presentaron forma bacilar simple con un ligero hinchamiento en los extremos asemejando la forma de mazo o en pares unidas por el extremo formando una V. De las pruebas de patogenicidad se desarrollaron síntomas que se evidenciaron a partir de los 15 días, y en los reaislamientos se obtuvieron colonias idénticas a las originales que crecieron en los medios YDC, NBY y D2 de Kado y Heskett. La bacteria resultó Gram positiva, aeróbica, reacción ácida en bacto agar dextrosa rojo fenol, oxidasa negativa y catalasa positiva. Reacción negativa para la reducción de nitratos, producción de indol, hidrólisis del almidón, producción de ácido sulfídrico, licuefacción de la gelatina, producción de ureasa, hidrólisis de la caseína y crecimiento a 37 ºC. No redujo los carbohidratos sorbitol y manosa. De acuerdo a las características culturales, morfológicas, fisiológicas y bioquímicas se identificó como Leifsonia xyli subsp xyli, bacteria coryneforme que causa el raquitismo de la caña de azúcar.
Palabras clave adicionales: Fitopatología, bacteria, raquitismo
Identification and characterization of Leifsonia xyli subsp. xyli as sugarcane pathogen (Saccharum sp.) in the Centro Occidental region of Venezuela
ABSTRACT
Given that in experimental and commercial sugarcane fields in Lara and Yaracuy states, thin stalks with rachitic appearance were observed, the objectic of this paper was to identify and characterize the causal agent from isolations made in yeast extract, dextrose, and calcium carbonate (YDC). For the pathogenicity tests, healthy budwood were inoculated by injection of the bacterial suspension at the shaft at the nodal region. The isolations originated colonies white cream color, mucoid, and round shape, with whole borders, gelatinous consistency and brilliant aspect. Under optical microscopy were seen bacillary simple form with a slight swelling in the ends, wedge shaped, frecuently V-curved. From the pathogenicity tests, symptoms including a salmon pink discoloration just below the growing point of young cane and an orange red discoloration of the nodal vascular bundles in mature cane stalk developed. The symptoms were evidenced at fifteen days after inoculation and in the re-isolation identical colonies like the original ones were obtained. The isolate grew in the cultures YDC, NBY and D2 of Kado and Heskett. The bacterium was Gram positive, aerobic, acid reaction in red phenol dextrose agar, negative oxidase, and positive catalase. Negative nitrate reduction, indol production, starch hydrolysis, H2S from cysteine, gelatin liquefaction, urease production, casein hydrolysis and positive growth at 37 ºC. Negative carbohidrate reduction of sorbitol and mamnose. According to morphological, cultural, physiological and biochemical characteristics it was identified as Leifsonia xyli subsp xyli, coryneform bacterium causal agent of ratoon stunting disease of sugarcane.
Additional key words: Plant pathology, bacteria, stunting disease
Recibido: Julio 6, 2007 Aceptado: Febrero 24, 2008
INTRODUCCIÓN
El raquitismo de la caña de azúcar o RSD (derivado de la expresión inglesa ratoon stunting disease) fue reconocido por primera vez entre 1944 y 1945 en Queensland, Australia en la variedad Q28 (Gillaspie et al., 1973; Plata et al., 1986; Jiménez y Fernández, 1987). Desde entonces ha sido reportada en 47 países (Jiménez y Fernández, 1987; Aponte y Ordosgoitti, 1991; Reis y Mariano, 1994). En el país ha sido detectada en algunas variedades y su efecto sobre los rendimientos en tonelaje de caña por hectárea son muy marcados, siendo más evidentes cuando la variedad afectada tiene varios cortes o soca (Aponte y Ordosgoitii, 1991). En los primeros estudios se asoció su agente causal con un virus debido a que se transmitía de forma mecánica de un material a otro (Gillaspie, 1970). No obstante, Gillaspie et al. (1973) reportaron que RSD estaba relacionado con una bacteria pequeña de forma bacilar. Posteriormente, la bacteria fue aislada en cultivos axénicos y su patogenecidad fue comprobada (Davis et al., 1980). La bacteria fue descrita como un organismo no móvil, Gram-positivo, pleomórfico, el cual se dividía por fisión binaria transversal y presentaba mesosomas; y se le denominó Clavibacter xyli subsp. xyli. Posteriormente, este microorganismo fue reclasificado dentro del género Leifsonia conservando la especie y subespecie (Evtushenko et al., 2000).
Desde su reconocimiento ha sido la enfermedad bacteriana de mayor importancia en el cultivo de caña de azúcar, ya que causa pérdidas alrededor del 50 % en variedades extremadamente susceptibles (Reis y Mariano, 1994). Sin embargo, estos valores pueden aumentar si la planta se encuentra bajo un régimen de estrés hídrico o asociada con el virus del mosaico de la caña de azúcar (SCMV) (Nass et al., 1991; Reis y Mariano, 1994). Las pérdidas se derivan principalmente porque la bacteria se desarrolla en los vasos conductores afectando la habilidad de la planta para absorber y transpirar agua. Además puede inducir la formación de gel vascular pectináceo en los vasos del xilema aumentando la obstrucción en los tejidos. Las plantas se caracterizan por presentar un crecimiento irregular con tallos raquíticos, característica a la cual se le debe su nombre común. Sin embargo, estos síntomas no son muy confiables ya que pueden ser atribuibles a otras enfermedades o pueden desaparecer bajo condiciones de humedad (Jiménez y Fernández, 1987; Reis y Mariano, 1994). Los síntomas internos incluyen manchas de coloración salmón por debajo de los puntos de crecimiento de cañas jóvenes y una coloración naranja rojiza en los nudos (Reis y Mariano, 1994; Pan et al., 1998; Flores et al., 2004). Debido a que la bacteria es muy difícil de aislar, por la poca especificidad de sus síntomas y sus bajas concentraciones en la planta, se requieren grandes cantidades de jugo proveniente de tallos infectados y puntos de dilución altos; como métodos de diagnóstico se han utilizado las características morfológicas, fisiológicas, bioquímicas y microscopía electrónica (Jiménez y Fernández, 1987), técnicas moleculares (Lozano et al., 2003; Brumbley et al., 2006; Young et al., 2006) e inmunoensayos (Hoy et al., 1999; Peralta et al., 2001; Grisham et al., 2007). En la selección de fuentes de resistencia los diagnósticos también se han realizado mediante microscopía por contraste de fases y tinción de los vasos del xilema (Chinea et al., 2001). Por la importancia que representa la enfermedad en nuestro país y la necesidad de disponer del aislamiento de Leifsonia xyli subsp xyli a fin de ser empleado en técnicas inmunoquímicas y moleculares, se realizó esta investigación con el fin de identificar y caracterizar la bacteria causante del raquitismo de la caña de azúcar en la región Centroccidental de Venezuela.
MATERIALES Y MÉTODOS
Recolección de muestras
Se colectaron mediante muestreos al azar tallos delgados y pequeños, en los cuales, al realizar cortes longitudinales se observó en los haces fibrovasculares una coloración salmón. Los materiales fueron colectados en campos experimentales y comerciales de los estados Lara y Yaracuy, se colocaron en bolsas plásticas transparentes y fueron llevados al laboratorio para su procesamiento.
Aislamiento del patógeno
Se tomaron trocitos previamente lavados suavemente con agua corriente, los cuales fueron macerados en un mortero que contenía 3 ml de agua destilada estéril (ADE). Obtenido el macerado se tomó 0,5 mL y se colocó en un tubo de ensayo que contenía 3 ml de ADE, se sometió a agitación constante por 5 min y se verificó la presencia de flujo bacteriano mediante la emisión de un hilo viscoso. Luego se procedió a realizar los aislamientos, para ello, se tomaron secciones pequeñas de tallo, se desinfectaron en hipoclorito de sodio (NaOCl) al 2 % durante 2 min, se enjuagaron con ADE y se colocaron en un mortero estéril con 3 ml de ADE para ser macerados. El macerado resultante se trató de dos maneras: a) Se tomó una pequeña porción del macerado con el ansa de platino y se estriaron por agotamiento placas de Petri conteniendo YDC. b) Se realizaron diluciones seriadas hasta 10-6 y se sembró en medio de cultivo YDC, 0,1 mL de cada dilución, la cual, se extendió en toda la placa. Asimismo, el aislamiento se obtuvo a partir de la extracción del jugo, para ello se tomaron esquejes, se lavaron con ADE, se flamearon, posteriormente se cortaron trocitos y se procedió a colocarlos en un molino adaptado para la extracción y el jugo extraído fue sembrado por agotamiento en placas de YDC. Las placas se colocaron en bolsas plásticas y se incubaron en condiciones de laboratorio a una temperatura promedio de 27 ºC y HR máxima de 65 % y mínima de 54 %.
Prueba de patogenicidad
Para las pruebas de patogenicidad se prepararon suspensiones provenientes de cultivos puros de 24 h, se ajustaron a una concentración de 108 celulas.ml-1 usando los tubos 3 y 4 de la escala de McFarland (Barret, 1975) y se inocularon esquejes sanos de tallos de dos variedades de caña de azúcar susceptibles al raquitismo, SP 701284 y CC 8592. Se utilizaron dos métodos de inoculación: Inyección en la región nodal del tallo y el otro colocando un algodón impregnado con el inóculo en uno de los extremos del esqueje, método utilizado por Jiménez y Contreras (2004) al evaluar la patogenicidad de Xanthomonas albilineans.
Los tallos inoculados se colocaron en cámara húmeda constituida por una bandeja con papel absorbente estéril en el fondo, el cual se humedeció, luego se cubrió herméticamente con papel plástico. Por cada método de inoculación y variedad utilizada, se realizaron cuatro repeticiones, además de un testigo que fue tratado de la misma manera pero con agua destilada estéril (ADE). Éstos se incubaron a una temperatura promedio de 27 ºC y una HR promedio de 70% durante 30 días, realizando observaciones cada 8 días hasta notarse los síntomas típicos de la enfermedad.
Reaislamiento del organismo causal
Para realizar el aislamiento del patógeno, del área con síntomas se tomaron trozos de la zona de avance, se seccionaron y se lavaron con hipoclorito de sodio (NaOCl) al 2 % por 2 min; luego se lavó con ADE tres veces consecutivas para eliminar las trazas del producto, se colocaron en un mortero estéril y se maceraron con ADE para formar una suspensión. Una gota de esta suspensión se colocó en el centro de una placa de Petri conteniendo medio YDC y se distribuyó en toda la placa mediante un rastrillo de vidrio con la finalidad de obtener colonias aisladas. Se incubaron bajo condiciones de laboratorio durante 48 h para su posterior identificación.
Identificación y caracterización de la bacteria
Se hicieron varias pruebas para la identificación y caracterización del género y especie de la bacteria. Se realizaron observaciones morfológicas y fueron estudiadas las características bioquímicas y fisiológicas de acuerdo a métodos recomendados por otros investigadores (Evtushenko et al., 2000; Schaad et al., 2001; Flores et al., 2004).
Características culturales, morfológicas, fisiológicas y bioquímicas
Se estudiaron las características culturales de los aislamientos patogénicos en los medios de cultivos YDC y NBY (10 g extracto de levadura, 2 g de K2HPO4, 0,5 g de KH2PO4, 2,5 g de glucosa, 15 g de agar, 1 L de agua destilada). En estos medios se determinó color, brillo, elevación, bordes, y consistencia de las colonias.
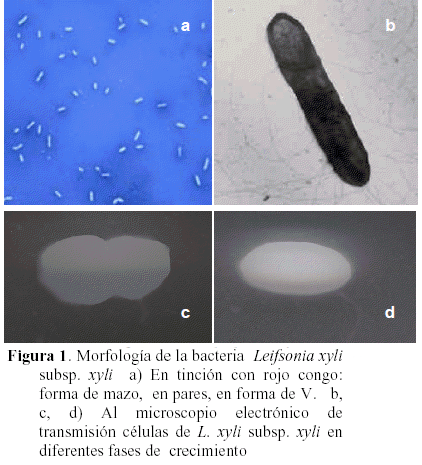
La forma de la bacteria se determinó mediante la tinción con rojo congo (French y Hebert, 1980; Schaad et al., 2001). Para el estudio de las propiedades fisiológicas y bioquímicas se hicieron las siguientes pruebas: Prueba de KOH al 3% (Suslow et al., 1982), prueba de Gram, prueba de anaerobiosis (Hugh y Leifson), prueba de aerobiosis (bactotioglicolato), bacto agar dextrosa rojo fenol, catalasa, oxidasa, hidrólisis de almidón, reducción de nitratos, producción de indol, producción de ácido sulfídrico, licuefacción de la gelatina, producción de ureasa, tolerancia al NaCl (3-5-7 %), hidrólisis de la caseína, crecimiento a 37º C, hidrólisis de esculina, producción de ácidos a partir de carbohidratos (Klement et al., 1990; Holt et al., 1994; Schaad et al., 2001). Finalmente se realizaron pruebas de crecimiento en los medios selectivos D2, D3, D4 y D5 (Kado y Heskett, 1970) para determinar género.
RESULTADOS
Aislamiento del patógeno
A partir de muestras de diluciones del jugo de tallos enfermos de caña de azúcar se aislaron consistentemente colonias bacterianas de color crema, mucoides, circulares, de bordes enteros, consistencia gelatinosa y aspecto brillante, las cuales crecieron a los 12 días después de la siembra en el medio YDC y vistas al microscopio óptico presentaron forma bacilar simple con un ligero hinchamiento en los extremos asemejando la forma de mazo o en pares unidas por el extremo formando una V (Figura 1a) y en el microscopio electrónico de transmisión se observó la morfología típica de las células bacterianas en diferentes fases de crecimiento (Figuras 1b, 1c, 1d).
Prueba de patogenicidad
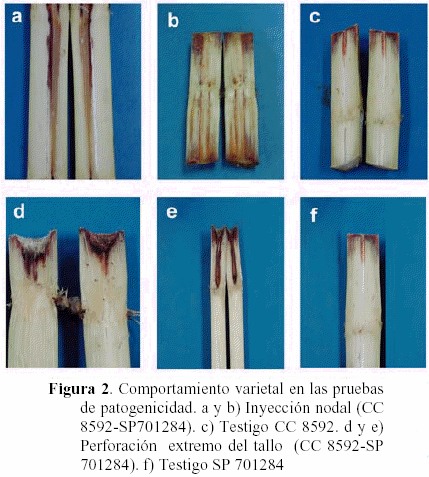
Después de 15 días los tallos tratados con el primer método de inoculación, es decir, inyección de la suspensión bacteriana en la región nodal, desarrolló en la variedad CC 8592 lesiones color salmón cerca de la región inoculada avanzando a lo largo de los vasos xilemáticos en la variedad CC 8592 (Figura 2a). En la variedad SP 701284 también se presentó la misma sintomatología (Figura 2b), aunque presentaron algunos síntomas similares, esta variedad fue más susceptible a la oxidación que la CC 8592.
En cuanto al método en el cual se perforó un extremo del tallo y se impregnó con inóculo, después de 30 días se manifestaron los síntomas pero no tan evidentes como en el primer procedimiento. Se observó el avance de la infección de coloración salmón a lo largo de los haces vasculares (Figuras 2d, 2e). En ambos métodos de inoculación en el tratamiento testigo no se desarrollaron estos síntomas, sólo regiones de coloración rojiza ocasionadas por procesos oxidativos de los tejidos (Figuras 2c y 2f).
Al realizar el reaislamiento de la bacteria a partir de las zonas con síntomas se obtuvieron colonias de coloración crema, mucoides y brillantes. Las bacterias observadas al microscopio óptico (100x) después de la tinción con rojo congo, presentaron forma idéntica a los aislamientos originales. Para verificar que las lesiones observadas en los tratamientos testigos eran producidas por procesos oxidativos, se tomaron trozos de éstas y se les aplicó el mismo procedimiento descrito anteriormente para obtener el reaislamiento. Se obtuvieron colonias de coloración amarilla brillante que al ser observadas al microscopio óptico (100x) después de la tinción con rojo congo, eran bacterias no fitopatógenas, corroborándose con ello que la coloración rojiza se debía a procesos de oxidación de los tejidos.
Identificación y caracterización de la bacteria
En el Cuadro 1 se presentan las características culturales de la bacteria en diferentes medios de cultivo. En las Figuras 3a, 3b y 3c se observa el crecimiento en los medios AN, D2 y NBY, respectivamente. En el Cuadro 2 y Figuras 3b y 3d puede observarse que la bacteria creció en el medio diferencial D2 de Kado y Heskett y no hubo crecimiento en los medios D3, D4 y D5 coincidiendo este resultado con lo citado para el género Corynebacterium (Kado y Heskett, 1970).
Cuadro 1. Características culturales de la bacteria aislada de caña de azúcar en diferentes medios de cultivo
| Medio de cultivo | Aislamiento |
| Dextrosa, carbonato de calcio, extracto de levadura (YDC) | Colonias color blanco-crema |
| Caldo nutritivo, extracto de levadura (NBY) | Colonias color blanco-crema |
Cuadro 2. Medios de cultivo diferenciales (Kado y Heskett) utilizados en la caracterización de la bacteria aislada de caña de azúcar
| Medio de cultivo | Colonia |
| D2 | Color blanco-crema |
| D3 | No hubo crecimiento |
| D4 | No hubo crecimiento |
| D5 | No hubo crecimiento |
D2 (Selectivo para Corynebacterium), D3 (Selectivo para Erwinia), D4 (Selectivo para Pseudomonas), D5 (Selectivo para Xanthomonas)
El Cuadro 3 muestra las características morfológicas, fisiológicas y bioquímicas de la bacteria aislada de caña de azúcar. Ésta resultó catalasa positiva, Gram positiva, aeróbica, reacción ácida en bacto agar dextrosa rojo fenol, y negativa para las pruebas de la oxidasa, hidrólisis de almidón, reducción de nitratos, producción de indol, producción de ácido sulfídrico, licuefacción de la gelatina, producción de ureasa, hidrólisis de la caseína, crecimiento a 37 ºC, hidrólisis de la esculina, toleró concentraciones de 3, 5 y 7 % de NaCl, y no produjo ácidos a partir de los carbohidratos, sorbitol, ribosa, y melezitosa.
Cuadro 3. Características morfológicas, fisiológicas y bioquímicas de la bacteria aislada de caña de azúcar
| Prueba | Reacción | Prueba | Reacción |
| Coloración de Gram | Gram positiva | Tolerancia al NaCl |
|
| Prueba de KOH al 3% | Gram positiva | 3% | + |
| Rojo congo (forma) | Bacilar simple (mazo o V) | 5% | + |
| Oxidasa | - | 7% | + |
| Catalasa | + (Reacción lenta) | 8% | - |
| Anaerobiosis (Hugh y Leifson) | - | Hidrólisis de la caseína | - |
| Bactotioglicolato | Aeróbica | Crecimiento a 37º C | - |
| Agar dextrosa rojo fenol | Ácida | Producción de ácidos: |
|
| Hidrólisis de la esculina | - | Sorbitol | - |
| Reducción de nitratos | - | Glucosa | - |
| Producción de indol | - | Arabinosa | - |
| Hidrólisis del almidón | - | Trehalosa | - |
| Producción de H2S | - | Ribosa | - |
| Licuefacción de la gelatina | - | Celobiosa | - |
| Producción de ureasa | - | Melezitosa | - |
Se utilizaron tres aislamientos y tres repeticiones. + = reacción positiva; - = reacción negativa
DISCUSIÓN
La sintomatología desarrollada en la plantas inoculadas en la prueba de patogenicidad coincidió con la exhibida por las muestras de caña traídas al laboratorio, como manchas acuosas de color salmón a lo largo de los haces fibrovasculares. Igualmente, los síntomas presentaron similitud a los descritos por otros autores (Reis y Mariano, 1994; Pan et al., 1998; Flores et al., 2004). Asimismo, las pruebas presuntivas realizadas a los reaislamientos coincidieron con el aislamiento bacteriano original. Por lo tanto, se comprobó que el aislamiento era patogénico y el causante de la enfermedad en caña de azúcar.
Al confrontar los resultados obtenidos en el aislamiento con los estudios hechos por otros autores en cuanto a las pruebas de Gram, aerobiosis y el crecimiento en el medio diferencial D2, se ubica a la bacteria estudiada en el grupo de las corineformes (Kado y Heskett, 1970; Davis, 1986; Schaad et al., 2001). En cuanto a la formación de colonias de color blanco crema en diversos medios (Cuadros 1 y 2) y producción de ureasa negativa, concuerda con lo señalado por varios autores (Klement et al., 1990; Holt et al., 1994; Shaad et al., 2001) para el género Clavibacter. La no producción de pigmentos en el medio NBY, es una característica únicamente de C. michiganensis subsp. sepedonicus y de C. xyli subsp. xyli, lo que hace diferenciarlas de todas las demás (Davis, 1986; Holt et al., 1994; Schaad et al., 2001). Sin embargo, la producción de ácidos a partir de sorbitol permitió diferenciar a C. m. subsp. sepedonicus de C. x. subsp. xyli ya que esta última no lo produce. Se diferenciaron C. x. subsp. xyli y C. x. subsp. cynodontis por la hidrólisis del almidón que es positiva para la subsp. cynodontis y negativa para la subsp. xyli (Cuadro 3) y la producción de pigmento de color amarillo en la subsp. cynodontis la diferencia de la subsp. xyli, la cual, no produce pigmentos (Holt et al., 1994; Evtushenko et al., 2000; Schaad et al., 2001). Las pruebas de anaerobiosis, reducción de nitratos, producción de ácido sulfídrico, indol y no crecimiento a 37 ºC coinciden con los resultados obtenidos por Jiménez y Fernández (1987), Evtushenko et al. (2000) y Flores et al. (2004). Los resultados de las pruebas anteriormente mencionadas identifican a la bacteria como Clavibacter xyli subsp. xyli, reclasificada hoy día como Leifsonia xyli subsp. xyli (Evtushenko et al., 2000). Esta bacteria señalada en la literatura como la causante del raquitismo de la caña de azúcar, es de mucha importancia en el país, así como la conservación del aislamiento bacteriano del patógeno obtenido en este trabajo, para futuras investigaciones en las áreas de mejoramiento genético, epidemiología y aplicación de metodologías de diagnóstico enmarcadas en el área de la biotecnología, entre otras.
CONCLUSIONES
De acuerdo a la sintomatología observada en plantas de caña de azúcar en campos comerciales de los estados Lara y Yaracuy, a los resultados positivos de las pruebas de patogenicidad, a las características morfológicas, culturales, fisiológicas y bioquímicas de los aislamientos, se comprobó que los síntomas observados son causados por la bacteria Leifsonia xyli subsp. xyli agente causal del raquitismo de la caña de azúcar.
AGRADECIMIENTO
Trabajo realizado con financiamiento del Consejo de Desarrollo Científico y Humanístico (CDCHT) de la Universidad Centroccidental Lisandro Alvarado. Proyecto Código 026-AG-2006.
LITERATURA CITADA
1. Aponte, A. y A. Ordogoitii. 1991. Resultados de las investigaciones en enfermedades de la caña de azúcar en Venezuela en el período 1986-1989. Caña de Azúcar 9: 53-65. [ Links ]
2. Barret, T. 1975. Preparation of bacterial vaccine. In: Proceeding of the first workshop of phytobacteriology. R.N. Goodman (ed.). Columbia. University of Missouri. pp. 1-6. [ Links ]
3. Brumbley, S.M., L.A. Petrasovits, S.R. Hermann, A.J. Young y B.J. Croft. 2006. Recent advances in the molecular biology of Leifsonia xyli subsp. xyli: causal organism of ratoon stunting disease. Australasian Plant Pathology 35(6): 681-689. [ Links ]
4. Chinea, A., G. Pérez, Prada de F. L, M. Matos y F. Pérez. 2001. Fuentes de resistencia al raquitismo de los retoños de caña de azúcar. IV Seminario Científico Internacional de Sanidad Vegetal. Varadero, Cuba. p. 251 [ Links ]
5. Davis, M., A. Gillaspie, R. Harris, R. Lawson. 1980. Ratoon stunting disease of sugarcane: Isolation of the causal bacterium. Science. 210: 365-367. [ Links ]
6. Davis, M. 1986. Taxonomy of plant-pathogenic coryneform bacteria. Ann. Rev. Phytopathology. 24: 115-140. [ Links ]
7. Evtushenko, LI., L. Dorofeeva, S.Subbotin, J. Cole y J. Tiedje. 2000. Leifsonia poae gen. nov., sp. nov., isolated from nematode galls on Poa annua, and reclassification of Corynebacterium aquaticum Leifson 1962 as Leifsonia aquatica (ex Leifson 1962) gen. nov., nom. rev., comb. nov. and Clavibacter xyli Davis et al. 1984 with two subspecies as Leifsonia xyli (Davis et al. 1984) gen. nov., comb. nov. Int.. J. Syst. Evol. Microbiol. 50: 371-380. [ Links ]
8. Flores, C., D. Mendoza, J. Pérez, y J. Castillo. 2004. Identificación de Clavibacter xyli subsp. xyli causante de RSD en caña de azúcar. 34º Congreso Nacional de Microbiología, Cancún, México. Resúmenes p. 66. [ Links ]
9. French, E. y T. Hebert. 1980. Métodos de investigación fitopatológica. Editorial IICA. San José. Costa Rica. 289 p. [ Links ]
10. Gillaspie, A. 1970. Evidence that RSD of sugarcane is caused by a virus and not a mycoplasma. Phytopathology. 60: 448-450. [ Links ]
11. Gillaspie, A., R. Davis y J. Worley. 1973. Diagnosis of ratoon stunting disease based on the presence of a specific microorganism. Plant Disease Reporter 57: 987-990. [ Links ]
12. Grisham, M.P., Y.B. Pan y E.P. Richard Jr. 2007. Early Detection of Leifsonia xyli subsp: xyli in Sugarcane Leaves by Real Time Polymerase Chain Reaction. Plant Disease 91: 430-434. [ Links ]
13. Holt, J., N. Krieg, P. Sereath, J. Staley y S. Williams. (eds). 1994. Bergeys Manual of Determinative Bacteriology. William & Wilkins. Baltimore. 1093 p. [ Links ]
14. Hoy, J., M. Grisham y K. Damann. 1999. Spread and increase of ratoon stunting disease of sugarcane and comparison of disease methods. Plant Disease, 83: 1170-1175. [ Links ]
15. Jiménez, L. y B. Fernández. 1987. Distribución, incidencia y comparación fenotípica de cepas de Clavibacter xyli subsp. xyli, causante del raquitismo del retoño de la caña de azúcar en Costa Rica. Agronomía Costarricense, 11: 103-108. [ Links ]
16. Jiménez, O. y N. Contreras. 2004. Xanthomonas albilineans agente causal de la escaldadura foliar de la caña de azúcar (Saccharum sp.). Rev. Fac. Agron. (LUZ) 21: 233-245. [ Links ]
17. Kado, C. y M. Heskett. 1970. Selective Media for isolation of Agrobacterium, Corynebacterium, Erwinia, Pseudomonas and Xanthomonas. Phytopathology, 60: 969-976. [ Links ]
18. Klement, Z., K. Rudolph y D. Sands. 1990. Methods in Phytobacteriology. Akademiai. Kiado. Budapest. [ Links ]
19. Lozano, A.I., M. Díaz, E. Peralta, V. Pazos y E. Alvarez. 2003. Diagnóstico del raquitismo de la caña de azúcar (Leifsonia xyli subsp. xyli) mediante la técnica de la reacción en cadena de la polimerasa anidada (nPCR). Rev. Protección Veg. 18(1): 19-22. [ Links ]
20. Nass, H., H. Rodríguez y L. Alemán. 1991. Situación actual de las enfermedades de la caña de azúcar en la región centro occidental de Venezuela. Caña de azúcar, 9: 99-109. [ Links ]
21. Pan, Y., M. Grisham y D. Burner. 1998. A polymerase chain reaction protocol for detection of Clavibacter xyli subsp. xyli, the causal bacterium of sugarcane ratoon stunting disease. Plant Disease, 82: 285-290. [ Links ]
22. Peralta, E., M. Díaz, J. Milián, D. Martín y V. Pazos. 2001. Comparación de métodos para la detección del raquitismo de los retoños de la caña de azúcar (Leifsonia xyli subsp. xyli). 41a Reunión anual de la Sociedad Fitopatológica Americana-División del Caribe. Varadero, Cuba. Resúmenes p. 71. [ Links ]
23. Plata, M., M. Davis y S. Pueppke. 1986. In vitro growth and storage of two subspecies of Clavibacter xyli. Turrialba, 36: 215-218. [ Links ]
24. Reis, A. y R. Mariano. 1994. O gênero Clavibacter no Brasil. Summa Phytopathologica, 20: 83-88. [ Links ]
25. Schaad, N.W, J.B. Jones y W. Chun. 2001. Laboratory Guide for Identification of Plant Pathogenic Bacteria. APS Press. Minessota. 373 p. [ Links ]
26. Suslow, T., M. Schroth y M. Isaka. 1982. Application of rapid method for gram differentiation of plant pathogenic and saprophytic bacteria without staining. Phytopathology, 72: 917-918. [ Links ]
27. Young, A.J., L.A. Petrasovits, B.J. Croft, M. Gillings y S.M. Brumbley. 2006. Genetic uniformity of international isolates of Leifsonia xyli subsp. xyli, causal agent of ratoon stunting disease of sugarcane. Australasian Plant Pathology, 35(5): 503-511. [ Links ]