Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro v.23 n.3 Barquisimeto dic. 2011
Extracción, caracterización y cuantificación de los fructanos contenidos en la cabeza y en las hojas del Agave tequilana Weber azul
José Montañez-Soto1, José Venegas-González1, María Vivar-Vera2 y Emma Ramos-Ramírez3
1 Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional del Instituto Politécnico Nacional (IPN). Unidad Michoacán. Jiquilpan, Mich. C.P. 59510, México. e-mail: montasoto@yahoo.com.mx
2 Instituto Tecnológico de Tuxtepec. Tuxtepec, Oaxaca. C.P. 68350, México
3 Dpto. Biotecnología y Bioingeniería. Centro de Invest. y Estudios Avanzados del IPN. C.P. 07300. México, D.F.
RESUMEN
Se obtuvieron las cabezas y las hojas de diez plantas de Agave tequilana Azul, las hojas fueron clasificadas en hojas jóvenes, maduras y secas; las hojas maduras fueron divididas en bases y puntas, y se determinó la contribución de cada fracción en el peso total de la planta. Las cabezas, bases y puntas fueron secadas y molidas para obtener sus harinas respectivas. Se realizó el análisis químico porcentual, contenido de fibra dietética, y se determinaron las condiciones óptimas (relación sólidos-agua, temperatura y tiempo de maceración) para extraer los fructanos de las harinas. Se determinó el contenido de azúcares reductores directos (ARD) y totales (ART), inulina y fructooligosacaridos (FOS), glucosa (G) y fructosa (F), así como el grado de polimerización promedio (GPP) y peso molecular promedio (PMP) de los fructanos presentes en los extractos. Se encontró que las plantas del agave estaban integradas por: cabeza 53,7 %, hojas maduras 38,6 % (bases 23,8 % puntas 14,8 %), hojas secas 5,8 % y hojas jóvenes 1,9 %. En base seca los carbohidratos constituyen el principal componente de todas las fracciones del agave y están integrados por: cabeza (ART 80,20 %, inulina 43,24 %, FOS 24,96 %, ARD 12,00 %), bases (ART 56,36 %, inulina 24,52 %, FOS 13,66 %, ARD 18,18 %), y puntas (ART 26,3 %, inulina 2,25 %, FOS 6,24 %, ARD 17,81 %). La inulina y los FOS presentes en la cabeza de la planta son de mayor GPP y PMP. De acuerdo con su perfil de carbohidratos, las cabezas y las bases de las hojas maduras del agave pueden utilizarse para la producción de jarabes de alta fructosa, fructosa cristalina, inulina y FOS, insumos ampliamente utilizados en la industria de alimentos y bebidas.
Palabras clave adicionales: Inulina, fructosa, fructooligosacaridos, tequila, fibra dietética
Extraction, characterization and quantification of the fructans contained in head and leaves of Agave tequilana Weber azul
ABSTRACT
Heads and leaves of ten Agave tequilana Azul plants were collected; leaves were classified as young, mature, and dry; mature leaves were divided into bases and tips, and the contribution of each fraction in the plant total weight was determined. Heads, bases, and tips were dried and ground to get their respective flour. Chemical analysis, dietary fiber content and optimal conditions (water-solid ratio, temperature, and soaking time) to extract fructans from each flour were performed. Determination in extracts included direct reducing sugars (DRS) and total (TRS), inulin and fructooligosaccharides (FOS), glucose (G) and fructose (F), the average degree of polymerization (ADP) and average molecular weight (AMW) of the fructans. It was found that the agave plants were composed by: head (53.7 %), mature leaves (38.6 %; bases 23.8 % and tips 14.8 %), dry leaves (5.8%), and young leaves (1.9 %). Carbohydrates represent the main constituent of all fractions of agave and are integrated by: heads (TRS 80.20 %; inulin 43.24 %, FOS 24.96% and DRS 12.00 %), bases (TRS 56.36 %; inulin 24.52 %, FOS 13.66% and DRS 18.18 %), and tips (TRS 26.3 %; inulin 2.25 %, FOS 6.24 % and DRS 17.81 %). Inulin and FOS present in the head of agave have greater ADP and AMW. According to their carbohydrate profile, heads and bases of mature leaves of agave plants can be used for the production of high fructose syrups, crystalline fructose, inulin and FOS, products widely used in the food and beverage industry.
Additional key words: Inulin, fructose, fructooligosaccharides, tequila, dietary fiber
Recibido: Octubre 15, 2010 Aceptado: Julio 1, 2011
INTRODUCCIÓN
El género Agave se considera originario de México, donde se encuentran 272 de las 310 especies reportadas, con 135 especies endémicas (García, 2002). Varias especies son económicamente importantes, entre ellas el Agave tequilana Weber Azul, el cual constituye la materia prima para la producción de tequila (Peña et al., 2004).
La parte aérea de la planta está integrada por dos fracciones principales: hojas y tallo. El tallo y las bases de las hojas que se unen a él comprenden la porción conocida con el nombre de cabeza o piña (Iñiguez, 2001), la cual posee un alto contenido de fructanos, y una vez cosechada se utiliza para la producción de tequila (Lamas et al., 2004).
Los fructanos son polímeros de fructosa que constituyen los principales carbohidratos de reserva; sólo contienen un residuo de glucosa en el extremo reductor de la molécula (Edelman y Jefford, 1968) y en el agave se almacenan en la cabeza de la planta (Iñiguez, 2001). El contenido de fructosa en estos polímeros varía de acuerdo a su grado de polimerización promedio (GPP). Los fructanos son sintetizados a partir de sacarosa y se clasifican como inulinas o levanas; sin embargo, se pueden presentar una variedad de estructuras complejas. Este es el caso de los fructanos del A. tequilana Azul, los que debido a su alto grado de ramificación, han sido nombrados agavinas (López et al., 2003). Por otra parte, derivados de la hidrólisis de estos fructanos se tienen los fructooligosacáridos (FOS), los cuales poseen bajo peso molecular y grado de polimerización menor a 10 unidades de fructosa (Spiegel et al., 1994; Mancilla y López, 2006).
En México, el A. tequilana Azul se cultiva de manera intensiva en una superficie superior a 120.000 hectáreas, y el precio del producto, regido por la oferta y la demanda, ocasiona altibajos en su producción, lo cual repercute en el abasto de esta materia prima a la industria tequilera. Esta industria demanda anualmente un volumen aproximado de un millón de toneladas de cabezas de agave para la producción de tequila, actividad que también genera un volumen similar de hojas que actualmente no se utilizan (CRT, 2009). Por ello, el objetivo del presente trabajo consistió en determinar la composición y características químicas de las diferentes fracciones de la planta de A. tequilana Azul y en base a ello, proponer y desarrollar usos alternativos para cada uno de estas fracciones y de esta forma, lograr el aprovechamiento integral de la planta.
MATERIALES Y MÉTODOS
Durante la cosecha de un cultivo de A. tequilana Azul con ocho años de edad, ubicado en Atotonilco el Alto, Jalisco, México, se seleccionaron diez plantas al azar, cuyas hojas fueron separadas de la cabeza y fueron clasificadas en hojas jóvenes, maduras y secas; las hojas maduras fueron cortadas para obtener las bases y puntas, y se determinó la contribución de cada fracción al peso húmedo total de las plantas; todo esto se realizó in situ y luego las hojas jóvenes y las secas se eliminaron del estudio. En el laboratorio, las cabezas de agave fueron cortadas diametralmente en rodajas de 10 mm de espesor mediante una sierra eléctrica, mientras que las bases y las puntas de las hojas maduras fueron cortadas longitudinalmente en tiras de 10 mm de espesor, y se determinó su contenido de humedad a través de la pérdida de peso luego de secadas a 60 ºC durante cinco días. Los materiales secos fueron triturados en un molino de martillos y más tarde en un molino coloidal con el objeto de obtener un polvo fino de malla 200, el cual se almacenó en recipientes herméticos.
La composición química proximal de cada una de las harinas obtenidas se obtuvo de acuerdo a los métodos oficiales de análisis (AOAC, 1997), los cuales incluyeron la humedad (925,10), cenizas (923,03), lípidos (920,39) y proteínas (920,87); los carbohidratos totales se determinaron por método espectrofotométrico (Dubois et al., 1956) y la fibra cruda se calculó por diferencia. El contenido de fibra dietética soluble, insoluble y total se determinó de acuerdo al método descrito por Prosky et al. (1988).
Para la extracción de los fructanos contenidos en las harinas se ensayaron tres diferentes relaciones sólido:agua (1:3, 1:6 y 1:9). Una vez conocida la mejor relación se prepararon dispersiones que fueron colocadas en frascos y llevados a un baño maría con agitación constante a diferentes temperaturas (20, 25, 30, 50, 60, 70 y 95 °C) y diferentes tiempos de maceración (5, 10, 20, 30, 40, 60 y 90 minutos), generándose 49 combinaciones. Luego fueron centrifugadas a 10.000 rpm durante 10 minutos y en los extractos se determinó el contenido de azúcares reductores totales (Miller, 1959), resultado que fue utilizado como variable de respuesta para encontrar la temperatura y tiempo óptimos de maceración para la extracción de los fructanos.
Para la caracterización y cuantificación de los carbohidratos, se determinaron en los extractos originales los azúcares reductores directos (ARD) y totales (ART) (Miller, 1959); también se determinó su contenido de glucosa (G) (Trinder, 1969) y la fructosa (F) se determinó como: F=ARD-G.
Posteriormente se determinaron los fructooligosacaridos (FOS) por el método de Wight y Niekerk (1983), el cual requiere someter los extractos a una hidrólisis previa mediante la enzima invertasa de Saccharomyces cerevisiae. En los extractos ya hidrolizados se determinó nuevamente el contenido de azúcares reductores directos (ARD1), glucosa (G1) y la fructosa (F1), mientras que los FOS se determinaron como FOS=ARD1-ARD. La glucosa y fructosa de los FOS se determinaron como GFOS=G1-G y FFOS=F1-F, respectivamente.
Finalmente, para determinar el contenido de inulina, los extractos fueron sometidos a un proceso de hidrólisis ácida con HCl 2M a 70 ºC por 30 minutos. En los extractos ya hidrolizados se determinó el contenido de ART, glucosa total (GT) y fructosa total (FT), y el de la inulina (INU) como INU=ART-(ARD+FOS). La glucosa y fructosa de la molécula de inulina se determinaron como GINU=GT-G1 y FINU=FT-F1, respectivamente.
Dado que los fructanos contienen sólo un residuo de glucosa (Edelman y Jefford, 1968), el grado de polimerización promedio de los fructooligosacaridos (GPPFOS) se determinó como GPPFOS=(FFOS-GFOS)/GFOS, y el de las inulinas (GPPINU) como GPPINU=(FINU-GINU)/GINU. Por último, el peso molecular promedio (PMP) de los fructanos se determinó multiplicando su GPP por 162, es decir, el peso molecular de un residuo de fructosa o glucosa que integran la molécula del fructano correspondiente; así, el PMP de los fructooligosacaridos (PMPFOS) se obtuvo como PMPFOS=162*GPPFOS, mientras que el de la inulina se obtuvo como PMPINU=162*GPPINU (Livingston III, 1990).
Todas las determinaciones se hicieron por triplicado y los resultados fueron comparados mediante análisis de varianza y pruebas de medias para encontrar diferencias entre los diferentes tratamientos utilizando el programa SPSS 12.0.
RESULTADOS
El peso húmedo promedio de las plantas de A. tequilana Azul fue de 91,1 kg y estuvo comprendido dentro del intervalo de 59 a 128 kg, mientras que el peso húmedo promedio de las cabezas de la planta fue de 48,9 kg y osciló entre 32 a 67,8 kg (Cuadro 1). La cabeza representó el 53,7 % del peso total de la planta, y el resto por las hojas. El bajo número de hojas jóvenes se atribuye a que el cultivo ya había alcanzado su madurez fisiológica, estado en que estas plantas ya no crecen (Iñiguez et al., 2001). Las hojas jóvenes y las secas se eliminaron de este estudio, debido a su escasa contribución a la biomasa total del cultivo.
Cuadro 1. Integración del peso húmedo total de las plantas de A. tequilana Azul
| Componente | Peso promedio (kg)a | Relación (%)b |
| Planta completa | 91,1 ± 22,2 | 100,0 |
| Cabeza | 48,9 ± 11,4 | 53,7 ± 3,5 |
| Hojas jóvenes | 1,7 ± 0,5 | 1,9 ± 0,1 |
| Hojas maduras |
|
|
| Punta de hoja | 13,5 ± 5,0 | 14,8 ± 3,2 |
| Base de hoja | 21,7 ± 5,1 | 23,8 ± 1,6 |
| Hojas secas | 5,3 ± 1,6 | 5,8 ± 0,6 |
a: promedio de 10 plantas ± SD; b: porcentaje del componente respecto al peso total de la planta
El contenido de humedad, cenizas, lípidos, proteínas y fibra cruda fue mayor en las puntas de las hojas y disminuyó hacia la cabeza de la planta (Cuadro 2); lo contrario ocurrió con los carbohidratos, cuyo contenido fue mayor en la cabeza y disminuyó hacia las puntas de las hojas. No se detectó diferencia significativa (P>0,05) en el contenido de humedad en las bases y en las puntas de las hojas. Tampoco en el contenido de lípidos y proteínas entre la base de las hojas y cabeza o piña del agave.
Cuadro 2. Composición química de las diferentes fracciones de A. tequilana Azul
| Fracción | Análisis químico (% en base húmeda) | |||||
| Humedad | Cenizas | Lípidos | Proteínas | Fibra cruda | Carbohidratos | |
| Punta de hoja | 81,13 a | 2,68 a | 0,26 a | 0,96 a | 9,86 a | 5,11 a |
| Base de hoja | 79,41 a | 1,76 b | 0,12 b | 0,64 b | 6,24 b | 11,83 b |
| Cabeza | 71,10 b | 1,16 c | 0,10 b | 0,62 b | 4,00 c | 23,02 c |
Letras diferentes en la misma columna indican diferencias significativas según la prueba de Duncan (P≤0,05)
La concentración de carbohidratos en la cabeza del agave fue mayor a la encontrada en las bases y en las puntas de las hojas de la planta. Después de los carbohidratos, la fibra cruda representó el principal constituyente en todas las fracciones de la planta de agave, excepto en las puntas de las hojas, en donde se observó mayor promedio de fibra cruda que de carbohidratos.
A la fibra cruda también se le conoce con el nombre de fibra dietética insoluble (Flamm et al., 2001) debido a que sus componentes (celulosa, hemicelulosa y lignina) son insolubles en agua y por ello, el contenido de fibra cruda (en base seca) fue bastante similar al contenido de fibra dietética insoluble, especialmente en la cabeza y base de la hoja de la planta (Cuadro 3).
Cuadro 3. Contenido de fibra dietética en las diferentes fracciones de A. tequilana Azul
| Fracción | Contenido de fibra dietética (% en base seca) | ||
| Insoluble | Soluble | Total | |
| Punta de hoja | 51,65 a | 28,15 c | 79,80 b |
| Base de hoja | 30,13 b | 57,62 b | 87,75 a |
| Cabeza | 13,65 c | 78,80 a | 92,45 a |
Letras diferentes en la misma columna indican diferencias según la prueba de Duncan (P≤0,05)
El contenido de fibra dietética insoluble fue mayor en la punta de las hojas y disminuyó hacia la cabeza de la planta; lo contrario ocurrió con la fibra dietética soluble, cuyo contenido fue mayor en la cabeza y disminuyó hacia la punta de las hojas. La fibra soluble más la fibra insoluble conforman la fibra dietética total, la cual fue menor en las puntas de las hojas y se incrementó hacia la cabeza; no se observaron diferencias significativas (P>0,05) en su contenido entre la base de la hoja y la cabeza de la planta.
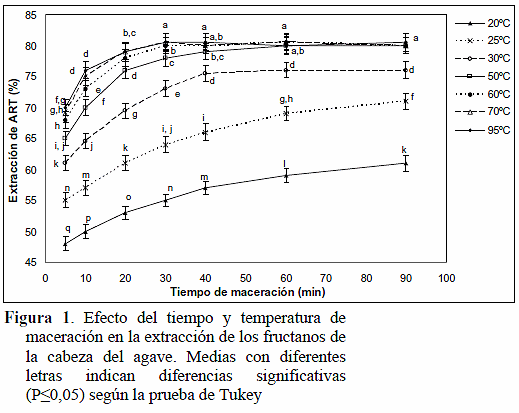
Las dispersiones realizadas a una relación sólido:agua de 1:3 no se hidrataron totalmente y las obtenidas a una relación de 1:9 estuvieron muy diluidas, mientras que las preparadas a una relación de 1:6 se mostraban completamente hidratadas, con una consistencia que facilitaba su manejo, por lo que se adoptó esta relación como la condición óptima para realizar la extracción de los carbohidratos contenidos en el agave. Por otra parte, se obtuvo que la mejor combinación de tiempo y temperatura para realizar la maceración fue de 30 minutos a 60 ºC, o bien 60 minutos a 50 ºC; dado que no hubo diferencias estadísticas significativas (P>0,05) en la cantidad de ART extraídos a otras relaciones de tiempo y temperatura de maceración superiores (Figura 1).
Con base en lo anterior, la extracción de los fructanos se realizó empleando una relación sólido:agua de 1:6 durante 30 minutos a 60 ºC. Bajo estas condiciones de extracción y, basados en el contenido de carbohidratos totales en cada fracción de la planta, en un solo ciclo de extracción sólo fue posible extraer cerca del 80 % de los carbohidratos totales contenidos en la cabeza del agave, por lo que fue necesario realizar tres ciclos de extracción para obtener una cantidad superior al 98 % del total de los carbohidratos contenidos en las diferentes fracciones.
Resultó más sencillo extraer los carbohidratos contenidos en la cabeza del agave que los que se encuentran en las bases o en las puntas de las hojas maduras, atribuible al hecho de que estas últimas fracciones tienen un mayor contenido de fibra cruda, la cual dificulta la solubilidad y por lo tanto, la extracción de los carbohidratos.
Al evaluar la integración de los carbohidratos contenidos en las diferentes fracciones de la planta de agave (Cuadro 4), se observó la presencia en las hojas de la mayor concentración de azúcares libres determinados como ARD a la vez que no existieron diferencias significativas (P>0,05) entre la cantidad de ARD presentes en la punta y base de las hojas. Se encontró que los ARD constituyen el principal componente de los ART presentes en la punta de la hoja de agave, seguido por los FOS y una mínima cantidad de inulina. Por otra parte, en las bases de las hojas maduras prevaleció la inulina, seguida por los ARD y por último los FOS. Tanto el contenido de FOS como de inulina fueron menores en la punta de la hoja y aumentaron hacia la cabeza de la planta. En esta última predomina la inulina, seguida por los FOS y una menor cantidad de ARD. Dado que los ART constituyen la suma de ARD, FOS e inulina, su contenido resultó mayor en la cabeza y disminuyó hacia la punta de las hojas de la planta.
Cuadro 4. Integración de los azúcares reductores totales contenidos en las diferentes fracciones de la planta de A. tequilana Azul
| Fracción | Componente (% base seca) | |||
| ARD | FOS | Inulina | ART | |
| Punta de hoja | 17,81 a | 6,24 c | 2,25 c | 26,30 c |
| Base de hoja | 18,18 a | 13,66 b | 24,52 b | 56,36 b |
| Cabeza | 12,00 b | 24,96 a | 43,24 a | 80,20 a |
ARD: azúcares reductores directos, FOS: fructooligosacaridos, ART: azúcares reductores totales. Letras diferentes en la misma columna indican diferencias significativas según la prueba de Duncan (P≤0,05)
El Cuadro 5 muestra la relación fructosa y glucosa que prevaleció en los diferentes fructanos que constituyen los ART en las diferentes fracciones de la planta, así como el GPP y el PMP de los mismos. Se puede apreciar que no existieron diferencias significativas (P>0,05) en las cantidades de fructosa y glucosa entre la punta y base de las hojas. Tampoco hubo diferencias entre los GPP de los FOS contenidos en las distintas fracciones de la planta.
Cuadro 5. Contenido de fructosa y glucosa, grado de polimerización y peso molecular promedio de los fructanos contenidos en las diferentes fracciones del A. tequilana Azul
| Carbohidrato | Fracción | Fructosa (%) | Glucosa (%) | GPP | PMP (g·mol-1) |
| ARD | Punta de hoja | 14,83 a | 2,98 a | 1 | 180 |
| Base de hoja | 15,09 a | 3,09 a | |||
| Cabeza | 9,94 b | 2,06 b | |||
| FOS | Punta de hoja | 5,26 c | 0,99 c | 6,33 a | 1026 a |
| Base de hoja | 11,58 b | 2,08 b | 6,60 a | 1070 a | |
| Cabeza | 21,03 a | 3,93 a | 6,35 a | 1029 a | |
| Inulina | Punta de hoja | 2,12 c | 0,13 c | 17,26 b | 2796 b |
| Base de hoja | 23,18 b | 1,34 b | 18,34 b | 2971 b | |
| Cabeza | 41,56 a | 1,68 a | 25,75 a | 4171 a |
ARD: azúcares reductores directos, FOS: fructooligosacaridos, GPP: grado de polimerización promedio, PMP: peso molecular promedio. Letras diferentes entre renglones de la misma columna y carbohidrato, indican diferencias significativas (P≤0,05) según la prueba de Duncan
Se encontró que el tamaño promedio de las moléculas de inulina fue menor en las puntas de las hojas y se incrementa hacia la cabeza de la planta, donde alcanzan su tamaño máximo (GPP de 25,75 ± 0,30 unidades y PMP de 4171 ± 48 g·mol-1). Este tamaño promedio es similar a los reportados por López et al. (2003), aunque mayores a los reportados por Lamas et al. (2004), y las diferencias han sido atribuidas a la edad de la planta y condiciones de cultivo (Valenzuela, 1997; Lamas et al., 2004; Pimienta et al., 2006), así como a la metodología empleada para su identificación y cuantificación (López et al., 2003).
DISCUSIÓN
Los altos valores de la desviación estándar (SD) obtenidos en el peso húmedo tanto de las plantas completas como de las cabezas del agave (22,2 y 11,4 kg, respectivamente) (Cuadro 1) son indicativos de la alta dispersión registrada en el tamaño de la planta. No obstante, las variaciones resultaron inferiores a las reportadas por Iñiguez et al. (2001), lo cual puede atribuirse a que ellos obtuvieron sus muestras a partir de diferentes plantaciones de agave, las cuales pudieron haber tenido distintas edades, mientras que en nuestro caso, la muestra fue obtenida en un solo predio. Independientemente de ello, la relación entre el peso de la cabeza con respecto al peso húmedo total de la planta (53,7±3,5 %) fue muy similar en ambos casos, lo que junto con el valor relativamente bajo de SD, es indicativo de que existe una relación constante entre el peso de la cabeza con respecto al peso total de la planta.
La cabeza del agave funciona como el principal órgano de reserva y allí se acumula la mayor cantidad de carbohidratos (23,02 % en base húmeda; 79,65 % en base seca) (Cuadro 2), valor similar al reportado por Iñiguez et al. (2001). Por su parte, Valenzuela (1997) menciona que el contenido de ART en la cabeza del A. tequilana Azul puede variar entre 16 y 30 % en base húmeda, lo que entre otros factores, depende de la edad de la planta y recomienda que el agave debe cosecharse entre los 8 y 10 años de edad, tiempo en el que la planta alcanza la mayor acumulación de carbohidratos. En peso seco, el contenido de carbohidratos en la cabeza de la planta fue similar al que contiene la alcachofa de Jerusalén (Helianthus tuberosus), principal fuente potencial de fructanos que ha sido propuesta para la obtención de jarabes de alta fructosa, inulina y fructooligosacáridos (Nakamura et al., 1995).
Las inulinas constituyen la principal fructana presente en la cabeza o piña de la planta de agave. Comparativamente, la inulina obtenida a partir de la cabeza del A. tequilana Azul es de menor tamaño (GPP de 25,75 unidades) y por lo tanto, de menor PMP (4171 g·mol-1) (Cuadro 5) que la obtenida a partir de otras fuentes potenciales de fructanos como son los tubérculos de la alcachofa de Jerusalén (GPP de 35 unidades y PMP de 5670 g·mol-1) según Edelman y Jefford (1968) y Chabbert et al. (1985), las raíces de achicoria (Chicory intibus) (GPP de 33,6 unidades y PMP de 5443 g·mol-1) según Ohta et al. (1993), y los tubérculos de dalia (Dahlia variabilis) (GPP de 38,8-40,3 unidades y PMP de 6286-6529 de g·mol-1) según Nakamura et al. (1995) y Ohta et al. (1993). El alto rendimiento de la producción de inulina del agave, comparativamente con las especies botánicas mencionadas, le confiere ventajas sobre ellas dado que el tamaño de la molécula no es una limitante para su aprovechamiento como fuente de fibra dietaria en la elaboración de alimentos o como fuente de azúcares fermentables para la obtención de insumos de interés industrial.
Tanto la inulina como los fructooligosacaridos son carbohidratos solubles considerados como fibra dietética que proporciona efectos benéficos al organismo humano, desempeñándose como agentes prebióticos a la vez que disminuyen la concentración del colesterol en sangre (Delzenne y Kok, 2001) y favorecen la absorción del calcio y mineralización de los huesos (Franck, 2006).
Como se señaló, las hojas constituyen residuos del cultivo que no se utilizan. Entre ellas, las hojas maduras, y dentro de ellas, sus bases, representan la fracción con mayor aportación a la biomasa total del cultivo y contribuyen con el 23,8 % del peso húmedo total de las plantas. El contenido de carbohidratos en esta fracción es del 11,83 % en base húmeda y asciende a 56,40 % en base seca, lo que equivale al 68,6 % de los carbohidratos que se encuentran en la cabeza de la planta. Por otra parte, existe un gradiente de concentración de ART que se incrementa desde la punta de la hoja hacia la cabeza de la planta.
Dado que la demanda de cabezas de agave para la industria tequilera supera el millón de toneladas anuales (CRT, 2009) y de acuerdo a la relación encontrada entre el peso de las bases de hojas maduras y el peso de las cabezas del agave, se puede inferir que anualmente se genera un aproximado de 443.800 toneladas de bases de hojas maduras de agave. De acuerdo a su composición química y perfil de carbohidratos, este material podría utilizarse para la obtención directa de productos tales como jarabes de alta fructosa, fructosa cristalina, fibra dietética soluble, edulcorantes de bajo aporte calórico tales como fructooligosacaridos e inulina (Iñiguez et al., 2001; Peña et al., 2004). También podrían utilizarse como materia prima en procesos de fermentación para la obtención de productos tales como etanol, ácido cítrico, sorbitol, ácido glucónico. (Narváez y Sánchez, 2009), con lo que se daría un gran avance en el aprovechamiento integral de este cultivo.
CONCLUSIONES
Las mejores condiciones para extraer los fructanos en las diferentes fracciones de la planta de agave se obtuvieron al emplear una dispersión en proporción sólido:agua de 1:6 y maceración a 60 ºC durante de 30 minutos, o bien 50 ºC por 60 minutos.
La cabeza representa la fracción más importante del peso húmedo total de la planta; en ella se almacena la mayor cantidad de azúcares reductores totales en los que predominan los fructanos tipo inulina y fructooligosacaridos.
Las bases de las hojas constituyen la segunda fracción con mayor aportación a la biomasa del cultivo con un contenido de carbohidratos que equivale al 68,6 % de los que contiene la cabeza y están integrados principalmente por inulina y una menor cantidad de FOS y ARD.
El contenido y perfil de los fructanos presentes en la cabeza del cultivo son similares a los de otras fuentes comerciales tales como tubérculos de la alcachofa de Jerusalén, raíces de achicoria y tubérculos de la planta de la dalia.
Las bases de las hojas maduras podrían utilizarse para la obtención directa de insumos de interés industrial tales como jarabes de alta fructosa, fructosa cristalina, fibra dietética soluble, edulcorantes de bajo aporte calórico (FOS) e inulina; o podrían utilizarse como materia prima para la obtención por fermentación, de productos tales como etanol, ácido cítrico, sorbitol o ácido glucónico. A su vez, el uso de las hojas contribuiría a la reducción de los residuos agrícolas y al uso integral del cultivo del A. tequilana Azul.
LITERATURA CITADA
1. AOAC. 1997. Official Methods of Analysis. Association of Official Analytical Chemists. Washington, DC. [ Links ]
2. Chabbert, N., P. Braun, J. Guiraud y M. Arnoux. 1985. Productivity and fermentability of Jerusalem artichoke according to harvesting date. Biomass 3: 209-224. [ Links ]
3. CRT (Consejo Regulador del Tequila). 2009. Anuario estadístico de producción del sistema agave-tequila. Guadalajara, Jalisco México. 1-38 p. [ Links ]
4. Delzenne, N. y N. Kok. 2001. Effects of fructans-type prebiotics on lipid metabolism. American Journal of Clinical Nutrition 73: 456-458. [ Links ]
5. Dubois, M., K. Gills, J. Hamilton, P. Rebers y F. Smith. 1956. Colorimetric method for determination of sugar and related substances. Analytical Chemistry 28: 350-356. [ Links ]
6. Edelman, J. y T. Jefford. 1968. The mechanism of fructosan metabolism in higher plants as exemplified in Helianthus tuberosus. New Phytology 67: 517-531. [ Links ]
7. Flamm, G., W. Glinsmann, D. Kritchevsky, L. Prosky y M. Roberfroid. 2001. Inulin and oligofructose as dietary fiber: A review of the evidence. Critical Reviews in Food Science and Nutrition 41(5): 353-362. [ Links ]
8. Franck, A. 2006. Oligofructose-enriched inulin stimulates calcium absorption and bone mineralization. Nutrition Bulletin 31: 341-345. [ Links ]
9. García, M. 2002. Distribution of Agave (Agavaceae) in Mexico. Cactus and Succulent Journal 4: 177-188. [ Links ]
10. Iñiguez, C., T. Díaz, D. Sanjuan, H. Anzaldo y M. Rowell. 2001. Utilization of by-products from the tequila industry. Part 2: potential value of Agave tequilana Weber azul leaves. Bioresour Technology 77: 101-108. [ Links ]
11. Lamas, R., F. Sandoval, T. Osuna, R. Prado y M. Gschaedler. 2004. Cocimiento y Molienda. Ciencia y Tecnología del Tequila: Avances y Perspectivas. Centro de Investigación y Asistencia en Tecnología del Estado de Jalisco. Guadalajara, México. [ Links ]
12. Livingston III, D. 1990. Fructan precipitation from a water/etanol extract of oats and barley. Plant Physiology 92: 767-769. [ Links ]
13. López, G., M. Mancilla y D. Mendoza. 2003. Molecular structures of fructans from Agave tequilana Weber azul. Journal of Agricultural and Food Chemistry 51: 7835-7840. [ Links ]
14. Mancilla, M. y M. López. 2006. Water-soluble carbohydrates and fructan structure patterns from Agave and Dasylirion species. Journal of Agricultural and Food Chemistry 54: 7832-7839. [ Links ]
15. Miller, G. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Analytical Chemistry 31: 420-428. [ Links ]
16. Nakamura, T., Y. Ogata, A. Shitara, A. Nakamura y K. Ohta. 1995. Continuous production of fructose syrups from inulin by immobilized inulinase from Aspergillus niger mutant 817. Journal of Fermentations Bioengineering 80(2): 164-169. [ Links ]
17. Narváez, Z. y T. Sánchez. 2009. Agaves as a raw material, recent technologies and applications. Recent Patents on Biotechnology 3(3): 1-7. [ Links ]
18. Ohta, K., S. Hamada y T. Nakamura. 1993. Production of high concentrations of ethanol from inulin by simultaneous saccharification an fermentation using Aspergillus niger and Saccharomyces cerevisiae. Applied and Environmental Microbiology 59(3): 729-733. [ Links ]
19. Peña, A., L. Díaz, A. Medina, C. Labastida y L. Vera. 2004. Characterization of three agave species by gas chromatography and solid-phase microextraction-gas chromatography mass spectrometry. Journal Chromatography A. 1027: 131-136. [ Links ]
20. Pimienta, B., H. Zañudo y G. García. 2006. Fotosíntesis estacional en plantas jóvenes de Agave tequilana. Agrociencia 40(6): 699-709. [ Links ]
21. Prosky, L., A. Georg, T. Schweizer, J. Devries y I. Furda. 1988. Determination of insoluble, soluble, and total dietary fiber in foods and food products: Interlaboratory study. Journal of Association Off Analytical Chemistry 71(5): 1017-1023. [ Links ]
22. Spiegel, J., R. Rose, P. Karabell, V. Frankos y D. Schmitt. 1994. Safety and benefits of fructooligosaccharides as food ingredients. Food Technology 48: 85-89. [ Links ]
23. Trinder, P. 1969. Enzymatic and colorimetric method for determination of glucose. Annals of Clinical Biochemistry 6: 24-26. [ Links ]
24. Valenzuela, Z. 1997. El Agave Tequilero: Su Cultivo e Industria. Lítteris Editores. México, D.F. 15 p. [ Links ]
25. Wight, A. y P. Niekerk. 1983. Determination of reducing sugars, sucrose and inulin in chicory root by high-performance liquid chromatography. Journal of Agricultural and Food Chemistry 31(2): 282-285. [ Links ]