Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro v.24 n.2 Barquisimeto ago. 2012
Características marcadoras en suspensiones celulares embriogénicas de banano cien bta-03 (AAAA) y su parental williams (AAA)
Maribel Ramírez-Villalobos1 y Eva de García2
1 Dpto. de Botánica, Facultad de Agronomía, Universidad del Zulia. Apdo. 15205, ZU4005. Maracaibo. Venezuela
2 Instituto de Biología Experimental, Facultad de Ciencias, Universidad Central de Venezuela. Los Chaguaramos, Caracas 1041, Venezuela. e-mail: mcramire@fa.luz.edu.ve
RESUMEN
Las suspensiones celulares embriogénicas (SE) constituyen un sistema ideal para la micropropagación clonal y la transferencia de genes; sin embargo, la carencia de protocolos eficientes de regeneración de plantas a partir de ellas es, en muchos casos, el principal obstáculo para la aplicación de estas biotécnicas. En este trabajo se analizaron SE y suspensiones celulares no embriogénicas del banano CIEN-BTA-03 (AAAA) y su parental Williams (AAA) para la selección de características marcadoras de la embriogénesis somática. A cada suspensión se le realizaron observaciones en microscopio de luz y se estudió la cinética de crecimiento, considerando número de células y agregados celulares, embriogénicos y no embriogénicos. Las SE resultaron 100 % viables con abundantes células y agregados celulares embriogénicos. El análisis de la composición celular y el aspecto de las SE sugieren que varias características de estas células y agregados celulares embriogénicos, y del medio de cultivo podrían considerarse marcadoras de la detección temprana de la capacidad embriogénica de dichas suspensiones.
Palabras clave adicionales: Agregados celulares, marcadores de embriogénesis, cinética de crecimiento
Marker characteristics of embryogenic cell suspensions of CIEN BTA-03 banana (AAAA) and its parental Williams (AAA)
ABSTRACT
Embryogenic cell suspension (ES) are an ideal system for clonal micropropagation and gene transfer, but the lack of protocols for efficient regeneration of plants from them is, in many cases, the main obstacle to the implementation of these biotech. This paper analyzed ES and non-embryogenic cell suspensions obtained from banana CIEN BTA-03 (AAAA) and from its parental banana Williams (AAA), for selection of earlier somatic embryogenesis markers. Each suspension was analyzed throughout light microscope observations and kinetics of growth, was established based on the number of embryogenic and non-embryogenic cells and cell clusters. ES were 100 % viable with abundant embryogenic cells and cell clusters. Analysis of cellular composition and appearance of embryogenic cell suspensions suggest that several characteristics of the embryogenic cells and cell clusters, and from the cultured medium could be considered markers of early detection of embryogenic capacity of theses suspensions.
Additional key words: Cell clusters, embryogenic markers, growth kinetic
Recibido: Agosto 30, 2011 Aceptado: Marzo 1, 2012
INTRODUCCIÓN
El cultivo de banano (Musa spp.) se encuentra ampliamente distribuido en las regiones tropicales y subtropicales del mundo, donde tienen gran importancia económica y social dado que son fuente de alimento, empleo e ingreso. Los bananos del subgrupo Cavendish, entre ellos Williams (AAA), son los más cultivados y dominan el mercado mundial. La producción de bananos en Venezuela ha sido fuertemente afectada por la enfermedad Sigatoka negra (Mycosphaerella fijiensis) (Martínez et al., 2007) que ha ocasionado grandes pérdidas en la producción, por lo que para controlarla es necesario aplicar técnicas biotecnológicas en su mejoramiento genético y micropropagación clonal de los cultivares mejorados.
El éxito de la aplicación de la biotecnología moderna como la transformación genética en bananos depende, entre otros factores, de protocolos eficientes y reproducibles de regeneración de plantas a partir de embriones somáticos y suspensiones celulares embriogénicas. La embriogénesis somática es un proceso morfogénico que permite obtener altos volúmenes de producción de plantas clonadas en corto tiempo y con menores costos. Ésta se ha establecido en bananos a partir de manos florales inmaduras masculinas (Strosse et al., 2003; Namanya et al., 2004; Pérez y Rosell, 2008); sin embargo, aún existen varias limitaciones en el sistema durante las etapas de inducción del callo embriogénico, establecimiento de suspensiones celulares embriogénicas, maduración de embriones somáticos y conversión posterior a plantas, por lo que no puede considerarse un protocolo común. Strosse et al. (2003) han indicado que una de las limitantes es que pocos callos embriogénicos resultan en una buena suspensión celular.
El método de manos florales inmaduras masculinas es aplicable a la mayoría de los cultivares de Musa que producen flores masculinas (Strosse et al., 2006); sin embargo, esta condición excluye a nuevos clones que se encuentren en cantidades limitadas en el germoplasma de Musa, y de los cuales se dispone de poco material vegetal en el campo, como es el caso del banano CIEN BTA-03, por lo que la embriogénesis somática se induce a partir de escalpo. Esta investigación tuvo como objetivo analizar las características marcadoras para la detección temprana de la capacidad embriogénica, en suspensiones celulares embriogénicas del banano CIEN BTA-03 (AAAA) y su parental Williams (AAA).
MATERIALES Y MÉTODOS
La investigación realizó en el Laboratorio de Biotecnología Vegetal del Instituto de Biología Experimental (IBE), Universidad Central de Venezuela (UCV). Se utilizaron como material vegetal los bananos Williams y CIEN BTA-03. El Williams es un triploide con genoma acuminata (AAA) que presenta rasgos similares al Giant Cavendish, se cultiva en mayor proporción en el estado Aragua y presenta susceptibilidad a las sigatokas amarilla y negra. El banano CIEN BTA-03 es un tetraploide con genoma acuminata (AAAA) obtenido por variación somaclonal del clon Williams en el Laboratorio de Biotecnología Vegetal, IBE-UCV y altamente tolerante a ambas sigatokas (Giménez et al., 2008).
Para la obtención de callo embriogénico en el banano Williams se utilizaron como explantes flores inmaduras masculinas de 1,5 cm de largo (Arteaga et al., 2002), manos florales inmaduras masculinas (Strosse et al., 2003) y escalpos (Strosse et al., 2003; 2006). Se denomina escalpo a la porción superior de 3 mm de grosor, de diminutas yemas múltiples obtenidas a través del cultivo de yemas apicales del vástago, constituidas por el ápice del vástago y tres o cuatro primordios foliares con una pequeña porción de rizoma, en medio de inducción con citocininas y auxinas. En el banano CIEN BTA-03 se usaron flores inmaduras masculinas de 1,5 cm de largo y escalpos, debido a que de este somaclon se disponían mayormente plantas cultivadas bajo condiciones de umbráculo e in vitro.
Las flores inmaduras masculinas se obtuvieron de inflorescencias masculinas reducidas a 15 cm de largo y luego desinfectadas superficialmente por 5 min en cloro comercial al 20 % (i.a. hipoclorito de sodio al 0,85 %, v/v) más dos gotas de tween 20 por litro. Se hizo un enjuague con agua destilada estéril y después se eliminaron las restantes brácteas a las inflorescencias hasta obtener flores inmaduras de 1,5 cm de largo, las cuales se mantuvieron por 5 min en antioxidante L-cisteína (100 mgL-1) antes de la siembra.
Las manos florales masculinas se extrajeron de inflorescencias masculinas, las cuales se redujeron a una longitud de 2,5 cm, se desinfectaron con etanol 70 % por 5 min y se enjuagaron una sola vez con agua destilada estéril en la cámara de flujo laminar. Luego, con la ayuda de un estereoscopio Poland PZO, se extrajeron de cada inflorescencia las manos florales ubicadas entre los nudos siete a dieciséis, contados a partir del ápice floral (Strosse et al., 2003).
Las flores inmaduras masculinas y las manos florales inmaduras masculinas se cultivaron en el medio de inducción de callo (MIC) descrito por Escalant et al. (1994): sales completas y vitaminas de Murashige y Skoog (MS), 1 mg·L-1 de ácido indolacético (AIA), ácido naftalenacético (ANA) y biotina, 4 mg·L-1 de 2,4-diclorofenoxiacético (2,4-D), 30 g·L-1 de sacarosa, 7 g·L-1 de agar-agar, pH 5,7. Adicionalmente, se utilizó un testigo colocando los explantes en el medio anterior sin las auxinas AIA, ANA y 2,4-D. Posteriormente las flores se inocularon en magentas con 100 mL de medio y las manos florales en frascos de vidrio pequeños con 30 mL.
A partir del escalpo se utilizaron vitroplantas provenientes de un cuarto ciclo de subcultivo, con ocho semanas en medio de multiplicación, constituido por las sales completas de MS, vitaminas de Morel y Wetmore, 2,5 g L-1 de benciladenina (BA), 30 g·L-1 de sacarosa, 7 g·L-1 de agar-agar, pH 5,7 y cultivadas en frascos de vidrio pequeños con 30 mL de medio, luz blanca fluorescente (33 µmol·m-2·s-1) y temperatura de 25±1 °C.
De las vitroplantas se extrajeron yemas apicales del vástago (8 mm de alto x 1,5 mm de diámetro) y se cultivaron de acuerdo a lo establecido por Ramírez y García (2008): medio de inducción de yemas múltiples IT25 (sales completas del medio MS, vitaminas de Morel y Wetmore, 30 g·L-1 de sacarosa, 25 mg·L-1 de BA, 0,217 mg·L-1 de AIA, pH 6,2) e inoculadas bajo inmersión temporal. Los escalpos se extrajeron de la porción superior (2-3 mm de grosor) de yemas múltiples pequeñas (2-3 mm de diámetro), se cultivaron en medio de inducción de callo ZS (Strosse et al., 2003; 2006) (ZS: mitad de las sales y vitaminas completas de MS, 1 mg·L-1 de 2,4-D, 0,219 mg·L-1 de zeatina, 30 g·L-1 de sacarosa, pH 6,2); pero gelificado con fitagel (1,8 g·L-1) y sin el antioxidante ácido ascórbico. Las flores inmaduras masculinas, las manos florales inmaduras masculinas y los escalpos se mantuvieron en oscuridad a 26±1 ºC hasta la obtención de callo embriogénico, de estructura granular y con presencia de embriones somáticos en su periferia.
Se establecieron suspensiones celulares embriogénicas de banano Williams obtenidas a partir de flores inmaduras masculinas (SEWf). Para las SEWf I se transfirió 1,2 g de callo embriogénico con embriones somáticos en estado globular, obtenido de flores inmaduras masculinas a los nueve meses de cultivo en el MIC, a 60 mL de medio líquido de multiplicación (ML) (Escalant et al., 1994) (ML: sales completas y vitaminas de MS, 1 mg·L-1 de 2,4-D y biotina, 100 mg·L-1 de glutamina y extracto de malta, 45 g·L-1 de sacarosa, pH 5,3) con 50 mg·L-1 de antioxidante (L-cisteína, ácido ascórbico o ácido cítrico) o sin antioxidante. Estas suspensiones se mantuvieron en fiolas de 150 mL, incubaas en agitación orbital en un equipo Innova 2100 (19 mm de órbita circular) a 140 rpm, bajo condiciones de oscuridad a 26±1 ºC; el recambio de medio se realizó cada 14 días durante tres meses. Luego de transcurrido este tiempo la SEWf I se tamizó a través de una rejilla con poros de 250 µm, se estableció la SEWf II y se determinó la cinética de crecimiento de esta suspensión durante 16 días para determinar el tiempo de recambio de medio. La SEWf II se inició en fiolas con 40 mL de medio, 3 % de volumen de células sedimentadas por 5 min (VCS) y 30 % de medio de la SEWf I.
Paralelamente, se iniciaron suspensiones celulares no embriogénicas de banano Williams SNWf I con 1,2 mg de callo no embriogénico (de estructura laxa, células alargadas) en 60 mL de medio de multiplicación ML, y las SNWf II mediante el filtrado (250 µm) de SNWf I.
Se establecieron suspensiones celulares embriogénicas de banano Williams obtenidas a partir manos florales inmaduras masculinas (SEWm). Las SEWm I se iniciaron con 240 mg de callo embriogénico que contenía abundantes embriones somáticos en estado torpedo, en 10 mL de medio ML (Escalant et al., 1994) sin antioxidante y contenidos en fiolas de 50 mL. El callo embriogénico se obtuvo a los cuatro meses de cultivo de manos florales inmaduras masculinas en MIC. Las suspensiones se mantuvieron bajo agitación orbital (Innova 2100) a 100 rpm, en oscuridad, a 26±1ºC y con recambio de medio fresco (50% del medio) cada siete días durante dos meses. Posteriormente la SEWm I se tamizó con una rejilla con tamaño poro de 250 µm, obteniendo la SEWm II, y se estudió la cinética de crecimiento durante 16 días. La SEWm II se inició en fiolas de 150 mL con 20 mL de medio, 2% de VCS y 30% de medio de la SEWm I.
Adicionalmente se establecieron suspensiones celulares no embriogénicas de Williams (SNWm). Para la SNWm I se utilizó 240 mg de callo no embriogénico (de estructura laxa, células alargadas) procedente de manos florales inmaduras masculinas y se inocularon en 10 mL de medio ML. La SNWm II se obtuvo mediante el filtrado (250 µm) de SNWm I.
Se establecieron suspensiones celulares embriogénicas de banano CIEN BTA-03 obtenidas a partir escalpo (SEC). Las SEC I se iniciaron con 10 a 15 embriones somáticos en estado torpedo, procedentes de callo embriogénico obtenido de escalpos (a los cinco meses de cultivo), en 5 mL de medio multiplicación ZL (Strosse et al., 2003; 2006), igual al ZS sin gelificante. Las SEC I se mantuvieron en fiolas de
25 mL, bajo agitación orbital (Innova 2100) a 100 rpm, oscuridad, temperatura de 26±1 °C y recambio de medio (50% de medio) cada siete días durante dos meses. Luego de transcurrido este tiempo la SEC I se tamizó (rejilla con poros de 250 µm) estableciendo la SEC II, y se analizó la cinética crecimiento de esta suspensión durante 16 días. La SEC II se inició en fiolas de 150 mL con 20 mL de medio, 1,38 % de VCS y 30 % de medio de la SEC I. Por otra parte se establecieron suspensiones celulares no embriogénicas de banano CIEN BTA-03 (SNC) I (SNC I) con 100 mg de callo nodular obtenido de escalpos en 5 mL de medio ZL. El filtrado (250 µm) de la SNC I produjo la SNC II.
Cada dos días se analizó la cinética de crecimiento en las suspensiones celulares II (SEWf II, SNWf II, SEWm II, SNWm II, SEC II y SNC II), considerando como cero el día inicial. De cada suspensión celular se tomaron tres alícuotas de 150 µL (agitación manual) para la determinación de número de células y agregados embriogénicos y no embriogénicos. Para el contaje celular se emplearon alícuotas de 150 µL debido a que las suspensiones I y II se establecieron con pequeños volúmenes de medio y poca cantidad de tejido embriogénico para obtener mayor uniformidad en la composición celular. El contaje celular se realizó cuatro veces por alícuota utilizando una cámara de Neubauer Boeco en un microscopio de luz.
Luego de evaluada la cinética de crecimiento, a las suspensiones celulares se les efectuó recambio de medio (50 % del medio) cada 14 días a las SEWf I, SEWf II, SNWf I y SNWf II, y cada 12 días a las SEWm I, SEWm II, SNWm I, SNWm II, SEC I, SEC II, SNC I y SNC II. En las SEWm I y SEWm II se eliminaron las estructuras globulares amarillas visibles mayores de 3 mm, y en las SEC I y SEC II las mayores de 1 mm; en las SNC I y SNC II sólo el tejido necrosado.
RESULTADOS Y DISCUSIÓN
Suspensiones celulares de banano Williams obtenidas a partir de flores y manos florales inmaduras masculinas. De las SEWm I, establecidas con callo embriogénico (con embriones somáticos en estado torpedo) procedente de manos florales inmaduras masculinas, el 100 % mostró color blanco-crema (Figuras 1A-C) hacia los dos meses de cultivo y se conservó viable, con células y agregados celulares embriogénicos vivos, aptas para las siguientes etapas de maduración y conversión de embriones a plantas. Las SEWm I presentaron alto contenido de células embriogénicas (198.100±2.900) y agregados celulares embriogénicos (14.000±1.700), y relativamente pocas células no embriogénicas (27.600±2.100) y agregados celulares no embriogénicos (3.800±200).
Los agregados celulares se apreciaron como masas celulares opacas amarillo-marrón con abundantes células embriogénicas en la periferia. En la suspensión también se observaron estructuras proembriónicas, embriones somáticos en diferentes estados y estructuras globulares amarillas. La presencia de algunos embriones somáticos en diferentes estado de desarrollo, y estructuras globulares amarillas en la SEWm I son características que demuestran la condición embriogénica de esa suspensión, y pueden considerarse como marcadores tempranos de alta competencia embriogénica en suspensiones embriogénicas de banano Williams iniciadas a partir de manos florales inmaduras masculinas.
Los agregados celulares embriogénicos de banano Williams son similares morfológicamente a los agregados clasificados como Tipo III en suspensiones embriogénicas de banano Gran naine (Georget et al., 2000). Estos agregados estuvieron constituidos por varias células embriogénicas y se caracterizaron por la opacidad en su parte central y presencia de zonas de proliferación celular en su periferia, constituidas por células embriogénicas con citoplasma denso, pared celular gruesa y alta proporción núcleo (prominente) a citoplasma.
Al segundo mes de cultivo de las SNWm I, establecidas con callo no embriogénico obtenido de manos florales inmaduras masculinas, se detectó poca cantidad de células no embriogénicas (11.700±1.400), agregados celulares no embriogénicos (3.900±400) y estructuras globulares negras de diferentes tamaños. El medio de esta suspensión se mantuvo translúcido.
Las células embriogénicas comparadas con las células no embriogénicas resultaron pequeñas, redondas, ovoides, citoplasmáticamente densas, con pared gruesa y núcleo prominente. Las células no embriogénicas presentaron tamaño grande, forma variable predominando la alargada, poco contenido citoplasmático, pared celular delgada, vacuola grande y núcleo pequeño. Las características de las células embriogénicas y no embriogénicas se corresponden en parte con las descritas en otros estudios (Jalil et al., 2003; Houllou et al., 2005); sin embargo, en las células no embriogénicas no se ha señalado la forma variable.
Todas las SEWf I, iniciadas con callo embriogénico de flores masculinas inmaduras, más embriones somáticos en estado globular, mostraron color negro-púrpura intenso a pesar de la presencia en el medio de antioxidante (50 mg·L-1 de cisteína, ácido ascórbico o ácido cítrico) (Figura 2A). Transcurridos tres meses las SEWf I estuvieron constituidas por gran cantidad de células embriogénicas (353.000 ± 3.100) y agregados embriogénicos (38.000 ± 2.100), los cuales no se observaron en las SNCF I. En estas suspensiones también se observaron varias estructuras globulares amarillas embriogénicas (2-4 mm) y negras, células no embriogénicas (47.000±1.500) y agregados no embriogénicos (6.300±900) (Figuras 2B-E). En la SNWf I, establecida con callo no embriogénico obtenido a partir de flores inmaduras masculinas, se detectó una baja población de células no embriogénicas (12.800±2.300) y agregados celulares no embriogénicos (4.000±500) de color púrpura-claro, así como varias estructuras globulares negras de diferentes tamaños (Figura 2F). El medio de SNWf I se mantuvo translúcido.
Las SEWf I presentaron alta cantidad de células y agregados celulares embriogénicos, es una condición que algunos investigadores han asociado en otros cultivares de Musa, con un alto potencial embriogénico (Georget et al., 2000; Houllou et al., 2005; Jalil et al., 2008). Sin embargo, en el caso del banano Williams es probable que la oxidación observada en las SEWf I afecte en algún grado la viabilidad de las células y agregados, tomando en consideración lo observado por Jalil et al. (2003) que la alta oxidación fenólica durante el establecimiento de suspensiones celulares de banano Mas (AA) disminuyó la viabilidad de las células.
Suspensiones celulares de banano CIEN BTA-03 obtenidas a partir escalpos. Las SEC I, iniciadas con embriones somáticos torpedo procedentes de callo embriogénico de escalpos, permitieron el establecimiento de un sistema de embriogénesis somática secundaria en el banano tetraploide (AAAA) del subgrupo Cavendish clon CIEN BTA-03.
Transcurridos dos meses todas las SEC I establecidas resultaron viables de color blanco-crema con alto contenido de células embriogénicas (283.300±2.300) y numerosos agregados celulares embriogénicos (51.200±1.100) opacos en su parte central, amarillo-marrón con muchas células embriogénicas su periferia (Figuras 3A-C), y bajo contenido de células no embriogénicas (10.100±2.600) y agregados celulares no embriogénicos (19.300±1.100). Estas suspensiones además presentaron estructuras proembriónicas y embriones somáticos en diferentes estados de desarrollo
En la SEC I se detectó un alto contenido de células y agregados embriogénicos y estructuras proembriónicas y embriones somáticos, características que muestran la alta condición y calidad embriogénica de la suspensión y pudieran utilizarse como marcadores tempranos de competencia embriogénica en suspensiones embriogénicas de banano CIEN BTA-03 obtenidas a partir de escalpo. Las características morfológicas observadas en los agregados celulares embriogénicos del banano CIEN BTA-03, como opacidad en su parte central y presencia de células embriogénicas en su periferia, se corresponden con las descritas en los agregados celulares de las suspensiones celulares embriogénicas de banano Williams, SEWm I y SEWm II, obtenidas en esta investigación a partir de manos florales inmaduras masculinas. De igual manera tienen semejanza con las señaladas por Georget et al. (2000) para agregados Tipo III en suspensiones embriogénicas de banano Gran naine, también iniciadas con manos florales inmaduras masculinas.
Las SNCI, establecidas con callo no embriogénico obtenido a partir de escalpo, presentaron baja cantidad de células no embriogénicos (17.300 ± 2.300) y agregados celulares no embriogénicos (5.200 ± 1.000), así como varias estructuras globulares amarillas y pequeños agregados celulares (menores de 4 mm) constituidos de células parenquimatosas con algunos gránulos de almidón (Figuras 3D-E). Estas suspensiones resultaron translúcidas y presentaron porciones de tejido necrosado, y no dieron origen a embriones somáticos.
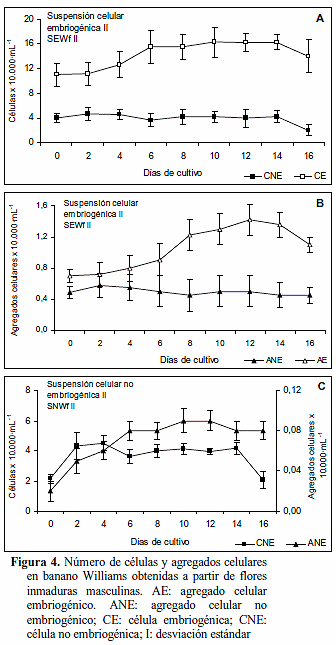
Cinética de crecimiento de suspensiones celulares II de banano Williams obtenidas de flores y manos florales inmaduras masculinas. Las cinéticas de crecimiento de las SEWf II establecidas mediante el tamizado de SEWf I (obtenida a partir de flores inmaduras masculinas de 1,5 cm), expresada en células embriogénicas y agregados celulares embriogénicos presentaron tres fases (Figuras 4A-B). La primera de crecimiento lento hasta el día cuatro, correspondiente a un período de adaptación a las nuevas condiciones nutricionales del medio, ocurriendo muy poca o ninguna actividad de división celular. Luego sigue una fase crecimiento rápido en los agregados celulares ubicada entre los seis y catorce días, y en las células embriogénicas esta fase resultó algo lenta, lo cual se asoció a que las células se agruparon para formar nuevos agregados celulares.
Después de los catorce días aparece una fase de desaceleración en el crecimiento tanto de las células embriogénicas como de los agregados embriogénicos asociada al agotamiento de los nutrientes en el medio y al agrupamiento de las células y agregados celulares. De acuerdo a las cinéticas de crecimiento el tiempo de catorce días es el más apropiado para el cambio de medio en esta suspensión.
Las SEWf II presentaron una cinética de crecimiento algo diferente al modelo teórico sigmoidal (Szabados et al., 1991). Esto se debió a la tendencia de las células a formar constantemente agregados celulares en la suspensión, y al hecho de que en este estudio la cinética de crecimiento se analizó por un corto período de tiempo (16 días) con el objeto de determinar el tiempo adecuado (día catorce en este caso) para la renovación o recambio de medio. Esto con el fin de asegurar el continuo crecimiento de las células y agregados celulares en la suspensión. La agregación celular ocurre comúnmente en las suspensiones celulares y modifica la distribución de células aisladas y el crecimiento de las suspensiones (Szabados et al., 1991).
En estudios de suspensiones celulares embriogénicas de banano Cau man se ha observado una curva de crecimiento, expresada en volumen de células sedimentadas, parecida a la del modelo teórico sigmoidal en un período de veintiocho días y con recambio de medio cada catorce días (Bui y Tran, 2004). En el banano Mas (AA) la curva (en volumen de células sedimentada) es similar a la sigmoidal típica en un lapso de 30 días con recambios de medio cada diez días (Jalil et al., 2003).
En otras especies como caña de azúcar, monocotiledónea, (Oropeza et al., 2001) también se ha observado que el crecimiento de la suspensión, sin recambio de medio, es algo diferente al modelo teórico sigmoidal. En suspensiones embriogénicas de papa (Vargas et al., 2005) el crecimiento sigue una curva sigmoidal con disminución en el número de células después de alcanzar el máximo crecimiento.
Las SEWf II mostraron gran contenido de células y agregados celulares embriogénicos, pocas células y agregados celulares no embriogénicos con pequeñas variaciones en su número (Figuras 4A-B), comparadas con las SNWf II, en las cuales además no se visualizaron células y agregados celulares embriogénicos. En las SNWf II se encontró que durante los primeros cuatro días hubo incrementos tanto en el número de células no embriogénicas como de agregados celulares no embriogénicos (Figura 4C). Luego las variables divergen, mientras que el número de células no embriogénicas se reduce el número de agregados no embriogénicos aumenta, en este
caso las células han pasado a formar nuevos agregados. Entre los días seis y catorce en ambas variables ocurren pequeños incrementos, y después del día doce a catorce disminuyen.
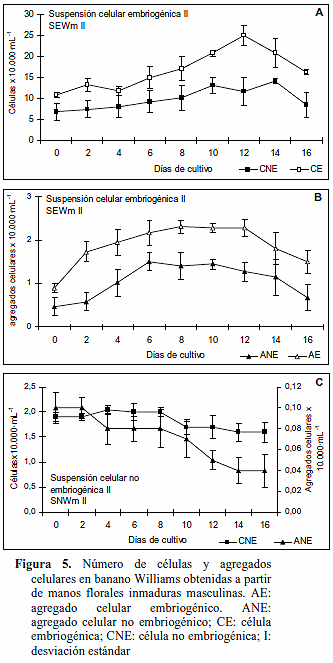
En las SEWm II, establecidas mediante el tamizado de SEWm I (obtenida a partir de manos florales inmaduras), el crecimiento de células embriogénicas mostró tres fases (Figura 5A). La primera fase de crecimiento lento en las células embriogénicas hasta el día cuatro, la segunda fase de crecimiento rápido entre los días cuatro a doce y la tercera fase de disminución después de los doce días. En los agregados celulares embriogénicos se observó un crecimiento rápido hasta el día ocho, luego se hizo constante y disminuyó después del día doce (Figura 5B). Estas cinéticas revelaron que el tiempo adecuado para el cambio de medio se ubicó en doce días, condición que mantendría la suspensión celular en constante crecimiento.
Durante el crecimiento de las SNWm II sólo se detectaron células no embriogénicas y agregados celulares no embriogénicos y mostró que durante los primeros dos días las células y agregados no embriogénicos se mantienen constantes (Figura 5C). Luego las variables divergen hasta el día dieciséis, los agregados celulares disminuyen y las células no embriogénicas incrementan. En ambas variables hubo una tendencia a la disminución.
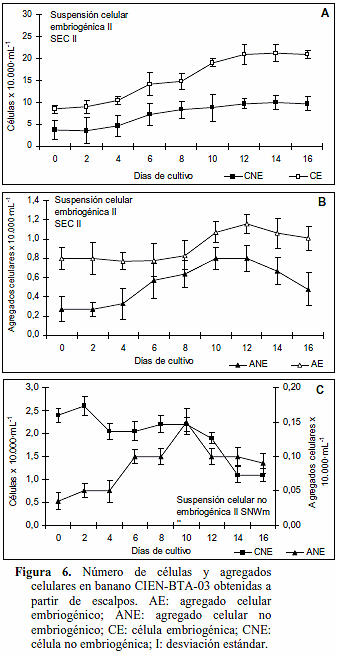
Cinética de crecimiento de suspensiones celulares II de banano CIEN BTA-03 obtenidas de escalpo. El crecimiento de SEC II, establecida mediante el tamizado de SEC I (obtenida a partir de escalpos), expresado en células y agregados celulares embriogénicos, mostró tres fases (Figuras 6A-B). En las células embriogénicas la primera fase de crecimiento lento se observó hasta el día cuatro, la segunda fase de crecimiento rápido entre los días cuatro a doce y la tercera fase estacionaria después de los doce días (Figura 6A). Los agregados celulares mostraron crecimiento lento hasta los seis días, crecimiento rápido entre los días seis y doce y disminución después del día doce (Figura 6B). Estas cinéticas indicaron que el tiempo adecuado para el recambio de medio es de doce días, condición que permitiría el crecimiento en la suspensión. El número de células y agregados celulares no embriogénicos de la SEC II resultó bajo, aunque hubo pequeños incrementos en ambas variables hasta el día doce.
Las SNC II sólo produjeron células y agregados no embriogénicos (Figura 6C). A medida que el número de células disminuía el número de agregados celulares aumentó hasta el día diez; luego disminuyeron ambas variables.
Las SEWm I, SEWm II, SEC I y SEC II presentaron 100 % de éxito y se conservaron viables, de color blanco-crema-claro y sin problemas de oxidación durante un período de doce meses, con subcultivos cada dos meses. Dichas suspensiones presentaron alta conversión de embriones a plantas (78-85%) y alto porcentaje de vitroplantas obtenidas (80-90%). En contraposición, la SEWf I mostró baja conversión de embriones a plantas (0,2%) y en la SEWf II no se produjeron plantas (datos no publicados).
El alto porcentaje de éxito logrado en esta investigación en las suspensiones celulares embriogénicas obtenidas tanto de manos florales inmaduras masculinas en Williams como de escalpo en CIEN BTA-03, se asocia a la composición celular de las suspensiones SEWm I y SEC I, respectivamente. Estas suspensiones se iniciaron en un pequeño volumen de medio -sin antioxidantes- con pequeñas cantidades de callo embriogénico más embriones somáticos torpedo en el banano Williams, y con pocos embriones
somáticos torpedo (sin tomar tejido de callo) en CIEN BTA-03. Sin embargo en CIEN BTA-03 se observó mayor uniformidad en la composición celular debido posiblemente a que la SEC I se inició sólo con embriones somáticos, lo cual la hace más homogénea.
El porcentaje de éxito logrado en el establecimiento de suspensiones celulares embriogénicas en CIEN BTA-03 (SEC I y SEC II) se considera muy alto al compararlo con el 30,5 a 47,8 % de éxito señalado en suspensiones embriogénicas de plátanos y bananos iniciadas con callo embriogénico más embriones somáticos obtenidos de escalpos (Strosse et al., 2003; 2006).
En el banano Williams el porcentaje de suspensiones celulares embriogénicas viables, obtenidas a partir de manos florales inmaduras masculinas, resultó alto con respecto al reportado en investigaciones de banano Gran enano (AAA) que osciló entre 59 y 62% de viabilidad (Lerma et al., 2001). Este porcentaje obtenido en las suspensiones embriogénicas del banano Williams también contrasta con otra investigación (Jalil et al., 2003), en la cual el establecimiento de suspensiones celulares en banano Mas (AA) resultó crítico debido a la oxidación de las mismas posiblemente por exudados fenólicos que afectan la viabilidad de las células.
CONCLUSIONES
Los sistemas de embriogénesis somática establecidos a partir de escalpo en el banano CIEN BTA-03 y de manos florales inmaduras masculinas en su parental Williams permitió la obtención de callo embriogénico, con abundantes embriones somáticos en estado de torpedo en su periferia, apropiado para el establecimiento de suspensiones celulares embriogénicas con alta capacidad para la formación de embriones funcionales aptos para convertirse en plantas.
Las suspensiones celulares embriogénicas obtenidas a partir de escalpo en el banano CIEN BTA-03 y de manos florales en su parental Williams mostraron alta capacidad embriogénica y presentaron varias características que se consideran marcadoras de la detección temprana de dicha capacidad tales como el cambio gradual del aspecto del medio nutritivo de translúcido hacia blanco-crema durante los primeros días de cultivo, la alta cantidad de células y agregados
celulares embriogénicos, la presencia de estructuras proembriónicas y embriones somáticos, y el aspecto morfológico de los agregados celulares embriogénicos caracterizados por una opacidad en el centro y presencia de muchas células embriogénicas en la periferia.
AGRADECIMIENTO
A la Fundación UCV (FUCV) por la subvención otorgada a través del proyecto No. 0297/2006 y al Vicerrectorado Académico de la Universidad del Zulia.
LITERATURA CITADA
1. Arteaga, M., García, E. y E. Vargas. 2002. Embriogénesis somática a partir de flores masculinas en clones de banano. Phyton 68: 199-206. [ Links ]
2. Bui V. y H. Tran. 2004. Crecimiento de las suspensiones celulares del cv Cau man InfoMusa 13: 2-4. [ Links ]
3. Escalant J., C. Teissont y F. Côte F. 1994. Amplified somatic embryogenesis from male flowers of triploid banana and plantain cultivars (Musa spp.). In vitro Cell Develpomental Biololgy-Plant 30: 181-186. [ Links ]
4. Georget F., R. Domergue, N. Ferrière y F. Côte. 2000. Morphohistological study of the different constituents of a banana (Musa AAA, cv. Grande naine) embryogenic cell suspension. Plant Cell Report 19: 748-754. [ Links ]
5. Giménez C., E. de García y O. Haddad. 2008. Genetic and resistance stability to black Sigatoka disease during micropropagation of Musa CIEN BTA-03 somaclonal variant. Phyton 77: 65-79. [ Links ]
6. Houllou L., E. Kido, M. Falco, M. Silva, A. Vargas, N. Nogueira, M. Lanzoni y A. Tulman. 2005. Somatic embryogenesis and the effect of particle bombardment on banana Maçã regeneration. Pesquisa Agropecuária Brasilera 40: 1081-1086. [ Links ]
7. Jalil M., W. Chee, R. Othaman y N. Khalid. 2008. Morphohistological examination on somatic embryogenesis of Musa acuminata cv. Mas (AA). Scientia Horticulturae 117: 335-340. [ Links ]
8. Jalil M., N. Khalid y R. Othman. 2003. Plant regeneration from embryogenic suspension cultures of Musa acuminata cv Mas (AA). Plant Cell, Tissue and Organ Culture 75: 209-214. [ Links ]
9. Lerma S., P. Acuña, A. Riveros y J. Sandoval. 2002. Tasa de multiplicación y potencial de regeneración de embriones somáticos de una suspensión celular de banano (Musa AAA cv. Gran enano). InfoMusa 11: 38-44. [ Links ]
10. Martínez G., E. Delgado, R. Pargas, E. Manzanilla y H. Ramírez. 2007. Consideraciones generales sobre la producción y el comercio mundial de banano. I: producción, exportación e importación. Revista Digital CENIAP Hoy No. 13. http://ceniap.gov.ve/pbd/revistastecnicas/ceniaphoy/ index.htm. (Consulta del 07/06/2011). [ Links ]
11. Namanya P., S. Magambo, G. Mutumba y W. Tushemereirwe. 2004. Somatic embryogenesis from immature male inflorescences of East African highland banana cv. ´Nakyetengu´. African Crop Science Journal 12: 43-49. [ Links ]
12. Oropeza M., A. Marcano y E. de García. 2001. Proteins related with embryogenic potencial in callus and cell suspension of sugarcane (Saccharum sp.). In vitro Cell Developmental Biology-Plant 37: 211-216. [ Links ]
13. Pérez J. y P. Rossel. 2008. Inflorescence proliferation for somatic embryogenesis induction and suspension-derived plant regeneration from banana (Musa AAA, cv. Dwarf Cavendish) male flowers. Plant Cell Report 27: 965-971. [ Links ]
14. Ramírez, M. y E. de García. 2008. Obtainment of embryogenic cell suspensions from scalps of the banana CIENBTA-03 (Musa sp., AAAA) and regeneration of the plants. Electronic Journal of Biotechnology 11: 1-10. [ Links ]
15. Strosse H., R. Domergue, B. Panis, J. Escalant y F. Côte. 2003 Suspensiones de Células Embriogénicas de Banano y Plátano. In: A. Vecina y C. Picq (eds). Guías Técnicas INIBAP No. 8. Red Internacional para el Mejoramiento del Banano y el Plátano. Montpellier. 31 p. [ Links ]
16. Strosse H., H. Schoofs, B. Panis, E. Andre, K. Reyniers y R. Swennen. 2006. Development of embryogenic cell suspensions from shoot meristematic tissue in bananas and plantains (Musa spp.). Plant Science 170: 104-112. [ Links ]
17. Sábados, L., L. Mroginski y W. Roca. 1991. Suspensiones celulares: descripción, manipulación y aplicaciones. In: W. Roca y L. Mroginski (eds). Cultivo de Tejidos en la Agricultura. Fundamentos y Aplicaciones. Centro Internacional de Agricultura Tropical (CIAT) No. 151. Calí, Colombia. p. 173-210. [ Links ]
18. Vargas T., E. de García y M. Oropeza. 2005. Somatic embryogenesis in Solanum tuberosum from cell suspensión cultures: histological analysis and extracellular protein patterns. Journal Plant Physiology 162: 449-456. [ Links ]