Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro vol.24 no.3 Barquisimeto dic. 2012
Variación de los compuestos fenólicos de Phaseolus vulgaris L. durante el almacenamiento y su relación con el endurecimiento
María V. Mujica1, Marisela Granito2 y Naudy Soto1
1 Programa de Ingeniería Agroindustrial, Decanato de Agronomía, Universidad Centroccidental Lisandro Alvarado. Apdo. 400. Barquisimeto. Venezuela
2 Universidad Simón Bolívar, Valle de Sartenejas, estado Miranda. Venezuela
RESUMEN
Una de las principales limitantes para el consumo de leguminosas en los países de clima tropical es el endurecimiento de los granos durante el almacenamiento a alta temperatura y alta humedad relativa. El objetivo de este estudio fue determinar el efecto de las condiciones de almacenamiento sobre los compuestos fenólicos y la capacidad antioxidante de los cotiledones y de la testa de Phaseolus vulgaris L. y su relación con el endurecimiento. Para ello se utilizaron muestras almacenadas durante 120 días a 5 °C - 34 % HR, y a 37 °C - 75 % HR. Las propiedades físicas (dureza, tiempo de cocción, capacidad de imbibición, conductividad eléctrica del agua de remojo, humedad y actividad de agua) se midieron en los granos enteros mientras que los compuestos fenólicos (polifenoles totales, ácidos hidroxicinámicos, flavonoides, taninos condensados solubles y lignina) y la capacidad antioxidante se cuantificaron en cotiledones y testa. Los ácidos hidroxicinámicos y flavonoides se analizaron por HPLC-DAD/ESI-MS, los compuestos libres se extrajeron con metanol y los enlazados a la fibra insoluble se liberaron por hidrólisis alcalina. El almacenamiento a 37 °C y 75 % HR aumentó la dureza de los granos y disminuyó su capacidad de imbibición. Además, generó una mayor reducción en la concentración de compuestos fenólicos (a excepción del ácido ferúlico, el cual se incrementó) y en la capacidad antioxidante de los cotiledones y de la testa, en comparación con el almacenamiento a menor temperatura y menor humedad relativa. El aumento significativo detectado en la concentración de ácido ferúlico libre y conjugado, en cotiledones y testa, únicamente en los granos almacenados a 37 °C y 75 % HR podría estar directamente relacionado con el endurecimiento del grano.
Palabras clave adicionales: Ácido ferúlico, capacidad antioxidante, cotiledones, frijol negro, testa
Variation of phenolic compounds of Phaseolus vulgaris L. during storage and its relationship with the hardening
ABSTRACT
A major limiting for consumption of legumes in tropical countries is the hardening of the grains during storage at high temperature and high relative humidity. The aim of this study was to determine the effect of storage conditions on phenolic compounds and antioxidant capacity of the cotyledons and seed coat of Phaseolus vulgaris L. and their relation to hardening. Grain samples were stored at 5 °C - 34 % RH and 37 °C - 75 % RH for 120 days. The physical properties (hardness, cooking time, imbibition capacity, electrical conductivity of the soaking water, moisture, and water activity) were measured in the whole grain, while phenolic compounds (total polyphenols, hydroxycinnamic acids, flavonoids, soluble condensed tannins, and lignin) and antioxidant capacity were measured in cotyledons and testa. Hydroxycinnamic acids and flavonoids were analyzed by HPLC-DAD/ESI-MS, the free compounds were extracted by methanol, and those bound to insoluble fiber were released by alkaline hydrolysis. Storage at 37 °C - 75 % RH increased grain hardness and decreased its imbibition capacity. Also, it generated a greater reduction in phenolic compounds concentration (except by ferulic acid, which increased) and antioxidant capacity of the cotyledons and the seed coat, compared with storage at 5 °C - 34 % RH. The significant increase detected in concentration of free and conjugated ferulic acid, only when stored at 37 °C - 75 % RH, could be directly related to the grain hardening.
Additional key words: Ferulic acid, antioxidant capacity, cotyledons, black bean, seed coat.
Recibido: Febrero 17, 2012 Aceptado: Julio 12, 2012
INTRODUCCIÓN
El frijol negro o caraota (Phaseolus vulgaris), una de las leguminosas más consumidas a nivel mundial, además de ser una fuente importante de proteína y de carbohidratos complejos puede considerarse un alimento funcional por su contenido de fibra soluble y de compuestos fenólicos (Mattei y Campos, 2011). En especial, las variedades negras de P. vulgaris son una rica fuente de componentes antioxidantes, ácidos hidroxicinámicos; flavonoles; antocianinas y proantocianinas; entre otros, que ayudan en la prevención de enfermedades crónicas, tales como cáncer, afecciones cardiovasculares, obesidad y diabetes (Hangen y Bennink, 2002; Díaz-Batalla et al., 2006; Gálvez et al., 2007).
Quintana (2001) afirma que las leguminosas en Venezuela son alimentos importantes para todos los estratos socioeconómicos y su consumo es un hábito generalizado e independiente del nivel de ingreso, siendo P. vulgaris la leguminosa de mayor producción y consumo en el país (MAT, 2008).
A pesar de estas características, el consumo de P. vulgaris es afectado negativamente por la baja calidad de los granos, siendo el endurecimiento uno de los defectos más importantes, el cual se genera durante el almacenamiento prolongado a alta temperatura y alta humedad relativa. Este defecto reduce la palatabilidad y el valor nutricional de los granos (Martin-Cabrejas et al., 1999). Adicionalmente, los largos tiempos de cocción incrementan el gasto de combustible. El endurecimiento de P. vulgaris ha sido extensivamente investigado; sin embargo, aún no se comprende totalmente. Se han propuesto varias hipótesis para explicar el mecanismo de endurecimiento, entre ellas, i) oxidación y/o polimerización de los lípidos; ii) insolubilización de las pectinas, iii) lignificación de la pared celular y de la laminilla media de los cotiledones; iv) mecanismos enzimáticos múltiples que incluyen pectinestereasas, polifenoloxidasas y lipoxigenasas; y v) cambios en las proteínas de almacenamiento (García et al., 1998).
La implicación de los compuestos fenólicos en el mecanismo de endurecimiento ha sido poco estudiada y los trabajos se han enfocado principalmente en los cotiledones de los granos. En este sentido, García et al. (1998) extrajeron ácidos hidroxicinámicos libres y conjugados a partir de cotiledones de granos (variedad Carioca) suaves y duros, y sugirieron que los cambios en los compuestos fenólicos podrían estar relacionados con el endurecimiento.
Los compuestos fenólicos pueden encontrarse en estado libre, conjugados con azúcares o esteres; enlazados a los polisacáridos y proteínas; y/o polimerizados, y no se distribuyen uniformemente en los tejidos o células, de allí la importancia de analizar por separado los cotiledones y la testa de los granos. En este orden de ideas, el objetivo de este trabajo fue evaluar el efecto del almacenamiento sobre los compuestos fenólicos y la capacidad antioxidante de los cotiledones y de la testa de P. vulgaris, y su relación con el endurecimiento de los granos.
MATERIALES Y MÉTODOS
Se utilizó una muestra recién cosechada de frijol negro (P. vulgaris, material SA029), suministrada por el Centro Nacional de Investigaciones Agropecuarias (CENIAP), Venezuela.
Para el almacenamiento, los granos recién cosechados se dividieron en tres lotes de 2000 g cada uno, el primero se analizó de inmediato (control) y los otros dos se almacenaron por 120 días bajo condiciones diferentes: 5 °C / 34 % HR y 37 °C / 75 % HR; esta última con el fin de propiciar el endurecimiento (García et al., 1998). Las cámaras de almacenamiento consistieron en recipientes rectangulares de vidrio con dimensiones de 45x35x20 cm, cuyo fondo se cubrió con soluciones salinas saturadas de MgCl2 y NaCl para alcanzar valores de humedad relativa de 34 y 75 %, respectivamente (Bell y Labuza 2000). Los granos se colocaron dentro de las cámaras sobre una placa perforada, evitando el contacto directo con la solución salina.
Los análisis físicos se realizaron en el grano entero, mientras que los químicos se hicieron en los cotiledones y en la testa por separado. Este fraccionamiento se efectuó previo remojo de los granos en agua (2:1 p/p, granos:agua) durante 1 h a 5 °C, luego se liofilizaron las fracciones y se procedió a su molienda hasta un tamaño de partícula inferior a 0,5 mm.
Análisis físicos
-Humedad: Se cuantificó por el método 925.10 de la AOAC (2000), deshidratando 1 g de muestra en estufa de vacío a 70 °C durante 24 h. Actividad de agua: Se determinó con una técnica psicrométrica utilizando el equipo Decagon CX-2 (AquaLab, USA).
-Capacidad de imbibición: Se utilizó el procedimiento de Nasar-Abbas et al. (2008) el cual consistió en colocar 10 g de granos en 50 mL de agua desionizada durante 18 h a temperatura ambiente, seguidamente se removieron los granos del agua, se lavaron con agua desionizada, se
separó la testa de los cotiledones, se secaron todas las fracciones con papel absorbente y finalmente se pesaron. Se tomó en cuenta los sólidos perdidos en las aguas de remojo y lavado para corregir el valor de la capacidad de imbibición.
-Conductividad del agua de remojo: Se midió según el método de Nasar-Abbas et al. (2008) con un equipo Oakton CON 510 (Eutech Instruments, Singapur). Para ello se remojaron 4 g de granos en 20 mL de agua desionizada durante 18 h a temperatura ambiente.
-Tiempo de cocción: Para su cuantificación se construyó un equipo denominado cooker Mattson siguiendo las recomendaciones de Jackson y Varriano-Marston (1981). Este equipo constaba de 25 barras de 90 ± 1 g de peso, cada una de las cuales se colocaba sobre un grano. Se registró el tiempo en el cual caía cada barra, penetrando el grano cocido y se tomó como tiempo de cocción el promedio de los tiempos correspondientes a las barras 12 y 13, de acuerdo a lo establecido por Maurer et al. (2004).
-Dureza de los granos cocidos: Los granos se remojaron en agua destilada (1:5 p/v, granos:agua) durante 18 h a temperatura ambiente y luego se colocaron en 100 mL de agua destilada a la temperatura de ebullición para cocinarlos durante 60 min. La dureza se midió con un texturómetro TA-XT2i (Stable Micro Systems, UK). La velocidad de compresión del ensayo fue de 1,0 mm·s-1, se usó una celda de 5 kg y una sonda múltiple para guisantes.
Análisis químicos
-Polifenoles totales: La extracción se hizo de acuerdo al método de Mujica et al. (2009) con algunas modificaciones. Se suspendió 0,5 g de cotiledones ó 0,05 g de testa en 12,5 mL de una solución metanólica al 80 % acidificada con HCl (0,1 % v/v) y se agitó durante 1 h a temperatura ambiente. Posteriormente, la mezcla se centrifugó a 1800 g durante 15 min y el residuo se extrajo nuevamente con 12,5 mL del solvente fresco. Los extractos se combinaron y se efectuó la cuantificación de acuerdo al método colorimétrico de Singleton y Rossi (1965).
-Taninos condensados solubles: La muestra recién molida, 1 g de cotiledones ó 0,02 g de testa se extrajo dos veces con 10 mL de metanol acidificado con HCl (1 %), usando un desintegrador de tejidos (Kinematica, USA) a 15000 rpm durante 60 s a temperatura ambiente.
Los sobrenadantes obtenidos, luego de centrifugar a 3500 g durante 15 min, se unieron y se aforaron a 25 mL. La cuantificación se realizó de acuerdo al método colorimétrico de las proantocianidinas descrito por Mole y Waterman (1987) y la curva de calibración se hizo con cloruro de cianidina. El principio del método se basa en la reacción con butanol/HCl y en la medida de la absorbancia a 550 nm.
-Lignina Klason: Se determinó gravimétricamente de acuerdo al método de Saura-Calixto et al. (1991). Inicialmente se obtuvieron los sólidos insolubles en alcohol aplicando reflujo continuo en un equipo de Soxhlet a 1 g de cotiledones ó 0,5 g de testa con 100 mL de metanol acidificado con HCl 11M (1% v/v) durante 4 h. El residuo obtenido se mezcló con 100 mL de H2SO4 12 M y se mantuvo con agitación durante 3 h a temperatura ambiente. Seguidamente se diluyó con agua destilada hasta obtener una concentración 1M de H2SO4 y se calentó a 100 °C durante 2,5 h en un digestor de fibra cruda Labconco mod. 30001. Se enfrió en un baño con hielo y se filtró al vacío en un crisol de placa porosa M, realizando tres lavados con 50 mL de agua y uno con 30 mL de acetona. El crisol con el residuo de lignina se secó en estufa a 60 °C toda la noche y finalmente se pesó.
-Capacidad antioxidante: se utilizó un método colorimétrico basado en la capacidad de los compuestos fenólicos para reducir o atrapar el radical 1,1-difenil-2-picril hidrazilo hidratado (DPPH). El extracto de muestra fue el mismo que se usó para análisis de polifenoles totales y la cuantificación se hizo de acuerdo a Yung-Ching et al. (2002). La solución de DPPH se preparó en metanol a una concentración de 100 ppm, en la cantidad suficiente para el trabajo del día y se mantuvo al resguardo de la luz. Para el análisis se distribuyó el extracto en una batería de tubos para un volumen final de 4 mL. Finalmente se dejó reaccionar durante 30 minutos al resguardo de la luz y luego se midió la absorbancia a 517 nm, ajustando a cero el equipo con un blanco de metanol:agua (2:1 v/v).
-Extracción de los compuestos fenólicos analizados por HPLC: Se obtuvieron tanto los componentes libres y sus formas conjugadas como los unidos a la fibra insoluble, siguiendo el procedimiento de García et al. (1998).
-Separación y cuantificación por cromatografía líquida con detector de fotodiodos alineados (LC-DAD): Se siguió el método reportado por Monagas et al. (2007) aplicando un gradiente compuesto por agua/ácido acético (98:2 v/v, eluyente A) y agua/acetonitrilo/ácido acético, (78:20:2 v/v/v, eluyente B) con un flujo de 1,0 mL·min-1 según el siguiente programa: 0-80 % B lineal, de 0 a 55 min; 80-90 % B lineal, de 55 a 57 min; 90 % B isocrático, de 57 a 70 min; 90-95 % B lineal, de 70 a 80 min; 95-100 % B, de 80 a 90 min, seguido del lavado y reequilibrio de la columna, de 90 a 120 min. Se inyectó un volumen de muestra de 40 µL para los compuestos fenólicos solubles en metanol y 100 µL para el resto de las fracciones. Todos los compuestos identificados se detectaron por su absorbancia a 325 nm.
Para comprobar la identificación de los compuestos fenólicos también se utilizó un equipo de LC-DAD equipado con un espectrómetro de masas cuadrupolar (Hewlett-Packard series 1100 MSD) acoplado a una interfase de ionización por electrospray (ESI). Esta técnica permite obtener información sobre posibles especies moleculares complejas y relaciones isotópicas de los átomos en las muestras. Las condiciones de la separación cromatográfica fueron idénticas a las anteriormente descritas, a excepción del flujo que fue de 0,7 mL·min-1. La temperatura y el flujo del gas de secado (N2) del ESI fueron 350 ºC y 10 L·min-1, respectivamente; presión del nebulizador: 380 Pa (55 psi); voltaje del capilar: 4000 V. El ESI se operó en modo negativo empleando un rango de masas entre 100 y 2000 m/z, con el siguiente programa de voltaje de fragmentación: 150 V (0-200 m/z) y 300 V (200-2000 m/z).
Todas las determinaciones se realizaron por triplicado y los resultados se evaluaron mediante un análisis de varianza utilizando el programa Statgraphics Centurion XV, previa comprobación de los supuestos de normalidad, homocedasticidad e independencia. La comparación de medias se realizó empleando la prueba de rango múltiple de Duncan.
RESULTADOS
Tal como se observa en el Cuadro 1, el almacenamiento a alta temperatura y alta humedad relativa (ATAH) aumentó significativamente (P≤0,05) la humedad, la actividad de agua, la conductividad del agua de remojo, el tiempo de cocción y la dureza de los granos almacenados, y redujo significativamente la capacidad de imbibición. Todo ello evidencia el desarrollo del endurecimiento en los granos sometidos a estas condiciones.
Cuadro 1. Propiedades físicas del control y de los granos almacenados durante 120 días
| Propiedades | Control | BTBH | ATAH | |
| Humedad (g por 100 g) | 10,18 b | 7,55 a | 12,46 c | |
| Actividad de agua (aw) | 0,719 b | 0,514 a | 0,716 b | |
| Capacidad de imbibición (%) | 95,12 b | 99,97 c | 65,48 a | |
| Conductividad eléctrica (μS·cm-1) | 569,3 a | 907,3 b | 3453,3 c | |
| Tiempo de cocción (min) | 8,82 a | 9,01 a | 95,53 b | |
| Dureza (N) | 20,85 a | 21,48 a | 112,49 b | |
Control: Granos recién cosechados. ATAH: Alta temperatura/Alta humedad relativa, BTBH: Baja temperatura/Baja humedad relativa. Diferentes letras en la misma fila indican diferencias significativas según la prueba de Duncan (P≤0,05)
En la condición de baja temperatura y baja humedad relativa (BTBH) se encontró una disminución significativa (P≤0,05) de la humedad y la actividad de agua, y un aumento significativo de la capacidad de imbibición y la conductividad del agua de remojo. En tanto que el tiempo de cocción y la dureza de los granos se mantuvieron constantes.
En el Cuadro 2 se observa que tanto en el control como en las muestras almacenadas, la concentración de los compuestos fenólicos y la capacidad antioxidante resultaron superiores en la testa, en comparación con los cotiledones de los granos.
Cuadro 2. Polifenoles totales, taninos condensados solubles (TCS), lignina y capacidad antioxidante de los cotiledones y de la testa del control y de los granos almacenados bajo condiciones seleccionadas durante 120 días
|
| Cotiledones |
| Testa | ||||
|
| Control | BTBH | ATAH |
| Control | BTBH | ATAH |
| Polifenoles totales/EAF (mg·g-1 MS) | 2,09 c | 0,94 b | 0,68 a |
| 66,97 b | 64,24 b | 36,47 a |
| TCS/ECC (mg·g-1MS) | 3,63 a | nd | nd |
| 5163,4 c | 4059,2 b | 1755,9 a |
| Lignina (g por 100 g MS) | 1,17 b | 0,97 a | 0,97 a |
| 16,88 b | 13,81 a | 17,99 c |
| Capacidad antioxidante (% EA) | 23,25 b | 16,36 a | 18,13 a |
| 86,94 b | 84,17 b | 74,72 a |
EAF: Equivalentes de ácido ferúlico. MS: Materia seca. ECC: Equivalentes de cloruro de cianidina. EA: Efecto atrapador. nd: No detectado. BTBH: Baja temperatura/Baja humedad relativa, ATAH: Alta temperatura/Alta humedad relativa. Para cada fracción (cotiledones o testa), diferentes letras en la misma fila indican diferencias significativas según la prueba de Duncan (P≤0,05)
En los cotiledones, tanto en BTBH como en ATAH se redujeron significativamente (P≤0,05) todos los compuestos fenólicos analizados y la capacidad antioxidante. En la testa, los polifenoles totales, los taninos condensados solubles y la capacidad antioxidante disminuyeron en la condición de ATAH, en un 46, 66 y 14 %, respectivamente, mientras que la lignina se incrementó en un 6 %. En la condición de BTBH, la concentración de polifenoles totales y la capacidad antioxidante de la testa se mantuvieron constantes mientras que los taninos condensados solubles y la lignina se redujeron en un 18 y 21 %, respectivamente.
Los componentes fenólicos identificados en cotiledones y testa por LC-DAD/ESI-MS se muestran en el Cuadro 3, con un total de 12 conjugados de ácidos hidroxicinámicos, 3 ácidos hidroxicinámicos libres y 6 compuestos tipo flavonoides. Los tiempos de retención resultaron superiores en el ESI-MS, y los componentes más polares presentaron menor tiempo de retención tanto con LC-DAD como con ESI-MS. En el Cuadro 3 además se indican las longitudes de onda de máxima absorción en el espectro UV.
Cuadro 3. Identificación de ácidos hidroxicinámicos y flavonoides en cotiledones y testa de P. vulgaris L. por LC-DAD/ESI-MS
| Pico # | Compuesto | tR LC/DAD | tR ESI-MS | Ión precursor [M-H]- | Fragmentos de [M-H]- | λ maxc |
| 1 | Conjugado ácido ferúlico-acido glucarico/galactarico | 9,525 | 16,445 | 385 | 209/191/147/129 | 241/sh 297/324 |
| 2 | Conjugado ácido p-coumarico-ácido glucarico/galactarico | 10,392 | 17,296 | 355 | 209/191/147 | 238/sh 297/313 |
| 3 | Conjugado ácido ferúlico-acido glucarico/galactarico | 11,041 | 18,578 | 385 | 209/191/147/129 | 230/sh 297/318 |
| 4 | Conjugado ácido ferúlico-acido glucarico/galactarico | 11,894 | 20,789 | 385 | 209/191/147/129 | 230/325 |
| 5 | Conjugado ácido ferúlico-acido glucarico/galactarico | 12,631 | 22,795 | 385 | 209/191/147/129 | 234/sh 297/325 |
| 6 | Conjugado ácido ferúlico-acido glucarico/galactarico | 13,481 | 24,260 | 385 | 209/191/147/129 | 235/sh 297/326 |
| 7 | Conjugado ácido ferúlico-acido glucarico/galactarico | 14,252 | 25,258 | 385 | 209/191/147/173/129 | 235/sh 297/322 |
| 8 | Conjugado ácido sinápico-ácido glucarico/galactarico | 15,700 | 28,408 | 415 | 209/191/147/173/129 | 240/328 |
| 9 | Conjugado ácido ferúlico-acido glucarico/galactarico | 16,542 | 30,807 | 385 | 209/191/147/173/ 129 | 238/sh 297/326 |
| 10 | Conjugado ácido ferúlico-acido glucarico/galactarico | 17,485 | 31,751 | 385 | 209/191/147/173/129 | 235/sh 297/325 |
| 11 | Conjugado ácido sinápico-ácido glucarico/galactarico | 18,860 | 34,759 | 415 | 209/191/164/147/129 | 238/325 |
| 12 | Conjugado ácido sinápico-ácido glucarico/galactarico | 20,008 | 36,290 | 415 | 223/209/191/173/164/147/129 | 235/322 |
| 13 | Ácido (trans) p-cumarico | 21,500 | 39,000 | 163 | 163/147/119 | 232/sh 297/309 |
| 14 | Ácido no identificado | 24,859 | 46,250 | 367 | 193/173/143/129 | 232/sh 297/328 |
| 15 | Ácido (trans) ferúlico | 26,183 | 47,025 | 193 | 134 | 234/sh 297/324 |
| 16 | Miricetina-3-O-glucósido | 28,940 | 52,334 | 479 | 316/287/271/256 | 260/sh 303/354 |
| 17 | Ácido sinápico | 29,810 | 52,964 | 223 | 193/179/164/149 | 237/323 |
| 18 | Miricetina-3-(6'malonil)-glucósido | 30,684 | 55,050 | 521 | 479/407/316/300/287/ 271/227 | 259/sh 303/354 |
| 19 | Quercetina glucósido | 35,646 | 61,031 | 463 | 300/271/243 | 255/sh 303/353 |
| 20 | Quercetina-3-(6'malonil)-glucósido | 38,646 | 64,011 | 549 | 505/463/300/271/255/ 243/227 | 257/sh 303/348 |
| 21 | Canferol glucósido | 42,567 | 67,735 | 447 | 284/255/227 | 265/sh 300/347 |
| 22 | Canferol-3-(6'malonil)-glucósido | 47,740 | 74,769 | 533 | 511/489/429/307/285/284/255/227 | 264/sh 300/347 |
tR: Tiempo de retención. [M-H]-: Peso molecular del ión precursor. cλ max: Longitud de onda de máxima absorción en el espectro UV
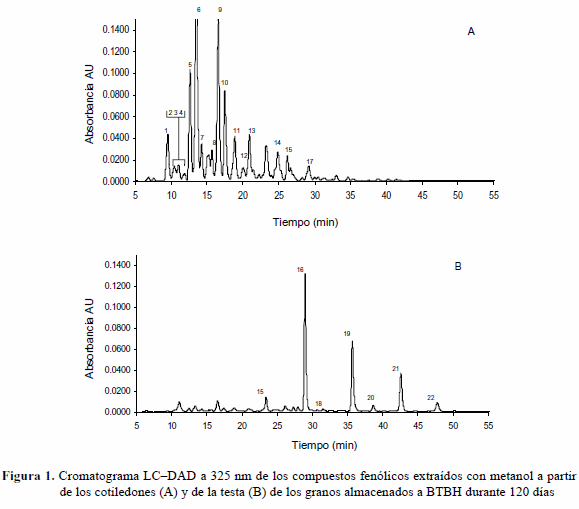
La Figura 1 ejemplifica la distribución de los picos en los cromatogramas LC-DAD de los extractos metanólicos de los cotiledones y de la testa de los granos almacenados a BTBH durante 120 días, los cromatrogramas del resto de las muestras (no mostrados) presentaron una distribución semejante, con diferencias principalmente en la altura de los picos. Se observa que en los cotiledones sólo se encuentran los ácido hidroxicinámicos identificados y sus conjugados, mientras que en la testa predominan los compuestos de tipo flavonoides.
El ácido (trans) ferúlico y sus conjugados fueron los componentes mayoritarios de los extractos metanólicos de los cotiledones, tal como se indica en el Cuadro 4, mientras que en la testa lo fue el compuesto miricetina-3-O-glucósido, y el ferúlico fue el principal ácido hidroxicinámico detectado en la misma. El almacenamiento disminuyó el contenido total de los compuestos fenólicos en los cotiledones y en la testa, en comparación al control, en un 31 % (BTBH)/59 % (ATAH) y 41 % (BTBH)/78 % (ATAH), respectivamente. No obstante, hubo un aumento significativo (P≤0,05) de la concentración de ácido ferúlico tanto en los cotiledones como en la testa de las muestras almacenadas bajo ATAH.
Cuadro 4. Composición fenólica de los extractos metanólicos de los cotiledones y de la testa del control y de los granos almacenados durante 120 días
| Compuesto fenólico (μg·g-1) | Control | BTBH | ATAH |
| Cotiledones | |||
| Conjugado ácido ferúlico - acido glucarico/galactarico | 123,07 c | 72,99 b | 19,45 a |
| Conjugado ácido p-coumarico - ácido glucarico/galactarico | 4,71 c | 2,43 b | 0,39 a |
| Conjugado ácido sinápico - ácido glucarico/galactarico | 17,01 c | 11,02 b | 2,05 a |
| Ácido (trans) p-cumarico | 1,95 b | 1,34 ab | 0,93 a |
| Ácido (trans) ferúlico | 5,54 b | 2,67 a | 9,28 c |
| Ácido sinápico | 3,85 b | 2,20 a | 1,17 a |
| Total | 164,48 | 96,90 | 34,52 |
| Testa |
|
|
|
| Ácido (trans) p-cumarico | nd | nda | 2,10 |
| Ácido (trans) ferúlico | 3,74 a | 3,29 a | 16,96 b |
| Miricetina-3-O-glucósido | 326,83 b | 238,15 ab | 133,39 a |
| Miricetina-3-(6'malonil)-glucósido | 18,90 b | 16,74 b | nd |
| Quercetina glucósido | 243,83 c | 164,35 b | 98,17 a |
| Quercetina-3-(6'malonil)-glucósido | 23,71 b | 15,43 a | nd |
| Canferol glucósido | 113,11 c | 67,53 b | 49,80 a |
| Canferol-3-(6'malonil)-glucósido | 38,02 c | 23,67 b | 7,79 a |
| Total | 768,14 | 529,14 | 308,22 |
Los datos son expresados como promedio (n=3). Baja temperatura/Baja humedad relativa, ATAH: Alta temperatura/Alta humedad relativa. Diferentes letras para cada fracción (cotiledones o testa) en la misma fila indican diferencias significativas según la prueba de Duncan (P≤0,05). nd: no detectado
Con respecto a los compuestos fenólicos presentes en los extractos alcalinos de la fibra insoluble (Cuadro 5), el ácido ferúlico presentó mayor concentración en los cotiledones y el miricetina-3-O-glucósido en la testa. El almacenamiento a ATAH produjo un incremento significativo en la concentración del ácido ferúlico en los cotiledones, tanto en la fracción hidrolizada con NaOH 0,1 M como con NaOH 4,0 M, resultando cuatro veces mayor al control, en ambos casos. También el contenido fenólico total de los extractos alcalinos fue superior en los cotiledones de los granos almacenados a ATAH.
Cuadro 5. Composición fenólica de los extractos alcalinos de la fibra insoluble de los cotiledones y de la testa, en el control y en los granos almacenados durante 120 días.
| Compuesto fenólico (μg·g-1) | 0,1 M NaOH |
| 4,0 M NaOH | ||||
| Control | BTBH | ATAH |
| Control | BTBH | ATAH | |
| Cotiledones | |||||||
| Ácido (trans) p-cumarico | 0,05 a | 0,03 a | 0,05 a |
| 0,08 ab | 0,05 a | 0,13 b |
| Acido (trans) ferúlico | 0,07 a | 0,06 a | 0,34 a |
| 0,13 b | 0,07 a | 0,51 c |
| Ácido sinápico | 0,02 a | 0,02 a | 0,03 a |
| 0,04 b | 0,02 a | 0,02 a |
| Total | 0,14 | 0,11 | 0,42 |
| 0,25 | 0,14 | 0,66 |
| Testa |
|
|
|
|
|
|
|
| Ácido (trans) p-cumarico | 0,20 a | 0,22 a | 0,19 a |
| 0,42 a | 0,28 a | 0,28 a |
| Acido (trans) ferúlico | 0,25 a | 0,30 a | 0,27 a |
| 0,45 a | 0,42 a | 0,42 a |
| Miricetina-3-O-glucósido | 6,95 a | 9,25 b | 6,31 a |
| 6,72 a | 6,47 a | 6,47 a |
| Miricetina-3-(6'malonil)-glucósido | 5,99 a | nd | nd |
| nd | nd | nd |
| Quercetina glucósido | 2,51 a | 5,04 b | 1,69 a |
| 2,69 a | 2,83 a | 2,83 a |
| Quercetina-3-(6'malonil)-glucósido | 0,91 a | nd | nd |
| nd | nd | nd |
| Canferol glucósido | 2,93 a | 3,98 b | 2,68 a |
| 2,49 a | 2,51 a | 2,51 a |
| Canferol-3-(6'malonil)-glucósido | 2,30 a | 2,55 a | nd |
| nd | nd | nd |
| Total | 22,04 | 21,35 | 11,33 |
| 12,76 | 12,51 | 12,51 |
Los datos son expresados como promedio (n=3). Baja temperatura/Baja humedad relativa, ATAH: Alta temperatura/Alta humedad relativa. Diferentes letras para cada fracción (cotiledones o testa) en la misma fila indican diferencias significativas según la prueba de Duncan (P≤0,05). nd: no detectado
En la testa, los conjugados 3-(6malonil)-glucósido de los extractos alcalinos desaparecieron durante el almacenamiento, a excepción del canferol-3-(6malonil)-glucósido que permaneció constante a BTBH en la fracción hidrolizada con NaOH 0,1 M. En relación al contenido fenólico total de los extractos de la testa, resultó inferior en la muestras almacenadas a ATAH e hidrolizadas con NaOH 0,1 M, mientras que en la fracción hidrolizada con NaOH 4,0 M se mantuvo constante en ambas condiciones de almacenamiento.
DISCUSIÓN
Propiedades físicas de los granos. Tal como era de esperarse, los granos almacenados absorbieron o perdieron humedad para alcanzar el equilibrio con el aire circundante. La humedad en la condición de ATAH fue superior en un 65 %, en comparación con BTBH. Resultados similares fueron obtenidos por Hentges et al. (1991) con variedades de P. vulgaris almacenadas a 30 y 65 % HR, quienes afirman que es la combinación contenido de humedad-temperatura, y no estos factores por separado, lo que resulta relevante en el desarrollo del endurecimiento de los granos. Reyes-Moreno et al. (2001) también reportaron un incremento del 63 % en el contenido de humedad de granos de garbanzo (Cicer arietinum L.) almacenados a 75 % HR por 160 días.
Por otra parte, el hecho de que la actividad de agua sea superior en los granos almacenados a ATAH implica que bajo estas condiciones pueden ocurrir un mayor número de reacciones de deterioro al existir una mayor proporción de agua libre, lo cual finalmente estará asociado con el endurecimiento de los granos.
En relación a la conductividad del agua de remojo, el aumento significativo (P≤0,05) del 507 % en los granos almacenados a ATAH pudo deberse a la expulsión de electrolitos a través de la membrana celular de los cotiledones, deteriorada por la condición de estrés abiótico a la que fueron sometidos los granos. En este sentido, Richardson y Stanley (1991) detectaron cambios en los lípidos de la membrana celular de los cotiledones de granos endurecidos a través del análisis de sus ácidos grasos, concluyendo que el daño de la membrana podría explicar el aumento de los sólidos perdidos en el agua de remojo.
El tiempo de cocción y la dureza de los granos también fueron drásticamente afectados por el almacenamiento a ATAH, puesto que estas variables se incrementaron en un 983 y 440 %, respectivamente. En este sentido, Del Valle y Stanley (1995) luego del primer mes de almacenamiento a 30 °C y 75 % encontraron un aumento del 700 % en la dureza de los granos de P. vulgaris variedad Blackhawk. Con otras especies de leguminosas como Cicer arietinum y Vicia Faba, se han reportado incrementos de 133 y 224 % en la dureza, luego de 160 días y de un año, respectivamente, bajo altas temperaturas y humedades relativas (Reyes-Moreno et al., 2001; Nasar-abbas et al., 2008).
Martin-Cabrejas et al. (1997) publicaron un aumento de 1100 % en el tiempo de cocción de P. vulgaris variedad Mwezi Moja, al pasar de 10 a 120 min, durante su almacenamiento en condiciones tropicales (30-40 ºC y 75 % HR). Medeiros et al. (2007) almacenaron dos variedades de P. vulgaris, Peruano y Paraíso, por 135 días bajo dos condiciones, 29 ºC y 75 % HR, y 5 ºC y 75 % HR, encontrando incrementos de 261 y 77 % en la primera variedad, y de 61 y 38 % en la segunda variedad.
Cabe resaltar que el incremento de la dureza o tiempo de cocción a ATAH y la reducción de la capacidad de imbibición se han asociado a cambios en la pared celular de los cotiledones que aumentan su rigidez y dificultan el ablandamiento de los granos durante la cocción (García et al., 1998; Shiga et al., 2004).
Por su parte, los granos almacenados a BTBH mantuvieron las propiedades iniciales, en especial la dureza, en concordancia con lo expuesto por Kyriakidis et al. (1997) quienes consideraron como granos suaves aquellos con una dureza entre 19,7 y 30,2 N, luego de 1 h de cocción a presión atmosférica. De estos resultados puede inferirse que las condiciones ideales para el almacenamiento postcosecha de los granos de P. vulgaris son las bajas temperaturas y humedades relativas, típicas de los climas templados, por lo que estos representan la condición idónea, desde este punto de vista, para centros de acopio de las leguminosas destinadas al consumo doméstico o uso industrial.
Polifenoles totales, taninos condensados solubles (TCS), lignina y capacidad antioxidante. La concentración de polifenoles totales fue superior en la testa por ser ésta rica en compuestos flavonoides, y concuerda con lo encontrado por Gálvez et al. (2007) en testa y cotiledones de variedades negras de P. vulgaris, 49-73 y 0,62-0,81 mg·g-1 de catequina equivalentes, respectivamente. Anton et al. (2007) reportaron 10,13 mg·g-1 de ácido ferúlico equivalentes de testa en variedades moteadas, seis veces menor a lo encontrado en esta investigación para una variedad oscura. Esta diferencia se atribuye principalmente al color de la testa.
En general, la reducción de los compuestos fenólicos durante el almacenamiento fue superior a ATAH y podría estar relacionada con el endurecimiento de los granos. Es posible que parte de los compuestos fenólicos extraíbles, especialmente el ácido ferúlico se enlacen a componentes no extraíbles como las hemicelulosas y pectinas, y formen puentes fenólicos entre éstos que aumenten la rigidez de la pared celular (García et al., 1998). En relación a los TCS, algunos autores sostienen que éstos pueden condensarse o formar complejos con proteínas o polisacáridos de la pared celular, lo cual los insolubiliza y no permite su extracción con el solvente (Stanley, 1992). Algunos estudios han demostrado que los taninos condensados solubles disminuyen o son menos extraíbles en los granos endurecidos, por lo tanto estos compuestos fenólicos también pudiesen estar implicados en el endurecimiento (Stanley, 1992; Granito et al., 2008).
El contenido de lignina, como era de esperarse, fue mucho mayor (14 veces) en la testa y su concentración disminuyó con el almacenamiento tanto en cotiledones como en testa, excepto en esta última a ATAH. A partir de este resultado se deduce que la lignificación de la pared celular de los cotiledones no fue la causa principal del endurecimiento de los granos. Del Valle y Stanley (1995) afirman que el endurecimiento de P. vulgaris ocurre en dos etapas, la primera se debe a un mecanismo reversible que puede completarse en un período de 100 días y la segunda etapa corresponde a un mecanismo irreversible. Posiblemente los 120 días de almacenamiento evaluados no fueron suficientes para detectar incremento en la concentración de lignina en los cotiledones de los granos almacenados en ATAH, puesto que este compuesto se ha asociado al mecanismo de endurecimiento irreversible. En este sentido, Hincks y Stanley (1987) quienes basaron sus conclusiones sólo en estudios de microscopía sin llegar a cuantificar la cantidad de lignina, encontraron evidencias de lignificación en los cotiledones de granos almacenados a 30 °C y 85 % HR durante 10 meses.
Con respecto a la capacidad antioxidante, medida como efecto atrapador del radical DPPH en los extractos con concentración de 5 mg·mL-1, se tiene que también resultó superior en la testa en comparación con los cotiledones, en concordancia con lo reportado por Gálvez et al. (2007) para variedades negras de P. vulgaris, y en ambas partes la reducción de la actividad antioxidante fue mayor en ATAH. Asimismo, Granito et al. (2008) reportaron una reducción del 79 % en la capacidad antioxidante de los granos almacenados, superior a la encontrada en este estudio debido a la mayor severidad de las condiciones empleadas por estos investigadores (50 °C y 80 % HR). Machado et al. (2008), por su parte, encontraron una disminución significativa del 21% en la capacidad antioxidante de los granos de P. vulgaris, de una variedad negra, conservados a 29 °C y 65 % HR por cinco meses.
Composición fenólica de los extractos metabólicos. En los cotiledones, el ácido hidroxicinámico presente en mayor concentración fue el ferúlico, seguido en orden por el sinápico y el p-cumarico, y este mismo comportamiento se observó en los conjugados. Los resultados concuerdan con lo reportado por Espinosa-Alonso, et al. (2006), quienes reportaron rangos de 14,91-34,01 µg·g-1 para ácido ferúlico y sus derivados, 16,25 µg·g-1 para ácido sinápico y sus derivados y 3,39-8,65 µg·g-1 para ácido p-cumárico y sus derivados, en variedades negras de P. vulgaris. De igual forma, Gálvez et al. (2007) encontraron 1,1-6,6 µg·g-1 ácido ferúlico en siete variedades negras brasileras y peruanas, semejante a lo cuantificado en este estudio.
Las condiciones de almacenamiento afectaron significativamente la concentración de los compuestos fenólicos cuantificados por HPLC en los cotiledones, y al considerar el total de los mismos se confirman los resultados señalados anteriormente. La disminución en la cantidad de los conjugados y el aumento del ácido ferúlico durante el almacenamiento en ATAH concuerda con lo señalado por Srisuma et al. (1989), García et al. (1998) y Machado et al. (2008), a excepción de que estos investigadores también encontraron un aumento significativo en las concentraciones de los ácido sinápico y p-cumarico. En este sentido, diversos autores afirman que las altas temperaturas y humedades relativas generan estrés en el grano y en consecuencia pueden activar mecanismos que promuevan la liberación de los ácidos hidroxicinámicos a partir de sus derivados conjugados y de la síntesis de novo con aminoácidos como la L-fenilalanina y L-tirosina (García et al. 1998; Srisuma et al., 1989). Los ácidos hidroxicinámicos, principalmente el ácido ferúlico, pueden luego unirse a polisacáridos o a proteínas de la pared celular y participar en reacciones de entrecruzamiento vía acoplamiento oxidativo por acción de las peroxidasas (Faulds y Williamson, 1999) incrementando la rigidez de la pared y la resistencia a la separación celular durante la cocción, produciendo así el endurecimiento.
En la testa, los derivados de miricetina se encontraron en mayor concentración, seguidos en orden por los de quercetina y canferol, lo cual concuerda con lo encontrado por Aparicio-Fernández et al. (2005) quienes afirman ser los primeros en reportar un glucósido de miricetina en P. vulgaris. Lin et al. (2008) señalaron al miricetina-3-O-glucósido como el principal flavonol presente en variedades negras de P. vulgaris. La magnitud de los derivados flavonoles coincide con lo reportado por Beninger et al. (2005) y por Gálvez et al. (2007) aunque éstos no detectaron los derivados de miricetina.
En relación al efecto del almacenamiento, la disminución de los derivados flavonoles pudo deberse a su interacción con los taninos condesados, transformando a estos últimos en compuestos menos solubles. Finalmente, es importante destacar que no se encontraron en la literatura disponible otras investigaciones referentes al efecto de las altas temperaturas y humedades relativas sobre los flavonoles de la testa y su relación con el endurecimiento de variedades negras de P. vulgaris.
Composición fenólica de los extractos alcalinos de la fibra insoluble. El incremento del ácido ferúlico ocurrió tanto en la fracción hidrolizada con NaOH 0,1 M como con NaOH 4,0 M, de lo cual se deduce que este ácido se encontraba esterificado a diferentes polisacáridos de la pared celular de los cotiledones. El ácido ferúlico puede encontrarse unido, a través de enlaces tipo éster, a los residuos de arabinosa y galactosa de las pectinas presentes en las paredes celulares de plantas dicotiledóneas (Faulds y Williamson, 1999). Cabe destacar que P. vulgaris pertenece a este tipo de plantas, y se ha demostrado que la pared celular de los cotiledones está compuesta principalmente por pectinas ricas en arabinosa, con diversas estructuras, las extraídas con NaOH 4 M son altamente ramificadas y de mayor peso molecular que las solubilizadas con NaOH 0,1 M (Shiga et al., 2003).
Asimismo, el ácido ferúlico ha sido señalado como el principal responsable del endurecimiento de vegetales como los espárragos, la castaña china y la remolacha azucarera (Ng et al., 1998; Parker et al., 2003; Rodríguez-Arcos et al., 2004) por la formación de puentes de ácido diferúlico entre polisacáridos de la pared celular. Aunque este ácido no se detectó en los cotiledones de los granos almacenados en ATAH, no se descarta la posibilidad de que se haya formado a muy bajas concentraciones y que luego se haya destruido durante la hidrólisis alcalina aplicada en el método, por lo que se puede señalar al ácido ferúlico como el principal responsable del endurecimiento de los granos de P. vulgaris.
CONCLUSIONES
El almacenamiento de los granos de P. vulgaris a alta temperatura y alta humedad relativa generó una mayor reducción de los compuestos fenólicos totales, taninos condensados solubles y capacidad antioxidante, en cotiledones y testa, en comparación con la condición de baja temperatura y baja humedad relativa, lo que conlleva a concluir que estos compuestos participan en el mecanismo de endurecimiento de los granos, y que este defecto comprende cambios tanto en un tejido como en otro. Adicionalmente, el aumento significativo de la concentración de ácido ferúlico, tanto en los extractos metanólicos como en los alcalinos de la fibra insoluble, en cotiledones y testa, únicamente bajo la condición de alta temperatura y alta humedad relativa implica que dicho compuesto está directamente relacionado con el endurecimiento de los granos.
LITERATURA CITADA
1. Anton, A., K. Ross, T. Beta, G. Fulcher y S. Arntfield. 2007. Effect of pre-dehulling treatments on some nutritional and physical properties of navy and pinto beans (Phaseolus vulgaris L.). LWT-Food Sci. Technol. 41(5): 771-778. [ Links ]
2. AOAC (Association of Official Analytical Chemists). 2000. Official Methods of Analysis. 15th Edition. Washington. USA. [ Links ]
3. Bell, L. y T. Labuza. 2000. Moisture sorption: practical aspects of isotherm measurement and use. American Association of Cereal Chemists St. Paul, MN. [ Links ]
4. Beninger, C., L. Gu, R. Prior, D. Junk, A. Vandenberg y K. Bett. 2005. Changes in polyphenols of the seed coat during the after-darkening process in pinto beans (Phaseolus vulgaris L.). J. Agric. Food Chem. 53(20): 7777–7782. [ Links ]
5. Del Valle, J., y D. Stanley. 1995. Reversible and irreversible components of bean hardening. Food Res. Intl. 28(5): 455-463. [ Links ]
6. Diaz-Batalla, L., J. Widholm, G. Fahey, E. Castaño-Tostado y O. Paredes-Lopez. 2006. Chemical components with health implications in wild and cultivated Mexican common bean seeds (Phaseolus vulgaris L.). J. Agric. Food Chem. 54(6): 2045-2052. [ Links ]
7. Espinosa-Alonso, L., A. Lygin, J. Widholm, M. Valverde y O. Paredes-Lopez. 2006. Polyphenols in wild and weedy Mexican common beans (Phaseolus vulgaris L.). J. Agric. Food Chem. 54(12): 4436-4444. [ Links ]
8. Faulds, C. y G. Williamson. 1999. The role of hydroxycinnamates in the plant cell wall. J. Sci. Food Agric. 79(3): 393-395. [ Links ]
9. Gálvez, L., M. Genovese y F. Lajolo. 2007. Polyphenols and antioxidant capacity of seed coat and cotyledon from Brazilian and Peruvian bean cultivars (Phaseolus vulgaris L.). J. Agric. Food Chem. 55(1): 90-98. [ Links ]
10. García, E., T. Filisetti, J. Udaeta y F. Lajolo. 1998. Hard-to-cook beans (Phaseolus vulgaris): involvement of phenolic compounds and pectates. J. Agric. Food Chem. 46 (6): 2110–2116. [ Links ]
11. Granito, M., M. Paolini y S. Pérez. 2008. Polyphenols and antioxidant capacity of Phaseolus vulgaris stored under extreme conditions and processed. LWT-Food Sci. Technol. 41(6): 994-999. [ Links ]
12. Hangen, L. y M. Bennink. 2002. Consumption of black beans and navy beans (Phaseolus vulgaris) reduced azoxymethane-induced colon cancer in rats. Nutr. Cancer, 44 (1): 60-65. [ Links ]
13. Hentges, D., C. Weaver y S. Nielsen. 1991. Changes of selected physical and chemical components in the development of the hard-to-cook bean defect. J. Food Sci. 56(2): 436-442. [ Links ]
14. Hincks, M. y D. Stanley. 1987. Lignification: evidence for a role in hard-to-cook beans. J. Food Biochem. 11(1): 41-58. [ Links ]
15. Jackson, M. y E. Varriano-Marston. 1981. Hard-to-Cook phenomenon in beans: effects of accelerated storage on water absorption and cooking time. J. Food Sci. 46(3): 799-803. [ Links ]
16. Kyriakidis, N., A. Apostolidis, L. Papazoglou y V. Karathanos. 1997. Physicochemical studies of Hard-to-Cook beans (Phaseolus vulgaris). J. Sci. Food Agr. 74(2): 186–192. [ Links ]
17. Lin, L., J. Harnly, M. Pastor-Corrales y D. Luthria. 2008. The polyphenolic profiles of common bean (Phaseolus vulgaris L.). Food Chem. 107(1): 399-410. [ Links ]
18. Machado, C., M. Ferruzzi y S. Nielsen. 2008. Impact of the Hard-to-Cook Phenomenon on Phenolic Antioxidants in Dry Beans (Phaseolus vulgaris). J. Agric. Food Chem. 56(9): 3102–3110. [ Links ]
19. Martin-Cabrejas, M., R. Esteban, P. Pérez, G. Maina y K. Waldron. 1997. Changes in physicochemical properties of dry beans (Phaseolus vulgaris) during long-term storage. J. Agric. Food Chem. 45(8): 3223-3227. [ Links ]
20. Martin-Cabrejas, M., L. Jaime, C. Karanja, A. Downie, M. Parker, F. López-Andreu, G. Maina, R. Esteban, A. Smith y K. Waldron. 1999. Modifications to physicochemical and nutritional properties of hard-to-cook beans (Phaseolus vulgaris) by extrusion cooking. J. Agric. Food Chem. 47(3): 1174-1182. [ Links ]
21. Mattei, J., F. Hu y H. Campos. 2011. A higher ratio of beans to white rice is associated with lower cardiometabolic risk factors in Costa Rican adults. Am J Clin Nutr. 94(3): 869-76. [ Links ]
22. Maurer, G., B. Ozen, L. Mauer y S. Nielsen. 2004. Analysis of hard-to-cook red and black common beans using transform infrared spectroscopy. J. Agric. Food Chem. 52(6): 1470-1477. [ Links ]
23. Medeiros, C., J. Pires, C. Mattos, E. Marcos y S. Mui. 2007. Effect of phytate and storage conditions on the development of t he hard-to-cook phenomenon in common beans. J. Sci. Food Agr. 87(7): 1237-1243. [ Links ]
24. MAT (Ministerio de Agricultura y Tierras). 2008. VII Censo Agrícola Nacional Leguminosas: Caraota. Caracas. Venezuela. [ Links ]
25. Mole, S. y P. Waterman. 1987. A critical analysis of techniques for measuring tannins in ecological studies. I. Techniques for chemically defining tannins. Oceologia. 72(1): 137-147. [ Links ]
26. Monagas M, I. Garrido, R. Lebron-Aguilar, B. Bartolomé y M. Gómez-Cordovés. 2007. Almond (Prunus dulcis (Mill.) D.A. Webb) skins as a potential source of bioactive polyphenols. J. Agric. Food Chem. 55: 8498-8507. [ Links ]
27. Mujica, M., M. Granito y N. Soto. 2009. Importance of the extraction method in the quantification of total phenolic compounds in Phaseolus vulgaris L. Inci. 34(9): 650-654. [ Links ]
28. Nasar-Abbas, S., J. Plummer, K. Siddique, P. White, D. Harris y K. Dods. 2008. Cooking quality of faba bean after storage at high temperature and the role of lignins and other phenolics in bean hardening. LWT-Food Sci. Technol. 41(7): 1260-1267. [ Links ]
29. Ng, A., A. Harvey, M. Parker, A. Smith y K. Waldron. 1998. Effect of oxidative coupling on the thermal stability of texture and cell wall chemistry of beet root (Beta vulgaris). J. Agric. Food Chem. 46(8): 3365-70. [ Links ]
30. Parker, C., M. Parker, A. Smith y K. Waldron. 2003. Thermal stability of texture in Chinese water chestnut may be dependent on 8,8-diferulic acid (aryltetralynform). J. Agric. Food Chem. 51(7): 2034-39. [ Links ]
31. Quintana E. 2001. Las leguminosas en la alimentación venezolana durante cinco décadas (1945-1997). Rev Esp Nutr Comunit. 7(3-4): 70-77. [ Links ]
32. Reyes-Moreno, C., O. Rouzaud-Sandez, J. Milán-Carrillo, J. Garzón-Tiznado y L. Camacho-Hernández. 2001. Hard-to-cook tendency of chickpea (Cicer arietinum L) varieties. J. Sci. Food Agr. 81(10): 1008-1012. [ Links ]
33. Richardson, J., y D. Stanley. 1991. Relationship of loss of membrane functionally and hard-to-cook defect in aged beans. J. Food Sci. 56(2): 590-591. [ Links ]
34. Rodríguez-Arcos, R., A. Smith y K. Waldron. 2004. Ferulic acid crosslinks in asparagus cell walls in relation to texture. J. Agric. Food Chem. 52(15): 4740-4750. [ Links ]
35. Saura-Calixto, F., I. Goñi, E. Mañas y R. Abia. 1991. Klanson lignin, condensed tannins and resistant protein as dietary fiber constituents: determination in grape pomaces. Food Chem. 39(3): 299-309. [ Links ]
36. Shiga, T., F. Lajolo y M. Filisetti. 2003. Cell wall polysaccharides of common beans (Phaseolus vulgaris L.). Ciênc. Tecnol. Aliment. 23(2): 141-148. [ Links ]
37. Shiga, T., F. Lajolo y M. Filisetti. 2004. Changes in the cell wall polysaccharides during storage and hardening of beans. Food Chem. 84(1): 53-64. [ Links ]
38. Singleton, V. y A. Rossi. 1965. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. Am. J. Enol. Viticult. 16(3): 144-158. [ Links ]
39. Srisuma, N., R. Hammerschmidt, M. Uebersax, S. Ruengsakulrach, M. Bennik y G. Hosfield. 1989. Storage induced changes of phenolic acids and the development of hard-to-cook in dry beans (Phaseolus vulgaris, var Seafarer). J. Food Sci. 54(2): 311-314, 318. [ Links ]
40. Stanley, D. 1992. A possible role for condensed tannins in bean hardening. Food Res. Intl. 25(3): 187-192. [ Links ]
41. Yung-Ching, Ch., Ch. Cheng-Tien y Ch. Wen-Wan. 2002. Antioxidative activity and safety of the 50 % ethanolic extract from red bean fermented by Bacillus substilis IMR-NK1. J. Agric. Food Chem. 50(8): 2454-2458. [ Links ]