Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro vol.24 no.3 Barquisimeto dic. 2012
Organogénesis in vitro en piña española roja y morfoanatomía foliar de las plantas Obtenidas en el proceso
Adriana Pineda1, Teresa E. Vargas1, Marcia Escala2 y Eva de García1
1 Instituto de Biología Experimental, Facultad de Ciencias, Universidad Central de Venezuela. Caracas. Venezuela. e-mail: eva.cristina.garcia@gmail.com
RESUMEN
La piña, Ananas comosus (L.) Merr., es un cultivo de gran importancia comercial por la alta demanda de su fruto. Esto ha conducido a la búsqueda de nuevos métodos de propagación que permitan acelerar la producción de propágulos para la plantación en el campo, y entre éstos, cabe señalar, el cultivo in vitro de yemas que permite mejorar sustancialmente el proceso de multiplicación. En el presente trabajo se estableció y analizó un proceso de organogénesis para la clonación de plantas de piña Española Roja mediante el uso de secciones de hojas de la planta en el establecimiento del sistema de propagación. Para comprobar la naturaleza organogénica del proceso se realizó un análisis histológico y anatómico del material vegetal cultivado in vitro. Así mismo, se evaluó, la existencia de posibles variaciones morfoanatómicas en la estructura foliar de la población clonal, obtenida mediante el proceso organogénico. Los resultados mostraron, rizogénesis directa, y formación de vástagos vía callo en el medio de cultivo que contenía 2,5 mg·L-1de 2,4-D, a la vez que hubo formación de raíces y vástagos, vía organogénesis indirecta, en el medio que contenía 5 mg·L-1de ANA y 0,25 mg·L-1 de BA. Se obtuvo el 100 % de plantas aclimatadas. Por otra parte, los cambios morfológicos y anatómicos presentados por las vitroplantas fueron revertidos durante la aclimatación y su posterior paso a condiciones de vivero. En consecuencia, se puede considerar que los mismos son cambios fenotípicos temporales, producto de las condiciones del cultivo in vitro.
Palabras clave adicionales: Ananas comosus, propagación clonal, reguladores de crecimiento, clon, estructura foliar
Organogenesis in vitro in pineapple Red Spanish and foliar morpho-anatomy of plants obtained in the process
ABSTRACT
The pineapple, Ananas comosus (L.) Merr., is a crop of great commercial importance due to the high demand for its fruit; this has led to the search of new methods of propagation in order to accelerate the production of propagules to plant in the field, and among them, we may mention the in vitro culture of buds that can substantially improve the multiplication protocols. In the present research an organogenesis process for cloning Red Spanish pineapple was developed using sections of plant leaves to establish the propagation system. To check the organogenic nature of the process, it was conducted anatomical and histological analysis of the plant material growing in vitro. Moreover, it was also evaluated the existence of possible morpho-anatomical variations in leaf structure of the clonal population obtained by the organogenesis process. The results showed direct rhizogenesis, and shoot formation via callus in the medium containing 2.5 mg·L-1 of 2.4-D, while formation of roots and shoots via indirect organogenesis was found in the medium containing 5 mg·L-1 of ANA and 0.25 mg·L-1 BA. All the plants were successfully acclimatized. On the other hand, the morphological and anatomical changes observed in vitroplants were reversed during the acclimatization and subsequent nursery conditions. Consequently, it can be consider that they are temporary phenotypic changes as a result of the in vitro culture conditions.
Additional keywords: Ananas comosus, clonal propagation, growth regulators, clone, leaf structure
Recibido: Febrero 5, 2012 Aceptado: Septiembre 3, 2012
INTRODUCCIÓN
En Venezuela, la piña se cultiva en los estados Táchira, Mérida, Trujillo, Lara, Monagas, Anzoátegui, Sucre y los márgenes del río Orinoco en el estado Amazonas, siendo la Española Roja la variedad de piña que ha sido más cultivada (Leal y Antoni 1981a, b). Constituye uno de los frutos autóctonos que ha mantenido su aceptación y conservado su cultivo, compitiendo con otras frutas exóticas. En el país, la piña para 2010 era el cuarto rubro vegetal en importancia después de la caña de azúcar, el maíz y el banano. A nivel mundial, actualmente Venezuela ocupa el puesto número 13 entre los principales países productores, con una producción anual de 371.410 toneladas métricas (FAO, 2010).
La piña es un cultivo de gran importancia comercial y consumo en nuestro país por la demanda de su fruto, lo que ha conducido la búsqueda de nuevos métodos de propagación, que permitan acelerar la producción de propágulos para la siembra en el campo, entre los cuales cabe señalar el cultivo in vitro de yemas que permite mejorar sustancialmente el proceso de multiplicación.
Desde finales de la década de los años 80 se han realizado interesantes trabajos de propagación in vitro de la piña basados en la ruptura de la latencia de yemas apicales y laterales pre-existentes, y el efecto del balance auxina- citocinina sobre la brotación de esas yemas. En este aspecto se pueden mencionar los trabajos de: Casale y García (1987) quienes estudiaron las variedades Española Roja, Brecheche y Nacional, y Saucedo et al. (2008) quienes trabajaron con las variedades Hawaiana y Champaka, ambos grupos lograron la supresión de latencia de yemas axilares de plantas adultas, utilizando los mismos reguladores de crecimiento en una proporción de 4:1 auxina: citocinina. Otros investigadores encontraron que algunas variedades como la Queen Australia requerían para la brotación concentraciones de citocininas 100 veces mayor que la de auxinas (Mogollón et al., 2004). También se han obtenido altas tasas de multiplicación de brotes de piña Española Roja, utilizando concentraciones iguales de auxinas y citocininas (García et al., 2008) pero usando un sistema de inmersión temporal. Recientemente Blanco et al. (2011), trabajando con variedades autóctonas del Amazonas venezolano resaltaron la importancia de la concentración de tiamina y el pH del medio de cultivo para el proceso de la ruptura de la latencia de las yemas.
En el presente trabajo se presentan los resultados de una investigación que tuvo como objetivos: a) Inducción del proceso de organogénesis in vitro para la clonación de plantas de la variedad Española Roja mediante el cultivo in vitro de secciones de hojas de vitroplantas. b) Análisis morfológico e histológico de los eventos morfogénicos. c) Caracterización morfoanatómica de hojas de las plantas madres y de las plantas regeneradas, para determinar la existencia de posibles variaciones estructurales presentes en las hojas de la población clonal, obtenida mediante el proceso organogénico.
MATERIALES Y MÉTODOS
Para el establecimiento de los cultivos e inducción a la organogénesis los explantes empleados fueron segmentos de bases de hojas de aproximadamente 5 mm2 provenientes de vitroplantas de piña Española Roja mantenidas durante 8 meses en condiciones in vitro.
Los medios de cultivo utilizados estuvieron constituidos por las sales de Murashige y Skoog, 1962 (MS), suplementados con 0,4 mg·L-1 de tiamina, 100 mg·L-1 de mioinositol y 30 g·L-1 de sacarosa. El pH de los medios fue ajustado a 5,8 con NaOH, se añadieron 8 g·L-1de agar como agente gelificante. Se probaron diferentes concentraciones de reguladores de crecimiento detallados en el Cuadro 1. Se emplearon 50 explantes por tratamiento.
Cuadro 1. Reguladores de crecimiento utilizados para la inducción de organogénesis en piña Española Roja
| Medio de cultivo | Reguladores de crecimiento | ||
| ANA (mg·L-1) | BA (mg·L-1) | 2,4-D (mg·L-1) | |
| MS1 | - | - | - |
| MS2 | 5 | 0,25 | - |
| MS3 | - | - | 2,5 |
MS1 (medio control); MS2 (medio de Roostika y Marisma, 2003); MS3 (medio propuesto por los autores)
Para la aclimatación de las plantas regeneradas, el material fue incubado en una cámara de crecimiento a una temperatura de 25 ± 1 ºC, en total oscuridad durante un mes para lograr la inducción del callo. Posteriormente, durante las etapas siguientes del proceso de formación de brotes, los cultivos fueron transferidos a condiciones de luz fluorescente continua (50 µmol·m-2·s-1) y temperatura de 27 ± 1 ºC, un período mayor a siete meses.
Se colocaron 30 plantas obtenidas por organogénesis, con una altura aproximada de 6 cm en un sustrato conformado por tierra negra y arena lavada en una proporción 1:1 y se colocaron durante 15 días en propagadores con alta humedad (80-93 % de humedad relativa) y baja luminosidad (10 µmol·m-2·s-1, densidad de flujo fotónico fotosintético. Luego las plantas fueron transferidas a condiciones de vivero.
El análisis estadístico de los datos se realizó a través del análisis de varianza y prueba de Duncan utilizando el programa Statistica versión 5.5.
También se realizó el cálculo del Índice de Formación de Brotes (IFB) para ambas variedades mediante la siguiente fórmula:
![]()
Análisis morfológico e histológico de los eventos morfogénicos: La naturaleza del proceso de regeneración in vitro, se estudió mediante el análisis de cortes histológicos del material vegetal, para así comprobar la naturaleza organogénica del proceso y determinar si dicho proceso ocurrió de forma directa o indirecta. Para ello se realizaron cortes a mano alzada del material vegetal de muestras tomadas cada 15 días desde que se inicia el cultivo hasta los 2 meses y medio, tiempo en el cual generalmente comienza la aparición de los meristemoides, y luego cada 7 días hasta la formación y desarrollo de los brotes. Los cortes fueron coloreados con Azul de toluidina en solución acuosa al 1 % y fijado en glicerina al 50 %, siguiendo el protocolo de Roth (1964).
Caracterización morfoanatómica de hojas de las plantas madres y de las plantas regeneradas
Para evaluar posibles cambios en la morfoanatomía de las hojas de las plantas hijas obtenidas por organogénesis in vitro se realizó un estudio morfológico y un estudio anatómico comparativo en las hojas de plantas madres mantenidas en vivero (a los 12 meses de cultivo), las plantas madres obtenidas por inducción de yemas pre-existentes in vitro, y mantenidas in vitro (8 meses de cultivo), las plantas hijas obtenidas por organogénesis y mantenidas in vitro (8 meses de cultivo) y las plantas hijas obtenidas por organogénesis y mantenidas ex vitro (8 meses de cultivo), donde algunas diferencias se definieron por presencia o ausencia de las diversas estructuras. Para ello se tomó aleatoriamente una hoja de tres plantas, creciendo en cada una de las condiciones de cultivo. Se desprendieron hojas ubicadas en la parte media de las plantas por presentar tejidos maduros (no juveniles ni senescentes), el material se lavó con agua corriente y de él se tomaron porciones correspondientes al tercio medio de la lámina, las cuales se fijaron en etanol al 70 %. Posteriormente se efectuaron secciones transversales a mano alzada, de aproximadamente 10 cortes por hoja por planta y se verificó en la totalidad de éstos la homogeneidad de las características observadas. La morfología externa fue observada en un microscopio estereoscópico, mientras que los cortes anatómicos lo fueron a través de un microscopio óptico estándar y un microscopio óptico con luz polarizada; se tomaron fotografías, en cada caso, con una cámara digital acoplada a los mismos. El cálculo del aumento total de las fotografías fue realizado mediante la multiplicación del aumento del objetivo, por el aumento del ocular y el zoom de la cámara.
RESULTADOS Y DISCUSIÓN
Inducción del callo y de la organogénesis in vitro. Se observó respuesta hacia la formación de callo en los medios donde se adicionaron reguladores de crecimiento (MS2 y MS3). Al mes de cultivo, se apreció un callo granular de consistencia friable y coloración de amarillenta a marrón hacia los extremos del explante. A los tres meses de cultivo, se obtuvo un 74 % de explantes con callo en el medio MS2 y un 38 % en el medio MS3 (Cuadro 2). Al séptimo mes de cultivo, el porcentaje de explantes con callo era de 84 % en el medio MS2 y 76 % en el MS3. Amin et al. (2005), también reportan inducción de callogénesis en A. comosus cv. Giant Kew a partir de bases de hojas a la cuarta semana de cultivo, pero en un medio MS con 2,0 mg·L-1 de 2,4-D (no usan ANA) y 2,0 mg·L-1 de BA, logrando un máximo de 95 % de callo formado. Un mejor tiempo de respuesta fue el reportado por Sripaoraya et al. (2003) quienes indican la formación de callos a los 14 días de cultivo a partir de bases de hojas de piña cv. Phuket, en medio MS suplementado con 2,4-D y BA pero en concentraciones diferentes (0,5 y 2,0 mg·L-1, respectivamente).
Análisis morfológico e histológico de los eventos morfogénicos. A los tres meses de cultivo los callos formados comenzaron a mostrar meristemoides o regiones localizadas de células en división activa, los cuales se asemejan a meristemas verdaderos. Estas zonas se encontraban en el interior del callo y estaban compuestas por células pequeñas, isodiamétricas, con citoplasma denso, vacuolas pequeñas y núcleos prominentes. Los meristemoides son los centros de origen de brotes en algunos casos, o de raíces en otros, dependiendo del balance hormonal inducido en el tejido.
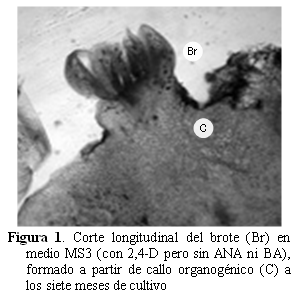
En la Figura 1 se observa el corte transversal de un brote formado en el medio MS3 a partir de callo organogénico y en otras secciones del tejido (no publicadas), pudimos observar la conexión vascular entre el brote neoformado y el tejido del callo que le dio origen. Un proceso similar se observó en los brotes formados en medio MS2.
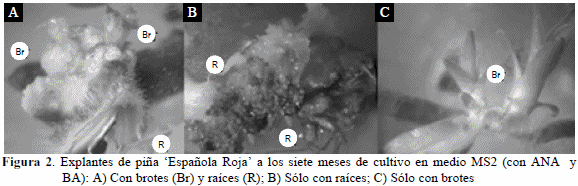
Es interesante destacar que en la etapa de regeneración, pudo apreciarse la formación de raíces y brotes en un mismo explante (Figura 2A) y en otros explantes ocurrió la formación solamente de raíces (Figura 2B) o brotes (Figura 2C).
Aproximadamente a los 4 meses se obtuvieron los primeros brotes en ambos medios, siendo de mayor tamaño los brotes obtenidos en el medio de cultivo MS2 (con BA) en un mismo lapso de tiempo. En este medio se obtuvieron 2,92 brotes por explante, valor mayor que el 0,67 brotes por explante obtenido en el medio MS3 (sin BA). Con respecto a las raíces, en MS2 se obtuvo un promedio por explante de 0,32 raíces mientras que en MS3 el promedio fue de sólo 0,08 raíces. El promedio de brotes por explante en ambos medios de cultivo (MS2 y MS3) fue mayor al promedio de raíces por explante (Cuadro 2).
Cuadro 2. Efecto del medio de cultivo sobre el proceso de organogénesis en segmentos de bases de hojas de piña Española Roja a los tres y siete meses de cultivo
| Medio de cultivo | Formación de callo (%) | Promedio de raíces por explante | Promedio de brotes por explante | Índice de formación de brotes |
| Tres meses de cultivo | ||||
| MS1 | 0 | 0 | 0 | 0 |
| MS2 | 74 | 0,32 | 2,92 | 2,29 |
| MS3 | 38 | 0,08 | 0,67 | 0,49 |
| Siete meses de cultivo | ||||
| MS1 | 0 | 0 | 0 | 0 |
| MS2 | 84 a | 1,34 a | 4,7 a | 3,85 |
| MS3 | 76 a | 0,46 a | 0,98 b | 0,71 |
MS1, MS2 y MS3 según el Cuadro 1. Medias con letras distintas en una variable indican diferencias significativas según la prueba de Duncan (P≤0,05)
Los brotes en general eran de color verde y a los 15 días de cultivo, tenían una tamaño promedio de 2 mm en ambos medios (Figura 3A), a los 7 meses los brotes en el medio MS2, alcanzaron una altura máxima de aproximadamente 8 cm (Figura 3B), mientras que los brotes en el medio MS3, alcanzaron una altura máxima de 6,7 cm.
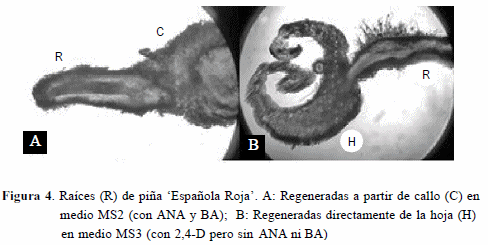
En relación a la formación de raíces, la Figura 4A muestra la formación de raíces a partir de callos, provenientes de explantes de hojas de la piña Española Roja cultivados en el medio MS2, mientras que la Figura 4B, corresponde a la formación de una raíz en la superficie del explante foliar, sin la formación de callo, en el medio de cultivo MS3.
A los 7 meses de cultivo, en el medio MS2 se obtuvo un promedio de 1,34 raíces por explante y un promedio de 4,7 brotes por explante. En el análisis estadístico se encontraron diferencias significativas entre los dos tratamientos aplicados (MS2 y MS3) con respecto a la formación de brotes, mientras que no hubo diferencias significativas entre ambos medios de cultivo para la formación de raíces (Cuadro 2).
Estos resultados son comparables a los citados por Almeida et al. (1997) quienes trabajaron con el híbrido PExSC-52 y el cv. Cayena Lisa, y reportaron que con 2 mg·L-1 de BA se obtiene la proliferación de brotes en el híbrido y que la combinación de la misma concentración de BA con 2 mg·L-1 era necesaria en Cayena Lisa. Firoozabady y Gutterson en el 2003 también obtuvieron brotes de piña in vitro vía organogénesis, utilizando la misma combinación hormonal pero en diferente concentración (1,5 mg·L-1 de BA y 0,5 mg·L-1 de ANA) en medio MS. Igualmente, Sripaoraya et al. (2003) obtuvieron brotes a partir de bases de hojas cultivadas en medio MS suplementado con la combinación de 0,5 mg·L-1 de 2,4-D y 2,0 mg·L-1 de BA.
Amin et al. (2005) usando un medio MS suplementado con una combinación de auxinas y citocininas (0,1 mg·L-1 de ANA y 1,0 mg·L-1 de BA), regeneraron brotes de piña obtenidos a partir de callo organogénico logrando un promedio de 18,55 brotes por explante a las seis semanas de cultivo.
El 2,4-D es una auxina empleada usualmente en la inducción de la embriogénesis somática, sin embargo la presente investigación arrojó resultados hacia la inducción de la génesis de órganos, produciendo la formación de brotes mediante organogénesis indirecta y de raíces mediante organogénesis directa. Sin embargo, a pesar de que se logró la inducción de la organogénesis en este medio (MS3), los resultados obtenidos en relación a producción de brotes son inferiores (0,67 brotes por explante). En relación a los valores alcanzados en el medio MS2 (4,7 brotes por explante), el medio de cultivo MS2 resultó ser más eficiente en la producción de brotes y raíces.
Roostika y Mariska (2003) establecieron un sistema de organogénesis en piña empleando yemas apicales cultivadas en un medio MS suplementado con 5 mg·L-1 de ANA y 0,25 mg·L-1 de BA (igual al medio MS2 empleado en esta investigación), obteniendo un 99 % de brotes vía organogénesis directa y un 86 % de brotes vía organogénesis indirecta. A diferencia de ellos en la presente investigación no se observó diferenciación directa de brotes mediante organogénesis, y esto puede deberse a la diferencia de los explantes utilizados, ellos utilizaron yemas apicales, tejidos menos diferenciados que las bases de hojas, usadas como explantes en esta investigación.
Aclimatación de las plantas regeneradas. Al final de los 3 meses que duró el período de aclimatación, del total de 30 plantas que fueron transferidas a un sustrato compuesto con tierra negra y arena lavada en proporción 1:1, y mantenidas en los propagadores, se obtuvo un 100 % de supervivencia, alcanzando medidas entre 9 y 15 cm de altura (Figura 5). Este resultado es similar al obtenido por García et al. (2008) quienes observaron un 100 % de supervivencia de plantas micropropagadas de piña Española Roja, empleando un sustrato con igual composición que el usado en la presente investigación.
Por otra parte, Dal Vesco et al. (2001), realizaron trabajos en plantas micropropagadas in vitro de piña cv. Pérola, evaluando diferentes factores tales como el tamaño de las plantas a aclimatar y la composición del sustrato (compost orgánico y arena en proporción 5:1), encontrando que independientemente del sustrato empleado, la tasa más alta de supervivencia (93,8 %) se obtuvo cuando los brotes aclimatados eran de más de 7 cm de altura, lo cual es una medida similar a los 6 cm de altura promedio con los cuales se realizó la transferencia a tierra de las plantas aclimatadas en la presente investigación.
En estudios realizados por Moreira et al. (2006) en plantas micropropagadas de piña Pérola, se indica la obtención de mejores resultados empleando tres tipos de sustratos: compost orgánico, una combinación de 50 % de tierra negra y 50 % de estiércol bovino y una combinación de 40 % de tierra negra, 30 % de estiércol bovino y 30 % de Plantmax (turba negra comercial cribada y tratada), obteniendo un 95 % de supervivencia en los tres casos reportados. Sin embargo, en la aclimatación realizada en esta investigación, se obtuvieron resultados superiores para la piña Española Roja (100 % de supervivencia), sin emplear compuestos adicionales, lo cual encarecería el costo de producción de las plantas.
Caracterización morfoanatómica de hojas de las plantas madres y de las plantas regeneradas
En el estudio morfoanatómico comparativo de las hojas de las plantas madres y de las plantas regeneradas se lograron observar algunas diferencias importantes, sobre todo con la planta madre ex vitro (Cuadro 3 y Figura 6 A,B,C,D). Por ejemplo, la hoja de la planta madre ex vitro mantenida en vivero fue la única que presentó antocianinas (Figura 6A) y hubo ausencia de espinas en la planta hija in vitro obtenida por organogénesis (Figura 6D).
Cuadro 3. Caracterización morfoanatómica de hojas de plantas madre e hija de piña Española Roja
| Características morfológicas y anatómicas | Planta madre | Planta hija | ||
| Ex vitro | In vitro obtenida por inducción de yemas | Ex vitro obtenida por organogénesis | In vitro obtenida por organogénesis | |
| Coloración de la hoja | Rojiza | Verde | Verde | Verde |
| Margen espinoso | Presencia | Presencia | Presencia | Ausencia |
| Cutícula | Gruesa | Delgada | Delgada | Delgada |
| Presencia de escamas peltadas | Presencia | Presencia | Presencia | Presencia |
| Cristales tipo rafidio | Presencia | Presencia | Presencia | Presencia |
| Líneas de paquetes de fibras | Dos líneas | Una línea | Una línea | Una línea |
| Aerénquima | Presencia | Ausencia | Ausencia | Ausencia |
| Hipodermis mecánica | Presencia | Ausencia | Ausencia | Ausencia |
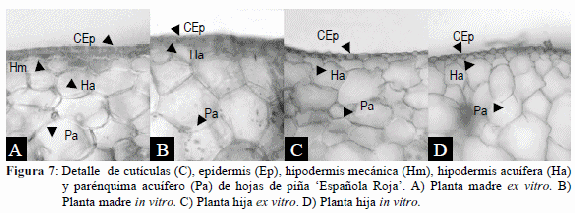
La Figura 7 muestra detalles de la cutícula, epidermis, hipodermis mecánica, hipodermis acuífera y parénquima acuífero, de las hojas de plantas en las diferentes condiciones de cultivo. En las hojas de plantas cultivadas y mantenidas in vitro (madres e hijas) (Figura 7 B,D), se pudo observar una cutícula poco desarrollada, en comparación con las hojas de las plantas madres mantenidas ex vitro (Figura 7 A,C). En las secciones transversales de la lámina foliar de las plantas mantenidas in vitro, se observó una hipodermis acuífera y un parénquima acuífero, constituido por células redondeadas de menor tamaño y menor número de capas que las de las plantas ex vitro. Por otra parte, la hipodermis mecánica, está presente únicamente en la planta madre ex vitro. En plantas mantenidas in vitro de Ananas comosus cv. Perola, también se reporta la presencia de una hipodermis y parénquima acuífero menos pronunciado (Santa Cruz et al., 2006).
Se podría sugerir que la presencia de hipodermis y parénquima acuífero, es un carácter fijado genéticamente y muestra plasticidad fenotípica en el número de capas y tipos celulares. Es posible que el poco desarrollo de los mismos en las plantas in vitro, en comparación con las plantas madres, sea efecto de las condiciones de iluminación controladas y humedad alta. Sin embargo, la presencia, aunque en menor proporción, de hipodermis y parénquima acuífero en las hojas de las plantas cultivadas in vitro, parece estar facilitando e incrementando la supervivencia de dichas plantas, cuando son transferidas a las condiciones de vivero.
En la Figura 8A se observa la hoja de la planta madre de la piña Española Roja mantenida en vivero, mostrando una línea de haces vasculares, acompañados por dos líneas paquetes de fibras, ubicados uno a cada lado del mesófilo, mientras que en las hojas de la hija ex vitro y las de las otras dos condiciones, sólo se observó una línea de haces vasculares principales y una de paquetes de fibras, a cada lado del mesófilo (Figura 8B).
En las secciones transversales de la lámina foliar de plantas micropropagadas de piña cultivadas in vitro y en el vivero, se pudo observar que éstas presentaron un mesófilo homogéneo, sin diferenciación en empalizada y esponjoso (Figura 8), contrariamente al mesófilo dorsiventral, reportado por Santa Cruz et al. (2006) para otras especies. En las dos condiciones de cultivo, la lámina foliar presentó un parénquima acuífero constituido por células grandes redondeadas, con paredes delgadas, planas o con leves ondulaciones. Pacheco et al. (2008) reportan que existe en el mesófilo una diferenciación entre parénquima de empalizada y esponjoso para Ananas comosus var. Erectifolius.
En las hojas de las plantas madres de piña del presente estudio, los paquetes de fibras extravasculares en conjunto con la epidermis, hipodermis mecánica y casquetes de fibras perivasculares, aumentan la rigidez foliar, ofreciendo un sostén mecánico, posiblemente como agente de protección del mesófilo durante condiciones de estrés térmico e hídrico (Krauss, 1949; Pyykkö, 1966; Brighigna et al., 1984). Se puede sugerir que la reducción de las fibras extra y perivasculares, es explicado por las condiciones de cultivo: alta humedad ambiental y baja intensidad de luz a las que están sometidas las plantas de piña cultivadas in vitro. Estas plantas mantenidas in vitro, mostraron alteraciones anatómicas como: reducción del engrosamiento de paredes de las células que intervienen en el sostén de la planta, presencia de tricomas glandulares, cutícula no distinguible, ausencia de acanalamiento en la epidermis inferior, reducción de las capas de hipodermis acuífera y ausencia de aerénquima. Santa Cruz et al. (2006) también reportan ausencia de aerénquima en hojas de piña mantenidas in vitro. Aparentemente, las plantas de piña in vitro, no requieren de las ventajas que ofrece el aerénquima como la flexibilidad y mayor circulación de aire en la lámina foliar, como fue sugerido por Mauseth (1988) para plantas crecidas en campo.
En la Figura 9 se observa un corte transversal de las hojas de la planta madre de la piña Española Roja, en el cual se observaron cavidades aeríferas (aerénquima), ubicadas entre los haces vasculares, lo cual no se observó en ninguna de las otras hojas estudiadas.
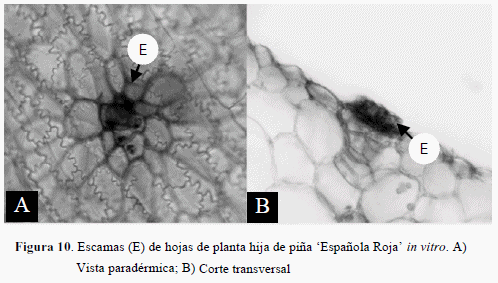
La Figura 10 A,B muestra escamas peltadas multicelulares en la cara adaxial de la epidermis de las plantas creciendo en condiciones in vitro, esto se observó también en las plantas ex vitro.
Según Tomlinson (1969) las escamas peltadas representan una variación natural distintiva para la familia Bromeliaceae.
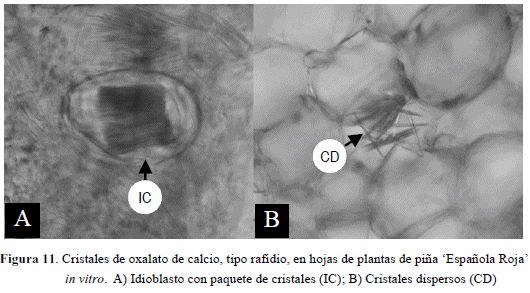
En la Figura 11 A,B se muestran cristales de oxalato de calcio tipo rafidio, en las hojas de plantas de piña estudiadas, los cuales se encuentran con frecuencia en la hipodermis acuífera.
Proença y Sajo (2007) reportan idioblastos que contienen cristales de oxalato de calcio, tipo rafidio, los cuales fueron encontrados en la hipodermis acuífera. Estos cristales son particularmente abundantes en las hojas de las plantas cultivadas in vitro y esto puede corresponderse a la composición del medio de cultivo, el cual es rico en minerales como el calcio. Tomlinson, (1969); Sousa et al. (2005), Proença y Sajo (2007) reportan que dichos cristales pueden tener carácter diagnóstico para la familia Bromeliaceae.
Es bastante conocido que el fenotipo de las plantas que crecen en condiciones in vitro está caracterizado por presentar, respecto a aquellas desarrolladas en ambientes ex vitro; tallos más delgados, menor cantidad de ceras cuticulares y epicuticulares, reducción de tejidos mecánicos de soporte, incremento de contenido de agua en las células, escasa capacidad fotosintética, estomas con baja funcionalidad y crecimiento heterótrofo o mixótropo, lo cual indica que los cambios fenotípicos son inducidos por las condiciones de cultivo, es decir, como respuesta a la ausencia de factores estresantes que si se presentan en los viveros y en el campo (Agramonte et al., 1998; Hazarika, 2006).
En consecuencia, se quiere resaltar que las características antes mencionadas, se presentaron en todas las plantas cultivadas y mantenidas in vitro, sin embargo, las mismas se revirtieron al realizar la aclimatación. Esto sugiere que las plantas presentaron plasticidad fenotípica y que dichas diferencias corresponden a cambios inducidos por las condiciones del cultivo in vitro y no por el proceso de regeneración al cual fueron sometidas.
CONCLUSIONES
En la piña Española Roja se observó la formación de raíces y/o brotes en los explantes colocados en los medios para inducción de callo, sin necesidad de transferirlos a un medio de inducción de brotes. En el medio de cultivo MS2 (5 mg·L-1 ANA y 0,25 mg·L-1 BA) se observó la formación de raíces y vástagos vía organogénesis indirecta y en el medio MS3 (2,5 mg·L-1 2,4-D) se produjo rizogénesis directa y formación de brotes mediante organogénesis indirecta.
En esta investigación se obtuvo un 100 % de plantas aclimatadas, empleando para ello, un sustrato compuesto con tierra negra y arena lavada, en proporción 1:1.
El patrón anatómico foliar observado es el típico de la familia Bromeliaceae. Entre los haces vasculares, se observan canales de aerénquima y paquetes de fibras extravasculares, ausentes en las vitroplantas.
Los caracteres morfoanatómicos foliares que exhibieron alteraciones en las plantas de piña obtenidas in vitro se revirtieron en el proceso de aclimatación y posteriormente al pasarlas a condiciones de vivero. En consecuencia, parecen ser cambios fenotípicos temporales, producto de las condiciones del cultivo in vitro y no del proceso de regeneración al cual fueron sometidas.
El análisis morfoanatómico foliar es una herramienta que permitió evaluar los efectos de las condiciones del cultivo in vitro sobre las plantas de piña micropropagadas.
LITERATURA CITADA
1. Agramonte, D., F. Jiménez y M. Dita. 1998. Aclimatización. In: J. N. Pérez Ponce (ed.). Propagación y mejora genética de plantas por biotecnología. Instituto de Biotecnología de las Plantas, Cuba, 193- 206. [ Links ]
2. Almeida, W., A. Matos y A. Sousa. 1997. Effects of benzylaminopurine (BAP) on in vitro proliferation of pineapple (Ananas comosus (L.) Merr) Acta Hort. (ISHS) 425: 235-242. [ Links ]
3. Amin, M., M. Rahman, K. Rahman, R. Ahmed, M. Hossain y M. Ahmed. 2005. Large scale plant regeneration in vitro from leaf derived callus cultures of pineapple (Ananas comosus (L.) Merr. cv. GiantKew). Intl. J. Bot. 1: 128-132. [ Links ]
4. Blanco, H., T. Vargas y E. de García. 2011. Micropropagación clonal de tres variedades de piña nativas de la región amazónica, mediante cultivo de yemas axilares y apicales. Interciencia 36(6): 437-443. [ Links ]
5. Brighigna, L., A.C. Fiordi y M.R. Palandri. 1984. Structural characteristics of mesophyll in some Tillandsia species. Phytomorphology 34: 191-200. [ Links ]
6. Casale, I. y E. de García. 1987. Multiplicación clonal acelerada de tres variedades de piña. ACEVIV Colombia. (2): 3-18. [ Links ]
7. Dal Vesco, L., A. de Almeida, G. Zaffari, R. Onofre, M. Dos Reis y M. Guerra. 2001. Improving pineapple micropropagation protocol through explant size and medium composition manipulation. Fruits 56: 143-154. [ Links ]
8. FAO, 2010. Documento electrónico: http://faostat.fao.org/site/339/default.aspx. Revisión del 03/09/2012. [ Links ]
9. Firoozabady, E. y N. Gutterson. 2003. Cost-effective in vitro propagation methods for pineapple. Plant Cell. Rep. 21: 844-850. [ Links ]
10. García, E. de, Garay, A., Vargas, T. y Blanco, H. 2008. Micropropagación clonal masiva de piña (Anana scomosus). Memorias del Instituto de Biología Experimental (MIBE) UCV. 5: 181-184. [ Links ]
11. Hazarika, B.N. 2006. Morpho-physiological disorders in in vitro culture of plants. Scientia Hort. 108: 105-120. [ Links ]
12. Krauss, B.H. 1949. Anatomy of the vegetative organs of the pineapple Ananas comosus (L.) Merr. II - The leaf. Botanical Gazette 110: 333-404. [ Links ]
13. Leal, F. y M. Antoni. 1981a. Clave para la identificación de las variedades comerciales de piña (Ananas comosus). Rev. Fac. Agron. UCV 29: 13-24. [ Links ]
14. Leal, F. y M. Antoni. 1981b. descripción y clave de las variedades de piña cultivada en Venezuela. Rev. Fac. Agron. UCV 29: 51-79. [ Links ]
15. Mauseth, J.D. 1988. Plant Anatomy. Benjamin/Cummings Pub. Menlo Park, CA. [ Links ]
16. Mogollón, N., J. Díaz y N. Hernández. 2004. Multiplicación clonal y enraizamiento in vitro de Ananas comosus L. Queen Australia. Rev. Fac. Agron. (LUZ) 21 Supl. 1: 15-21. [ Links ]
17. Moreira, M., J. Guedes, M. Pasqual, C. Borges y A. Bortolotti. 2006. Efeito de substratos na aclimatização de mudas micropropagadas de Abacaxizeiro cv. Pérola. Ciênc. Agrotec., Lavras. 30: 875-879. [ Links ]
18. Murashige, T. y F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant.15: 473-479. [ Links ]
19. Pacheco, E., O. Alves, F. Borges y R. Ferreira. 2008. Estructura foliar de Curauá em diferentes intensidades de radiação fotosinteticamente activa. Pesq. Agropec. Bras. 43: 163-169. [ Links ]
20. Proença, S. y M. Sajo. 2007. Anatomia foliar de Bromélias ocorrentes em áreas de Cerrado do Estado de São Paulo, Brasil. Acta Bot. Bras. 21: 657-673. [ Links ]
21. Pyykkö, M. 1966. The leaf anatomy of East Patagonian xeromorfic plants. Annales Botanici Fenici 3: 453-622. [ Links ]
22. Roostika, I. y I. Mariska. 2003. In vitro culture of pineapple by organogenesis and somatic embryogenesis: its utilization and prospect. Buletin AgroBio 6: 34-40. [ Links ]
23. Roth, I. 1964. Microtecnia Vegetal. Ediciones UCV. Imprenta Universitaria, Universidad Central de Venezuela, Caracas. 96 p. [ Links ]
24. Santa Cruz, S., D. Graciano-Ribeiro, J. Batista, T. Aquino, y L. Copati, 2006. Anatomia foliar de plantas micropropagadas de Abacaxi. Pesq. Agrop. Brasil 41: 185-194. [ Links ]
25. Saucedo, S.G., E.L. Ramos, E. Varas y F. Carmigniani. 2008. Propagación clonal in vitro de piña (Ananas comosus L. Merr) variedades Champaka y Hawaiana. Cienc. y Tecn. 1: 49-54. [ Links ]
26. Sousa, G.M., M.E. Estelita y M.G. Wanderley. 2005. Anatomía foliar de especies brasileras de Aechmea subg. Chevaliera (gaudich. ex Beer) Baker, Bromelioidae-Bromeliaceae. Revista Brasileira de Botánica 28: 603-613. [ Links ]
27. Sripaoraya, S., R. Marchant, P. Brian y M. Davey. 2003. Plant regeneration by somatic embryogenesis and organogenesis in commercial pineapple (Ananas comosus L.). In vitro Cell. Dev. Biol.-Planta 39: 450-454. [ Links ]
28. Tomlinson, P.B. 1969. Commelinales-Zingiberales. In: C.R. Metcalfe (ed.). Anatomy of the Monocotyledons: III. Clarendon Press. Oxford. pp. 193-294. [ Links ]