Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro vol.27 no.3 Barquisimeto dic. 2015
Análisis genético, mediante marcadores RAPD, de microbulbos de ajo conservados e irradiados in vitro
Adriana Pardo1, Alexander Hernández2, Naileth Méndez2 y Geine Alvarado2
1 Dpto. de Genética, Decanato de Agronomía, Universidad Centroccidental Lisandro Alvarado.
2 Postgrados de Agronomía, Decanato de Agronomía, Universidad Centroccidental Lisandro Alvarado.Apdo. 400. Barquisimeto. Venezuela. e-mail: apardo@ucla.edu.ve; ahernandez@ucla.edu.ve; naileth@gmail.com; geinealvarado@gmail.com
RESUMEN
Debido a su condición apomíctica el ajo se reproduce de manera vegetativa, estando su mejoramiento genético limitado a la selección clonal y a la búsqueda de variabilidad por procedimientos como variación somaclonal o mutagénesis inducida. Una vez obtenidos los clones o mutantes con características deseables se debe considerar su mantenimiento o preservación en bancos de germoplasma. Por lo antes señalado, se planteó analizar mediante la técnica RAPD, la estabilidad genética en microbulbos del clon Boconó conservados in vitro así como la presencia de variaciones genéticas en aquellos materiales irradiados con gamma. Durante la conservación, los microbulbos fueron almacenados en cinco medios: T1= MS + 45 g·L-1 de sacarosa, T2= ½ MS + 45 g·L-1 de sacarosa, T3= ½ MS, T4= ¼ MS + 45 g·L-1 de sacarosa y T5= ¼ MS. Para el tratamiento mutagénico, los microbulbos fueron irradiados con dosis de 0, 6, 8 y 10 krad. De los 12 iniciadores utilizados, 10 y 9 de ellos generaron un total de 62 y 71 bandas polimórficas en los experimentos de conservación y mutagénesis, respectivamente. Los resultados indicaron que los medios ¼ MS y ½ MS, ambos con sacarosa, permitieron la conservación de microbulbos estables o fieles al tipo por un período de 210 días; mientras que la irradiación con 8 o 10 krad, propició la inducción de cambios o variaciones genéticas en los microbulbos de ajo.
Palabras clave adicionales: Cultivo de tejidos, crecimiento mínimo, microbulbificación, radiación gamma
Genetic analysis using RAPD markers of in vitro conserved and irradiated garlic microbulbs
ABSTRACT
Due to apomictic condition, garlic shows a vegetative reproduction, thus genetic breeding is limited to clonal selection and search for variability by procedures such as somaclonal variation or induced mutagenesis. After clone or mutant with desired characteristics is obtained, maintenance or preservation in germoplasm banks should be considered. In this regard, analyses by RAPD technique was made for evaluating genetic stability in garlic microbulbs clone Boconó conserved in vitro or to detect presence of genetic variations in materials irradiated with gamma. During conservation, microbulbs were stored in five media: T1 = MS + sucrose 45 g·L-1, T2 = ½ MS + sucrose 45 g·L-1, T3 = ½ MS, T4 = ¼ MS + sucrose 45 g·L-1 and T5 = ¼ MS. Mutagenic treatments consisted in irradiance of microbulbs with gamma at 0, 6, 8 and 10 krad. Out of 12 primers used, 10 and 9 yield 62 and 71 polymorphic bands in treatments related to conservation and mutagenesis, respectively. Results showed that ¼ MS and ½ MS medium, both with sucrose, can be used to conserve microbulbs with genetic stability for 210 days, while the application of 8 or 10 krad gamma rays promoted changes or genetic variations in the garlic microbulbs.
Additional key words: Gamma radiation, microbulbification, minimum growth, tissue culture
Recibido: Marzo 3, 2015 Aceptado: Septiembre 25, 2015
INTRODUCCIÓN
El ajo (Allium sativum L.) especie diploide (2n=16) perteneciente a la familia Alliaceae, ha sido ampliamente cultivado y utilizado a nivel mundial desde tiempos antiguos, principalmente por sus cualidades culinarias y medicinales (Paredes et al., 2008; Alam et al., 2012). Debido a su condición apomíctica y por ende, escasa producción de semilla botánica, esta especie se reproduce exclusivamente de manera vegetativa, estando su mejoramiento genético limitado a la selección clonal y a la búsqueda de variabilidad genética a través de la selección de mutantes espontáneos que expresen características deseables, o bien a partir de nuevos genotipos generados por variación somaclonal y/o la aplicación de mutágenos (Buso et al., 2008; Hyun et al., 2012; Vatsyayan et al., 2013; Pardo et al., 2015). Asimismo, una vez obtenidos los genotipos o clones de alta calidad, se debe considerar su mantenimiento o preservación, por lo que es frecuente que los clones comúnmente cultivados a nivel mundial sean conservados en bancos de germoplasma. Para el mantenimiento de las colecciones en campo se requiere de tiempo y un gran esfuerzo humano para minimizar las pérdidas por los efectos de factores climáticos adversos y/o el ataque de plagas y enfermedades que aumentan notablemente su costo (Volk et al., 2004; Ipek et al., 2008; Barboza et al., 2012). Al respecto, el cultivo de tejidos constituye una valiosa herramienta para el estudio o la investigación de especies de reproducción vegetativa, ya que facilita la regeneración masiva de plantas fieles al tipo y con ello la producción, conservación in vitro y el mejoramiento de recursos fitogenéticos, así como también la aplicación de mutagénesis in vitro para la producción de nuevas variantes o mutantes con características de interés agrícola (Sánchez y Jiménez, 2009; Bairu et al., 2011).
Cabe destacar, que los marcadores moleculares basados en el ADN, han sido utilizados bien sea para estimar la fidelidad o integridad genética de los bancos de germoplasma (Ipek et al., 2003; Choi et al., 2005), o bien para detectar la presencia de variaciones genéticas en materiales sometidos a un tratamiento mutagénico (Afrasiab y Iqbal, 2012). Específicamente, los marcadores RAPD, han demostrado ser una técnica sensible, económica y fácil de usar, que permiten determinar las variaciones dentro o entre clones (Khar et al., 2008; Abdoli et al., 2009; Pardo et al., 2009).
Entre otras ventajas atribuidas a esta técnica se señalan el gran número de muestras que pueden ser analizadas en forma rápida y económica con pequeñas cantidades de ADN, así como que la amplificación del ADN ocurre independientemente de las expresiones ontogenéticas o de las influencias ambientales (Figliuolo et al., 2001; Wilches, 2004; Buso et al., 2008; Alam et al., 2012). Por lo anteriormente señalado, en la presente investigación se analizó la conservación y estabilidad genética en microbulbos de ajo clon Boconó, conservados in vitro y tratados con radiación gamma, respectivamente, mediante la técnica RAPD.
MATERIALES Y MÉTODOS
Los experimentos se realizaron en el laboratorio de cultivo in vitro de la Unidad de Biotecnología, del Postgrado de Horticultura del Decanato de Agronomía, de la Universidad Centroccidental Lisandro Alvarado (UCLA), en Tarabana, estado Lara, Venezuela. Se utilizaron brotes de ajo, clon Boconó, procedentes del cultivo de ápices caulinares los cuales, para alcanzar la fase de bulbificación, fueron cultivados en el medio de Murashige y Skoog (MS) con 90 g·L-1 de sacarosa + 2 mg·L-1 de 2ip y 8 g·L-1 de agar según lo establecido por Mujica y Mogollón (2004).
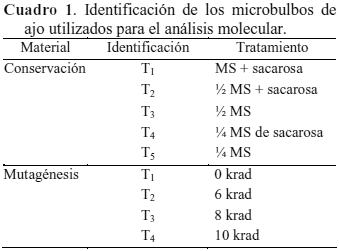
Se evaluó la estabilidad genética de microbulbos que estuvieron conservados (almacenados) durante 210 días o que fueron sometidos mutagénesis in vitro. Para esto, se seleccionaron microbulbos con un peso entre 0,6 y 0,8 g y diámetro ecuatorial comprendido entre los 0,5 a 1 cm.
Conservación in vitro. Los microbulbos fueron almacenados bajo los siguientes cinco medios de cultivo: T1= MS con 45 g·L-1 de sacarosa; T2= ½ MS con 45 g·L-1 de sacarosa; T3= ½ MS; T4= ¼ MS con 45 g·L-1 de sacarosa y T5= ¼ MS, todos con 8 g·L-1 de agar, y 30 repeticiones. Como tratamiento testigo se utilizó el T1 (el cual incluyó sólo la mitad de la sacarosa comúnmente utilizada en la bulbificación) para garantizar un crecimiento mínimo del microbulbo. El protocolo empleado para la conservación bajo condiciones de crecimiento mínimo fue el utilizado por Pardo et al. (2014). El medio MS se preparó manteniendo la concentración total de los componentes: tiamina-HCl (30 mg·L-1), glicina (2 mg·L-1), ácido nicotínico (10 mg·L-1), piridoxina (1 mg·L-1) e inositol (100 mg·L-1); el pH se ajustó a 5,8±0,1. Los microbulbos se cultivaron en tubos de ensayo de 25 x 150 mm con 10 m·L-1 de medio y se mantuvieron durante 210 días, sin subcultivos, en un ambiente controlado en cuarto de crecimiento con temperatura de 25±2 ºC, iluminación de 13,5 mmolm-2s-1 y fotoperíodo de 16 horas de luz y 8 horas de oscuridad.
Mutagénesis in vitro. El estudio se realizó en la Planta de Esterilización por Rayos Gamma (PEGAMMA) del Instituto Venezolano de Investigaciones Científicas (IVIC) ubicado en los Altos de Pipe, estado Miranda, Venezuela. Los microbulbos del clon Boconó, cultivados en tubos de ensayo contentivos de medio MS con 90 g·L-1 de sacarosa + 2 mg·L-1 de 2ip y 8 g·L-1 de agar, fueron irradiados al colocarlos a 75 cm de distancia de la fuente de radiación gamma (60Co). El poder y la velocidad de la fuente fue de 9813 Curie y 195 krad·h-1. De acuerdo con estos valores, se determinaron tiempos de exposición de 1 min 50 seg, 2 min 28 seg y 3 min 4 seg, para las dosis de radiación de 6, 8 y 10 krad, respectivamente, más el testigo o control (0 krad).
Una vez irradiados, los microbulbos se trasfirieron dos veces a medio fresco de bulbificación (dos subcultivos). Se aplicó un diseño completamente al azar con 4 tratamientos (0, 6, 8 y 10 krad), 20 repeticiones y un microbulbo por tubo de ensayo.
Análisis de la estabilidad genética. El estudio se realizó en el laboratorio de Biología Molecular del Postgrado de Agronomía de la UCLA. El Material experimental consistió en microbulbos de ajo, clon Boconó, provenientes de los ensayos de conservación y mutagénesis in vitro arriba mencionados (Cuadro 1).
Se utilizó el protocolo para la obtención de bandas RAPD en A. sativum previamente descrito por Pardo et al. (2009). De acuerdo a esto, se siguieron los pasos correspondientes a la extracción de ADN, la amplificación del ADN polimórfico y la visualización de las bandas generadas, tal como se describe a continuación:
Para la extracción de ADN genómico se tomaron muestras de cinco microbulbos provenientes de cada uno de los tratamientos de conservación y mutagénesis in vitro y se aplicó el método de purificación con bromuro de cetiltrimetilamonio (método CTAB) descrito por Doyle y Doyle (1999). Esta metodología permitió obtener cantidades suficientes de ADN de buena calidad.
La amplificación de los fragmentos al azar fue realizada con 12 iniciadores mostrados en el Cuadro 2. Se seleccionó una muestra compuesta de tejido de cada uno de los materiales antes descrito y se aplicó el protocolo para RAPD descrito por Williams et al. (1990). Las condiciones más apropiadas para la amplificación fueron: Tampon Promega 1X, 1,5 μM MgCl2, 0,2 mM dNTPs, 0,001% gelatina, 0,25 mM iniciador, 1,5 U Taq Promega y 10 ng de ADN en un volumen final de 20 μL.
La PCR fue realizada en un termociclador Thermo Px2, programado para un primer ciclo térmico de 1 min a 93 ºC, seguido por 45 ciclos correspondientes a la desnaturalización (1 min a 93 ºC), alineación del iniciador (36 ºC por 1 min) y elongación (72 ºC por 1 min). Posteriormente, el producto se mantuvo constante a 72 ºC por 5 min y luego fue conservado a 4 ºC hasta la realización de la electroforesis. Se realizaron tres réplicas de cada reacción.
Se logró la visualización de los fragmentos amplificados en geles de agarosa al 2 %, teñidos con bromuro de etidio al 1%. Los productos de amplificación polimórficos fueron registrados en matrices binarias de datos, asignando (0) para ausencia y (1) presencia de bandas amplificadas. Se construyó una matriz generada mediante el coeficiente de distancia Dice (1-S) y con ésta, un análisis de agrupamiento por dendrograma y coordenadas principales. Ambos tipos de análisis permitieron visualizar las relaciones genéticas entre los materiales evaluados. Los análisis se realizaron utilizando el programa estadístico Infogen (Universidad Nacional de Córdoba, Argentina).
RESULTADOS Y DISCUSIÓN
La microbulbificación a partir de brotes cultivados en MS suplementado con 2 mg·L-1 de 2ip y 90 mg·L-1 de sacarosa, permitió el desarrollo de un solo microbulbo por tubo de ensayo, evidenciando la eficiencia del protocolo utilizado, tal como lo indicado por Mujica y Mogollón (2004). Dichos autores señalan que este medio es comúnmente utilizado para la regeneración de microbulbos a partir de ápices caulinares, dado que con estas concentraciones se encuentran las condiciones apropiadas para el rápido crecimiento y/o desarrollo tanto de los microbulbos, como de las hojas y raíces en un período de 2 meses.
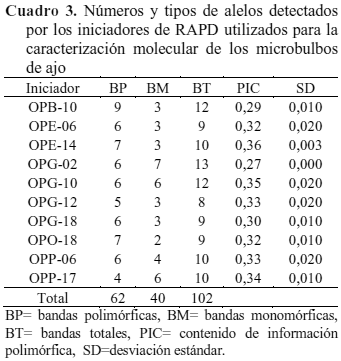
Conservación in vitro. Los microbulbos almacenados bajo cinco tratamientos de conservación in vitro se diferenciaron por patrones de bandas obtenidos por marcadores RAPD. De un total de 12 iniciadores de las series OPB, OPE, OPG, OPO Y OPP, sólo 10 de ellos generaron un total de 102 bandas de las cuales 62 bandas fueron polimórficas (Cuadro 3). Entre éstos, el iniciador OPB-10 generó el mayor número de bandas polimórficas (9), seguido por OPE-14, OPO-18, OPE-06, OPG-02, OPG-10, OPG-18 y OPP-06 que formaron entre 7 a 6, así como el OPG-12 y OPP-17 con 5 y 4 bandas polimórficas, respectivamente. Todas las bandas se mostraron claras, leíbles y reproducibles, lo cual permitió detectar las variaciones genéticas entre los microbulbos conservados in vitro.
Estos resultados indican que la cantidad y calidad de los productos de amplificación fueron suficientes para detectar variaciones genéticas entre los microbulbos de ajo cultivados en cinco tratamientos de conservación, confirmando investigaciones previas realizadas por Buso et al. (2008), Khar et al. (2008) y Abdoli et al. (2009), donde se reporta a los marcadores RAPD como una herramienta útil para detectar variaciones genéticas en diferentes clones o cultivares de ajo.
Con respecto a la reproducibilidad de los RAPD, los resultados fueron similares a los reportados en ajo por Al Zahim et al. (1997) y Paredes et al. (2008), dado que en las investigaciones realizadas por los autores mencionados, los iniciadores de la serie OPB, OPG y OPO amplificaron un promedio de 2 a 20 bandas polimórficas cada uno. Asimismo, de los iniciadores utilizados por Maas y Klass (1995), Choi et al. (2005) y Khar et al. (2008), sólo 12 a 15 de éstos revelaron bandas polimórficas, lo cual demuestra la optimización de esta técnica durante la investigación aquí desarrollada.
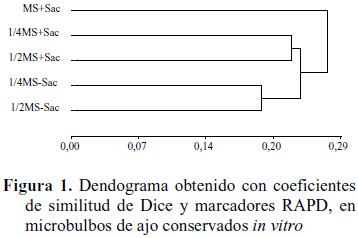
El dendograma obtenido mediante el coeficiente de distancia de Dice, conformó tres grupos (Figura 1). En el grupo I, se ubicó el tratamiento MS con sacarosa (T1) a una distancia de 0,28, siendo el más alejado de los restantes tratamientos. El grupo II se conformó por los medios ½ MS y ¼ MS ambos con sacarosa (T2 y T4) con una distancia de 0,23; mientras que el grupo III incluyó a los microbulbos conservados en ½ MS y ¼ MS sin sacarosa (T3 y T5), con una distancia de 0,18. Estos resultados indican que en el medio MS con sacarosa se observó la mayor variación genética, equivalente en este caso a mayor inestabilidad genética, seguido por los medios ½ MS y ¼ MS ambos con sacarosa con una variación o estabilidad genética intermedia. Por su parte, en los medios ½ MS y ¼ MS sin sacarosa la menor variación indica una mayor estabilidad genética.
Lo anterior refleja que la presencia de sacarosa, más que la fortaleza del medio fue el factor que más influyó en la variación genética de los microbulbos durante su conservación in vitro.
La representación gráfica de las coordenadas principales muestra dos coordenadas (Figura 2). La primera explica el 40,6% de la variación total del análisis y está relacionada con la concentración del medio MS, observándose en orden lineal de izquierda a derecha valores crecientes de MS (¼, ½ y 1). La segunda coordenada explica sólo el 27% de la variación detectada y se relaciona con la presencia de sacarosa, incluyéndose en los cuadrantes positivos los medios sin sacarosa y en los negativos en presencia de este carbohidrato. En el cuadrante ++, se concentraron los materiales conservados en ½ MS (T3), en el cuadrante + -, los almacenados en MS con sacarosa (T1), mientras que en los cuadrantes - - y - +, los medios ¼ MS y ½ MS con sacarosa (T4 y T2) y ¼ MS (T5), respectivamente.
En este experimento, los tres tipos de análisis utilizados (cuantitativo, dendograma y coordenadas principales) evidencian que la presencia o ausencia de sacarosa en el medio nutritivo constituye un factor determinante sobre el comportamiento de los microbulbos de ajo. Al respecto, Pardo et al. (2014) sugieren que sólo en presencia de este carbohidrato los microbulbos como órganos de reserva, pueden realizar una eficiente translocación de agua y nutrientes hasta la parte aérea, garantizando con ello los procesos fotosintéticos así como el balance carbohidrato-sales necesario para el buen funcionamiento de los tejidos. Contrariamente, en ausencia de este carbohidrato, los materiales manifiestan, además de bajos promedios para las características vegetativas evaluadas, deficiencias fisiológicas manifestadas como poco vigor y colores blanquecinos.
Es importante destacar que durante el mantenimiento en los bancos de germoplasma y/o durante la conservación in vitro se debe garantizar la uniformidad o estabilidad genética de los materiales. En tal sentido, el análisis molecular reflejó que los microbulbos almacenados en los medios ½ MS y ¼ MS, ambos con sacarosa (T2 y T4), mostraron además de un crecimiento mínimo pero progresivo, variación o estabilidad genética intermedia. Por lo que ambas condiciones, crecimiento mínimo y estabilidad genética intermedia, permitirán la conservación de los microbulbos por un período de tiempo no mayor a los 210 días. Contrariamente, en el medio MS con sacarosa (T1), además de presentar la mayor variación genética, en este caso equivalente a inestabilidad genética, los microbulbos crecieron y se desarrollaron rápidamente, lo cual no es recomendable para su mantenimiento durante largos períodos de tiempo. Por su parte, los microbulbos almacenados en los medios ½ MS y ¼ MS en ausencia de sacarosa (T3 y T5), aún cuando mostraron la mínima variación genética, a nivel morfológico presentaron poco vigor y bajo porcentaje de sobrevivencia, lo que resulta indeseable para la conservación bajo condiciones de crecimiento mínimo. Cabe destacar que aun cuando el análisis molecular detectó variaciones entre los microbulbos conservados, tales cambios genéticos no se evidenciaron como alteraciones morfológicas o a nivel fenotípico en los materiales evaluados.
Finalmente, los resultados obtenidos soportan investigaciones previas con marcadores RAPD en ajo por Buso et al. (2008), Paredes et al. (2008) y Afrasiab y Iqbal (2012), ya que se demostró que además de ser una técnica rápida, fácil y económica, los RAPD son útiles para evaluar la estabilidad genética durante la micropropagación, la conservación ó el mantenimiento de recursos fitogenéticos.
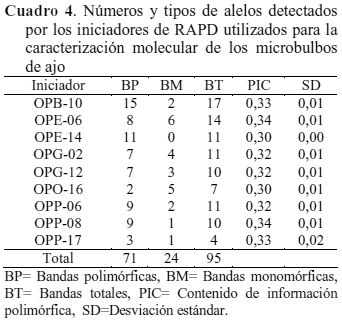
Mutagénesis in vitro. Los microbulbos irradiados se diferenciaron por patrones de bandas obtenidos de los marcadores RAPD. De los 12 iniciadores utilizados, sólo 9 de ellos generaron un total de 95 bandas de las cuales 71 resultaron polimórficas (Cuadro 4). Dentro de éstos, el iniciador OPB-10 generó el mayor número de bandas polimórficas (15), seguido por OPE-14 con 11 y OPP-06 y OPP-08 con 9 bandas cada uno. Los restantes iniciadores generaron entre 8 y 2 bandas polimórficas.
Con respecto a los iniciadores utilizados y el número de bandas obtenidas, 7 de éstos (OPB-10, OPE-06, OPE-14, OPG-02, OPG-12, OPP-06, OPP-17), amplificaron tanto en microbulbos conservados como irradiados, mostrando en ambos experimentos el efecto de la radiación gamma así como de los tratamientos de conservación utilizados. Tal como lo señalado por Luna y Ponce (2001), estas variaciones, reflejadas como polimorfismo RAPD, pueden ser atribuidas bien sea a mutaciones puntuales en el ADN tales como sustitución o inserción de bases, o bien a cambios en la estructura de los cromosomas como delecciones o translocaciones.
El dendograma obtenido mediante el coeficiente de distancia de Dice, conformó dos grupos (Figura 3). El grupo I, incluyó a los microbulbos irradiados con 8 y 10 krad, con una distancia de 0,38 entre ellos, mientras que el grupo II, a los materiales testigos o tratados con 6 krad, a una distancia común de 0,28. Estos resultados indican que la aplicación de 8 o 10 krad de radiación gamma, determinó la mayor variación genética en los microbulbos, mientras que con 6 krad o en el testigo dicha variación fue menor.
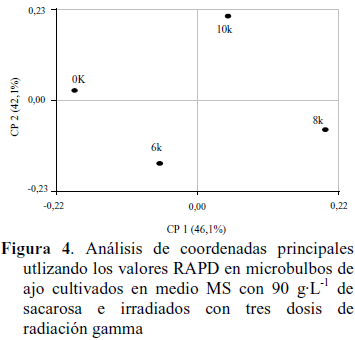
El análisis de las coordenadas principales (Figura 4) explica en el CP1 el 46,1% de la variación y se relaciona con el grado de radiación que causa variación. En este caso, la radiación con 6 krad se asocia con el testigo no irradiado, ubicándose en los valores negativos del eje, mientras que las dosis mayores se ubican del lado positivo del eje. En general todos los tratamientos de mutagénesis, incluyendo al testigo, se ubicaron en planos opuestos del gráfico, es decir en los cuadrantes I, II, III y IV, respectivamente.
En este estudio, el análisis molecular (dendograma y coordenadas principales), separó a los tratamientos con 8 y 10 krad de los testigos e irradiados con 6 krad. En efecto, con altas dosis de radiación, los microbulbos mostraron mayor variación genética (distancia 0,38), lo cual pudo ser detectado a nivel molecular por los marcadores RAPD, mientras que con 0 y 6 krad se observaron los menores promedios para ambas variables y la menor distancia genética (0,28) equivalente en este caso a menor variación genética. Lo anteriormente señalado, sugiere que los microbulbos pueden ser irradiados con las dosis mayores si el propósito es inducir cambios, alteraciones o variaciones en el ADN con fines de mejoramiento genético.
En relación a los factores o fuentes para incrementar la variabilidad en clones de ajo, destacan el empleo del medio MS con sacarosa (45 g·L-1) así como de la aplicación de radiación gamma en dosis de 8 y 10 krad, ya que en ambos casos se observó la mayor variación genética en los experimentos de conservación y mutagénesis, respectivamente. Por otra parte, si en ambos experimentos se consideran análogas las distancias obtenidas por el coeficiente de Dice, se observa que la irradiación de los microbulbos con las dosis antes mencionadas indujo la mayor variación genética (0,38), seguido por el uso de MS con 45 g·L-1 de sacarosa (0,28). En consecuencia, el empleo de estas dosis de irradiación y del medio de cultivo señalado pueden propiciar la producción de mutantes o variantes somaclones, respectivamente.
Los resultados aquí obtenidos demuestran la sensibilidad de los marcadores RAPD para detectar variaciones genéticas entre diferentes materiales de ajo, tal como lo reportado por Buso et al. (2008) y Afrasiab y Iqbal (2012), por lo que dicha técnica resulta de gran utilidad para la detección temprana de mutantes o variantes somaclonales, ya que permite bien sea distinguir variaciones genéticas antes de que los materiales sean llevados al estado adulto o bien antes de que se exprese alguna alteración a nivel morfológico o fenotípico.
CONCLUSIONES
Durante los experimentos de conservación, los microbulbos cultivados en los medios ¼ MS y ½ MS, ambos con sacarosa, mostraron estabilidad genética por un período de tiempo de al menos 210 días.
Los microbulbos irradiados con 8 y 10 krad, presentaron la mayor variación genética.
AGRADECIMIENTO
A Paúl Azuaje Pardo. Al CDCHT-UCLA por el financiamiento otorgado. Al personal de los Laboratorios de Cultivo in vitro y Biología Molecular del Decanato de Agronomía-UCLA
LITERATURA CITADA
1. Abdoli, M., B. Habibi, K. Baghalian, S. Shahnazi y H. Rassouli. 2009. Classification of Iranian garlic (Allium sativum L.) ecotypes using RAPD markers. Journal of Medicinal Plants 8(5): 45-51. [ Links ]
2. Afrasiab, H y J. Iqbal. 2012. Genetic analysis of somaclonal variants and induced mutants of potato (Solanum tuberosum L.) cv. Diamant using RAPD markers. Pak. J. Bot. 44(1): 215-220. [ Links ]
3. Alam, M., M. Rahim y P. Simon. 2012. Molecular characterization of garlic germplasms using RAPD. J. Agrofor. Environ. 6(1): 63-66. [ Links ]
4. Al-Zahim, M., H. Newbury y B. Ford-Lloyd. 1997. Classification of genetic variation in garlic (Allium sativum L.) revealed by RAPD. HortScience 32(6): 1102-1104. [ Links ]
5. Bairu, M., A. Aremu y J. Staden. 2011. Somaclonal variation in plants: causes and detection methods. Plant Growth Regulation. 63(2): 147-173. [ Links ]
6. Barboza, K., A. Hernández y C. Zuñiga. 2012. Semejanzas entre el ajo (Allium sativum L.) costarricense y el ajo asiático según secuencias del ADN ribosomal. Tecnología en Marcha. 25(2): 32-40. [ Links ]
7. Buso, G., H. Paiva, A. Torres, F. Resende, M. Ferreira, J. Buso y N. Dusi. 2008. Genetic diversity studies of brazilian garlic cultivars and quality control of garlic cloves production. Genetic and Molecular Research 7(2): 534-541. [ Links ]
8. Choi, H., K. Kim, Y. Ahm, D. Kim, J. Won y Y. Lim. 2005. Analysis of genetic relationships in garlic germplasm and fertile garlic by RAPD. J. Kor. Soc. Hort. Sci. 44: 595-600. [ Links ]
9. Doyle, J y T. Doyle. 1999. Isolation of DNA from small amounts of plant tissues. Focus 12: 13-15. [ Links ]
10. Figliuolo, G., V. Candido, G. Logozzo, V. Miccolis y P. Spagnoletti. 2001. Genetic evaluation of cultivated garlic germplasm (Allium sativum L. and A. ampeloprasum L.). Euphytica 121: 325-334. [ Links ]
11. Hyun, M., I. Ham, K. Thu, S. Kwon, F. Lu y Y. Park. 2012. Classification of genetic variation in garlic (Allium sativum L.) using SSR markers. Australian Journal of Crop Science 6(4): 625-631. [ Links ]
12. Ipek, M y A. Ipek. 2003. Comparison of AFLPs, RAPD markers and isozymes for diversity assessment of garlic and detection of putative duplicates in germplasm collections. J. Amer. Soc. Hort. Sci. 128(2): 246-252. [ Links ]
13. Ipek, M., A. Ipek y P. Simon. 2008. Rapid characterization of garlic with locus specific DNA markers. Turk. J. Agric. For. 32: 357-362. [ Links ]
14. Khar, A., A. Devi y K. Lawande. 2008. Analysis of genetic diversity among indian garlic (Allium sativum L.) cultivars and breeding lines using RAPD markers. The Indian Journal of Genetic and Plant Breeding. 68(1): 52-57. [ Links ]
15. Luna, F y P. Ponce. 2001. Caracterización molecular de aislados de Sclerotium cepivorum mediante análisis del polimorfismo de los fragmentos amplificados al azar. Acta Universitaria 11(2): 53-59. [ Links ]
16. Maas, H y M. Klaas. 1995. Infraspecific differentiation of garlic (Allium sativum L.) by isozyme and RAPD markers. Theor. Appl. Genet. 91(1): 89-97. [ Links ]
17. Mujica, H y N. Mogollón. 2004. Bulbificación in vitro de ajo (Allium sativum L.) con adición de citocininas y sacarosa en el medio de cultivo. Bioagro 16(1): 55-60. [ Links ]
18. Paredes, M., V. Becerra y M. González. 2008. Low genetic diversity among garlic (Allium sativum L.) accessions detected using random amplified polymorphic DNA (RAPD). Chilean Journal of Agriculture Research 68(1): 3-12. [ Links ]
19. Pardo, A. 2015. Mutagénesis inducida en microbulbos de Allium sativum L. Acta Agronómica 64(3): 41-46. [ Links ]
20. Pardo, A., A. Hernández y N. Méndez. 2009. Caracterización molecular de siete clones de ajo (Allium sativum L.) mediante la técnica RAPD. Bioagro 21(2): 81-86. [ Links ]
21. Pardo, A., S. Rivero y G. Alvarado. 2014. Conservación in vitro de microbulbos de ajo (Allium sativum L.). Bioagro 26(2):115-122. [ Links ]
22. Sánchez, N y V. Jiménez. 2009. Técnicas moleculares para la detección de variantes somaclonales. Agronomía Mesoamericana 20(1): 135-151. [ Links ]
23. Vatsyayan, S., P. Brar, R. Dhall. 2013. Genetic variability studies in garlic (Allium sativum L.). Annals of Horticulture 6(2): 315-320. [ Links ]
24. Volk, G., A. Henk y C. Richards. 2004. Genetic diversity among U.S. garlic clones as detected using AFLP methods. J. Amer. Soc. Hort. Sci. 129 (4): 559-569. [ Links ]
25. Wilches, A. 2004. Descripción de algunas herramientas moleculares y sus aplicaciones. Instituto de agricultura, recursos naturales y ambiente. Serie Técnica N° 15. 31 p. [ Links ]
26. Williams, J., A. Kubelik, N. Livak, A. Rafañski, A. y S. Tingey. 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucl. Acids. Res. 18: 6531-6535. [ Links ]