Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro vol.29 no.3 Barquisimeto dic. 2017
Efecto de la microfiltración y diafiltración en el contenido de carotenoides y compuestos aromáticos del jugo de sandía (Citrullus lanatus L.)
Luis Chaparro1, Soraya Castillo1, Fabrice Vaillant2, Adrien Servent2 y Manuel Dornier2
1 Dpto. de Procesos Agroindustriales, Programa de Ingeniería Agroindustrial. Decanato de Agronomía, Universidad Centroccidental Lisandro Alvarado. Apdo. 400. Barquisimeto, Venezuela. e-mail: luischaparro@ucla.edu.ve
2 Centre de coopération Internationale en Recherche Agronomique pour le Développement (CIRAD), Montpellier Cedex 5, France.
RESUMEN
Los carotenoides son un grupo de pigmentos naturales presentes en frutas y hortalizas con alta capacidad antioxidante, y además son precursores de la formación de aromas específicos. El objetivo del trabajo fue evaluar la distribución de carotenoides y compuestos aromáticos del jugo de sandía durante operaciones secuenciales de microfiltración y diafiltración. Los ensayos de microfiltración se realizaron en jugo con tratamiento enzimático previo, empleando una membrana de 0,8 μm a una presión promedio de 0,1 MPa, temperatura de 50 ºC y velocidad de flujo de 6,0 m·s-1, con 2 L de volumen de alimentación constante. Seguidamente se realizó un proceso de diafiltración del retenido utilizando agua potable. Se determinó la concentración de β-caroteno, isómeros trans y cis licopeno, sólidos solubles totales (SST), pH, acidez titulable, materia seca total y componentes aromáticos en las corrientes derivadas del proceso. El flujo promedio obtenido en la etapa de microfiltración fue de 114 L·h-1·m-2 a un factor de reducción volumétrica (FRV) de 10. La concentración de licopeno en el retenido luego de la microfiltración fue de 657±40 mg·kg-1. La etapa de diafiltración redujo los SST hasta 11,1±0,3 g·kg-1. El tratamiento enzimático no influyó en la composición de los compuestos aromáticos del jugo, sin embargo del proceso de microfiltración y diafiltración se obtuvieron corrientes con una distribución de compuestos aromáticos diferentes al jugo fresco.
Palabras clave adicionales: Aromas, enzimas, membranas, fracción retenida
Effect of microfiltration and diafiltration on carotenoid and aromatic compounds of watermelon juice (Citrullus lanatus L.)
ABSTRACT
Carotenoids are a group of natural pigments of fruits and vegetables with high antioxidant capacity, and are also precursors to the formation of specific aromas. The objective of this work was to evaluate the distribution of carotenoids and aromatic compounds of watermelon juice during sequential microfiltration and diafiltration operations. The microfiltration tests were performed in juice with previous enzymatic treatment, using a membrane of 0.8 μm at an average pressure of 0.1 MPa, temperature of 50 °C and flow velocity of 6.0 m·s-1, with 2 L constant feed volume. A retention diafiltration process was then performed using potable water. The concentration of β-carotene, trans and cis-lycopene isomers, total soluble solids (SST), pH, titratable acidity, total dry matter and aromatic components were determined in all streams derived from the process. The average flow obtained in the microfiltration stage was 114 L·h-1·m-2 at a volumetric reduction factor of 10. The concentration of lycopene in the retentate after the microfiltration was 657±40 mg·kg-1. The diafiltration step reduced the SST to 11.1±0.3 g·kg-1. The enzymatic treatment did not influence the composition of the aromatic compounds of the juice; however, from the microfiltration and diafiltration processes currents were obtained with a distribution of aromatic compounds different from the fresh juice.
Additional key words: Enzymes, fragance, membranes, retentate
Recibido: Agosto 30, 2016 Aceptado: Mayo 29, 2017
INTRODUCCIÓN
La nueva tendencia de la industria de alimentos se orienta al desarrollo de productos sin agregados artificiales, conservando sus compuestos naturales, y enriquecidos con elementos bioactivos que aporten beneficios más allá de los nutricionales. Esta situación ha impulsado la búsqueda de nuevos métodos de obtención de ingredientes y aditivos a partir de fuentes naturales, para sustituir aquellos potencialmente tóxicos o alérgenos (Restrepo-Gallego, 2007).
Tarazona-Díaz y Aguayo (2013b) mencionaron que el jugo de sandía (Citrullus lanatus L.) presenta altos contenidos de licopeno y citrulina, por lo cual es una excelente fuente de compuestos bioactivos. Esta fruta es una fuente importante de carotenoides en la dieta, siendo el licopeno y β caroteno los pigmentos responsables del color de su pulpa (Wenen et al., 2013).
Por su parte Tlili et al. (2011) reportaron que el contenido de carotenoides en sandia varía entre 53 y 102 mg·kg-1; sin embargo, esta concentración puede cambiar de acuerdo a la variedad, época de cosecha y otros factores climáticos. Anese et al. (2013) indicaron que la popularidad de los carotenoides como componentes bioactivos se debe a que estudios epidemiológicos han concluido que su ingesta está asociada con un menor riesgo de sufrir enfermedades degenerativas. Particularmente, el licopeno es considerado como un importante antioxidante liposoluble, el cual no puede ser sintetizado por el organismo, por lo que su ingesta depende principalmente del consumo de frutas y vegetales. Este caroteno es un poderoso secuestrante de oxígeno singlete y es comparativamente más poderoso que la mayoría de los carotenoides plasmáticos, por lo cual se le atribuye propiedades anticancerígenas (Shi et al., 2011). Boon et al. (2010) señalaron que en productos vegetales crudos, aproximadamente 95 % del licopeno se encuentra en forma all-trans, formando un complejo proteína-pigmento fotosintético de la membrana tilacoide. En alimentos procesados normalmente el licopeno se encuentra en su forma isómera cis debido a las transformaciones por efecto de la temperatura, luz, oxígeno, y cuya nueva configuración favorece la absorción en el organismo (Van Buggenhout et al., 2010).
La principal ventaja comparativa de la microfiltración tangencial respecto a otros métodos de procesamiento de jugos de frutas consiste en que las condiciones de trabajo pueden llevarse a cabo a temperatura ambiental. Ha sido señalado por de Oliveira et al. (2012) que la mayoría de los jugos de frutas tropicales se caracterizan por su alto contenido de componentes volátiles, los cuales se pierden durante los procesos térmicos reduciendo la calidad sensorial del producto final. Este efecto se observa mayormente en frutas como melón, piña, maracuyá y papaya, en los cuales se pueden perder hasta un 90 % de los compuestos aromáticos empleando métodos convencionales.
Las tecnologías de procesamiento por membranas pueden ser una alternativa para la separación de compuestos nutricionales a partir de jugos de frutas. Dizge et al. (2011) aplicaron microfiltración tangencial en la separación de suspensiones biológicas ya que no involucra agentes químicos y se obtienen productos de baja turbidez. Cruz et al. (2011) concluyeron que la microfiltración con membranas cerámicas y de polímeros del jugo de la palmera acai (Euterpe oleracea Mart.) no afectó significativamente los compuestos bioactivos del jugo.
Por su parte Vaillant et al. (2005) señalaron que la microfiltración de jugo de melón puede ser una alternativa de concentración de β-caroteno. Los autores reseñaron que pruebas sensoriales preliminares realizadas al jugo clarificado mostraron que el permeado conservó el aroma característico a melón, el cual pudo ser reconocido fácilmente, mientras que el material retenido resultó con muy poco aroma y poseía una textura aceitosa, la cual fue atribuida a la alta concentración de β-caroteno.
En razón de lo expuesto, se planteó evaluar la distribución de los carotenoides y compuestos aromáticos del jugo de sandía durante un proceso de microfiltración y diafiltración del zumo.
MATERIALES Y MÉTODOS
Materia prima y tratamiento enzimático del jugo. Se emplearon frutos de sandía o patilla adquiridas en el mercado local de Montpellier (Francia) los cuales fueron lavados con agua clorada (200 ppm), cortados y despulpados en forma manual y posteriormente refinados en una despulpadora tipo horizontal auriol, mod. PH3, con malla de 0,5 mm. Posteriormente el jugo fue almacenado a -18 ºC por 24 h. Una fracción del jugo se hidrolizó a 45 ºC por 45 min con la mezcla enzimática comercial Ultrazym AFP-L. La mezcla enzimática utilizada posee una actividad declarada de 12.500 unid·mL-1 de poligalacturonasa obtenida a partir de cepas seleccionadas de Aspergillus niger y Aspergillus aculeatus. El jugo fresco se utilizó como tratamiento control para comparar las características físicas y químicas y componentes aromáticos durante los tratamientos aplicados.
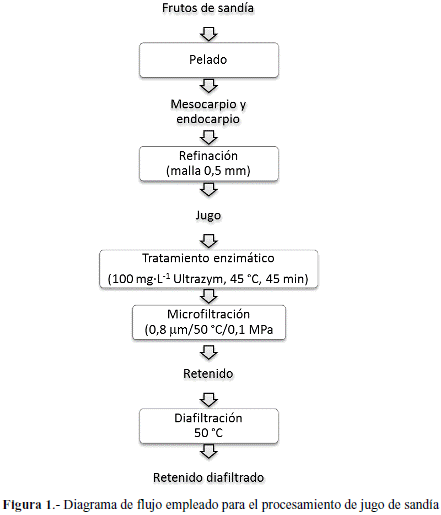
Procedimiento (microfiltración y diafiltración). El proceso tecnológico aplicado consistió de una etapa de microfiltración del jugo de sandía hidrolizado. Posteriormente el retenido obtenido fue sometido a un proceso de diafiltración el cual consistió en alimentar al sistema una corriente de agua con el objetivo de eliminar la fracción de componentes solubles del retenido (Figura 1).
La microfiltración se realizó en un equipo piloto, fabricado por (Techniques Industrielles Appliquées,) con cuatro membranas de α-Al2O3, mod. Membralox T1-70 (Pall Exekia,). Se emplearon membranas de 0,8 μm, presión transmembrana de 0,1MPa a 50 ºC, a una velocidad tangencial del flujo de 6,0 m·s-1, con 2 L de volumen constante hasta alcanzar un factor de reducción volumétrica (FRV) teórico de 10 calculado de acuerdo a la siguiente ecuación.
![]()
donde:
Vp = volumen de permeado
Vr = volumen de retenido
La diafiltración se realizó inmediatamente después de la microfiltración, agregando agua potable al sistema. El proceso se efectuó a volumen constante hasta obtener tres lecturas comparables de sólidos solubles en el permeado de diafiltrado. Las condiciones de temperatura, presión y velocidad de flujo fueron las mismas aplicadas en la microfiltración y la cantidad de agua empleada para realizar el proceso se expresó en términos de diavolumen (DV) según la siguiente ecuación.
![]()
donde:
Vd = volumen de diafiltrado
Vr = volumen de retenido
Caracterización fisicoquímica. Los sólidos solubles totales (SST) se determinaron utilizando un refractómetro digital Pocket PAL-3 (ATAGO). Los análisis de pH y acidez titulable (expresada como % acido málico) se realizaron siguiendo la normativa AOAC (1990) y la materia seca total (MST) en estufa a vacío a 30 mbar según la misma normativa. Por otra parte, los sólidos insolubles suspendidos (SIS) fueron calculados por diferencia entre la MST y los SST. Todos los análisis fisicoquímicos se realizaron en el jugo fresco y con tratamiento enzimático, así como en las corrientes derivadas del proceso con un total de tres repeticiones.
Análisis de carotenoides. La concentración de carotenoides se determinó según lo propuesto por Dhuique-Mayer et al. (2007) y empleado por De Abreu et al. (2013). Se utilizó un cromatógrafo líquido Agilent, mod. 1100 equipado con un detector de arreglo de fotodiodos. La separación se llevó a cabo con una columna C30 (250 x 4,6 mm d.i., 5 μm) YMC (YMC Europe GmbH). La fase móvil consistió en H2O como eluyente A, metanol como eluyente B, y MTBE (metil terc-butil éter) como eluyente C. El flujo fue fijado en 1 mL·min-1, temperatura de la columna en 25 ºC y volumen de inyección en 20 μL empleando un programa de gradiente. La absorbancia se midió a 470, 450 y 400 nm. Los carotenoides se analizaron cuantitativamente mediante el uso de calibración externa con licopeno, β-caroteno y cis-licopeno. Las curvas de calibración se construyeron con cinco niveles de concentración, cada una por triplicado y los coeficientes de correlación oscilaron entre 0,994 y 0,998.
Las muestras inyectadas en el equipo de HPLC fueron obtenidas mediante extracción en solución alcohólica de etanol:hexano (4:3) para posteriormente separar la fase orgánica con una solución de NaCl al 15 % y luego ser evaporada en un rotavapor a 45 ºC a presión de vacío de 30 mbar. Finalmente el residuo fue recolectado con 500 μL de CH2CL2 (cloruro de metileno) y 1000 μL de MTBE/etanol 80:20.
Análisis de compuestos aromáticos. Se utilizó la metodología aplicada por Meret et al. (2011) para la identificación de los compuestos aromáticos presentes en las muestras de jugo fresco, con tratamiento enzimático, permeado, retenido y retenido diafiltrado usando cromatografía de gases-espectrometría de masas (GC-MS).
Luego de 5 min de descongelación, se colocaron 2 mL de cada muestra en un tubo vial de vidrio de 10 mL y se agregaron 300 μL de 2-octenal como estándar interno. Los compuestos volátiles libres fueron capturados por microextracción en fase sólida del espacio de cabeza (SPME), con una fibra de poli-dimetilsiloxano (PDMS) a 60 ºC durante 45 min bajo agitación. El análisis por GC-MS se realizó en un cromatógrafo de gases (Agilent 6890) acoplado a un detector de masas (Agilent Mass Spectrometer (5973 N) J & W Scientific) y la elución fue separada en columna capilar polar DB-Wax (30 m x 0,25 mm d.i. x 0,25 µm). Se utilizó gas hidrógeno como portador a un flujo de 1,2 mL·min-1. El espectrómetro de masa fue operado a 70 eV con un rango de 40 a 300 Dalton. La identificación se realizó comparando los índices de retención (IR) determinados por la inyección de una mezcla de la serie C8-C20 de n-alcanos con los espectros de la base de datos del National Institute of Standards and Technology NIST 11 (Nist/Epa/Nih Mass Spectral Library) y verificados en los registros disponibles en internet de las bases de datos Volatile Compounds in Food (VCF) (Triskelion B.V., Zeist, Países Bajos), Flavornet (catalogada por Terry Acree y Heinrich Arn, Cornell University, NY, USA) y The Pherobase: Database of Pheromones and Semiochemicals (recopilado por El-Sayed AM, USA). Los compuestos volátiles se expresaron como la concentración equivalente a 2-octenal y el porcentaje de retención relativo para cada corriente del proceso:
![]()
donde:
A = Área del pico del compuesto en el jugo
Aj = Área del pico del compuesto en la muestra obtenido por cromatografía gaseosa
Análisis estadístico. Los resultados de los análisis físicos y químicos se expresaron como los promedios y su desviación estándar con coeficientes de variación menores a 10 %. Las diferencias estadísticas se realizaron a través de una prueba t de student.
Resultados Y DISCUSIÓN
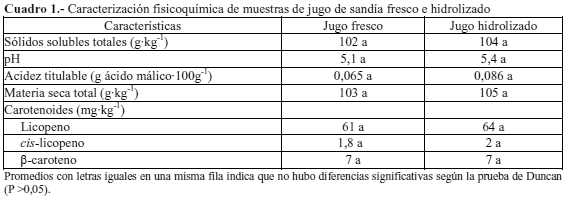
Caracterización del jugo de sandía. Los resultados de los análisis fisicoquímicos del jugo fresco y el hidrolizado se muestran en Cuadro 1, en el que se observa que no hubo diferencias significativas (P≤0,05) entre ambos tipos de jugo. Los sólidos solubles totales del jugo fresco fueron de 102 ± 3 g·kg-1, promedio inferior a los valores tabulados por Perkins-Veazie y Collins (2004) de 12,2 y 11,9 % para los cultivares Summer Flavor 800 y Sugar Shack, respectivamente. Por su parte, Quek et al. (2007) reportaron 12,1 ºBx para el cv. Sugar Baby, y Tarazona-Díaz y Aguayo (2013a) 9,03 ºBx para el cv. Boston.
La acidez titulable del jugo fresco y el hidrolizado no mostraron diferencias significativas (P>0,05) y fluctuaron entre 0,065 y 0,086 %. Estos valores coincidieron con los resultados publicados por Sharma et al. (2008) quienes tabularon porcentajes entre 0,06 y 0,09 %. Por otra parte, los bajos niveles de acidez titulable y pH superiores a 4,5 detectados en las muestras analizadas, sugieren que el zumo obtenido es susceptible a la degradación microbiana. Tarazona-Díaz y Aguayo (2013a) mencionaron que la sandía es susceptible al crecimiento de patógenos debido a su baja acidez (pH 5,2 a 6,7) y alta actividad de agua (0,97 hasta 0,99).
A pesar de realizar una maceración enzimática no hubo diferencia significativa (P>0,05) entre el contenido de materia seca del jugo fresco y el hidrolizado. Este resultado indicó que el complejo enzimático aplicado no tuvo efecto sobre los sólidos suspendidos en la matriz líquida bajo condiciones del ensayo. El contenido de materia seca está relacionado con la capacidad que tiene un jugo de colmatar la membrana durante la microfiltración. Dahdouh et al. (2015) concluyeron que este es un buen indicador de predicción de filtrabilidad en procesos de separación por membranas, por lo que es de esperar que el jugo de sandía posea un mejor desempeño que otras frutas ya que se encontraron valores de 105 ± 0,3 g·kg-1 de materia seca, en comparación con el mango el cual posee valores próximos al 220 g·kg-1 según Padda et al. (2011).
El contenido de licopeno y β-caroteno en el jugo fresco y el jugo con tratamiento enzimático no presentaron diferencias significativas (P>0,05). Los valores obtenidos para licopeno fueron mayores al encontrado por Gomes et al. (2013) de 44,38 mg·kg-1 en sandías de la variedad Crimson Sweet. Zhao et al. (2013) hacen mención a sandías con concentraciones de 120 mg·kg-1 y señalaron que los frutos triploides poseen mayor cantidad de licopeno que cultivares diploides. La acumulación de licopeno en sandía muestra una curva tipo S donde el contenido de licopeno en frutos jóvenes es baja y por lo general su acumulación es lenta, para luego incrementarse rápidamente durante la madurez fisiológica del fruto y luego disminuir durante la maduración (Wang et al., 2011). Según Tarazona-Díaz et al. (2011) los compuestos funcionales en frutas y otros vegetales pueden ser influenciados por varios factores, tales como el cultivar, condiciones climáticas, prácticas culturales y madurez.
Los resultados del análisis de carotenoides indicaron que no hubo un incremento notable en la cantidad de isómeros cis-licopeno en el jugo con tratamiento enzimático luego de las operaciones aplicadas. Los isómeros detectados representaron solo el 3 % del total de licopeno presente en el jugo tratado enzimáticamente.
La mayor parte del licopeno presente en los frutos se encuentra en su forma trans unido a la matriz sólida, lo cual impide su liberación completa y disminuye la biodisponibilidad. La isomerización a la forma cis es deseable para mejorar su biodisponibilidad (Cruz-Bojórquez et al., 2013). La formación de estos compuestos se debe principalmente a la acción combinada de factores como oxígeno, luz y temperatura las cuales son variables que influyen en la estabilidad química de los carotenoides tal como lo señalan Demiray et al. (2013). La forma isomérica de los carotenoides influye en su bioactividad y biodisponibilidad y se debate si los isómeros cis pueden ser preferencialmente absorbidos por el cuerpo o el trans-licopeno es convertido a cis una vez consumido (Boon et al., 2010). Por otra parte, la forma cis se encuentra en altas proporciones en productos elaborados y es más susceptible a procesos de degradación por factores externos por lo que es conveniente conservar la molécula en su forma nativa.
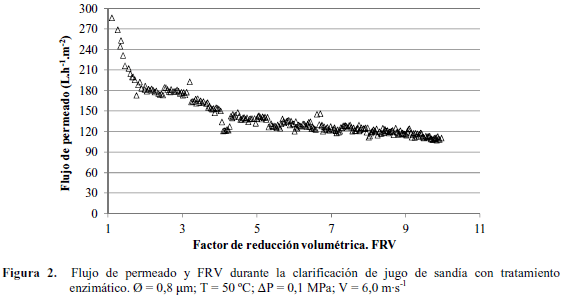
Microfiltración. El comportamiento del flujo de permeado durante el ensayo de clarificación de jugo de sandía hidrolizado se presenta en la Figura 2. La curva obtenida mostró un comportamiento típico de un proceso de microfiltración de jugos de frutas en la cual se observan tres etapas claramente definidas. Una primera etapa comprende desde un FRV desde 1 hasta 3,5 donde el flujo de permeado disminuyó de forma significativa producto de la rápida formación de la capa de sólidos sobre la membrana la cual produjo el descenso del flujo hasta un caudal volumétrico de 150 L·h-1·m-2. A partir de este valor el flujo de permeado posee características seudoestables y ocurrió una lenta disminución del flujo de permeado hasta alcanzar 120 L·h-1·m-2 a un FRV = 7. Finalmente el caudal volumétrico se estabilizó a 114 L·h-1·m-2 luego de 4,45 h de proceso a un FRV = 10.
Las condiciones aplicadas resultaron en un flujo de permeado muy superior a los obtenidos en los ensayos descritos por Gomes et al. (2013) quienes evaluaron el efecto de la microfiltración sobre el contenido de licopeno en jugo de sandía fresco empleando membranas de 0,1 μm. Los autores informan un flujo máximo de permeado de 92,4 L·h-1·m-2 a un FRV de 6 empleando una presión transmembrana de 0,3 MPa a 30 ºC y una velocidad tangencial de 6,4 m·s-1. Por su parte Rai et al. (2010) evaluaron la disminución del flujo de permeado durante la microfiltración de zumo de sandía prefiltrado con malla de nylon, empleando membranas de acetato de celulosa de 0,2 μm a 0,276 MPa de presión transmembrana a temperatura ambiental. El flujo máximo de permeado obtenido fue de 15 L·h-1·m-2 luego de 30 min.
La principal causa de la disminución del flujo de permeado es la formación temprana de la capa de ensuciamiento en la superficie de la membrana y con ello el incremento de la resistencia al flujo. Es de esperar que a medida que se aplica una presión mayor, más solutos se depositen sobre la superficie de la membrana y con ello aumente la capa de ensuciamiento (Chhaya et al., 2008). A pesar de que no hubo una disminución apreciable de la MST en el jugo hidrolizado, se obtuvieron altos flujos de permeado a un FRV de 10 luego de 4,45 h de proceso.
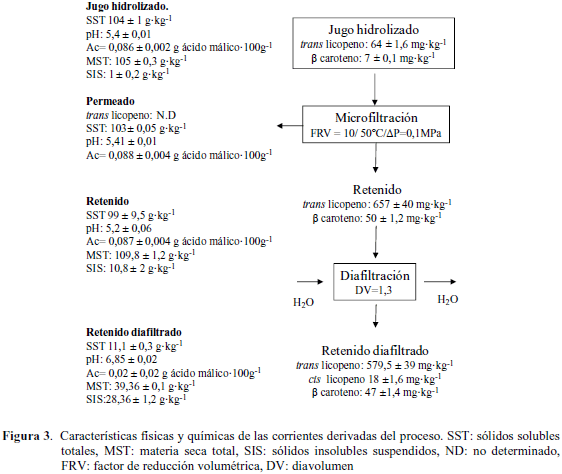
Características fisicoquímicas de las corrientes de proceso. La Figura 3 muestra las características físicas y químicas de las corrientes derivadas de los ensayos realizados. Como se puede observar en la etapa de microfiltración, la corriente de permeado no mostró diferencias apreciables en SST, acidez y pH respecto al jugo hidrolizado de alimentación. Esta característica demostró que los componentes hidrosolubles del jugo se mantuvieron en las mismas proporciones en las corrientes resultantes luego del proceso. Del mismo modo, García-Rujano et al. (2014) no encontraron diferencias en SST, acidez y pH entre el jugo hidrolizado y el permeado durante la microfiltración de jugo de mango empleando una membrana de 0,22 μm.
La concentración de trans-licopeno (657 ± 40 mg·kg-1) y β-caroteno (50 ± 1,2 mg·kg-1) en el retenido final fue proporcional al FRV calculado, lo que indicó que bajo las condiciones estudiadas no existieron pérdidas significativas de carotenos durante el proceso. Este resultado indicó que efectivamente los carotenoides fueron retenidos totalmente por la membrana ya que están asociados a la fracción sólida del jugo. Para de Abreu et al. (2013) los pretratamientos aplicados a la materia prima y la temperatura de procesamiento son las variables de mayor influencia sobre la concentración de carotenoides en procesos de microfiltración.
En el permeado obtenido no se observaron trazas de carotenoides a pesar de haberse empleado una membrana de 0,8 μm muy superior a las empleadas por Gomes et al. (2013), Rai et al. (2010) y Chhaya et al. (2008), resultando un producto claro, indicando que se retuvieron solo los compuestos en suspensión, donde el licopeno fue el componente de mayor interés para el estudio. La MST del retenido se incrementó producto del aumento de los SIS atrapados por la membrana, los cuales fueron diez veces mayor (10,8 g·kg-1) que los del jugo de alimentación, equivalente a la proporción de licopeno retenido en el sistema. Estos resultados son de particular importancia debido a que se evidencia que es posible obtener un extracto concentrado en licopeno y β-caroteno a partir de una materia prima cuyo contenido inicial de carotenoides no era significativo. Efectuar una concentración de los carotenoides a partir de materias primas vegetales, sin afectar de forma importante la estructura nativa de los mismos, permitiría la apertura de una amplia gama de aplicaciones en cuanto a la obtención de colorantes naturales, desarrollo de alimentos potencialmente funcionales y diversificación o revalorización de frutos locales poco comercializados.
Respecto al proceso de diafiltración, el aporte más destacado de esta etapa lo constituyó el aumento de la pureza del retenido (relación contenido de licopeno por MST) debido a la disminución de los SST. Como era de esperarse, hubo una disminución de la MST en el retenido diafiltrado, ya que los SST descendieron hasta 11,1 g·kg-1 los cuales fueron disueltos por el agua añadida y retirados vía el permeado junto a los ácidos orgánicos. Este efecto se puede corroborar al observar el aumento del valor de pH y el descenso de la acidez titulable en el retenido diafiltrado. Por otra parte, los SIS no mostraron variación luego del proceso.
La diafiltración no tuvo efecto considerable en la formación de isómeros cis, los cuales representaron ≈ 3 % de la totalidad del licopeno, lo que indicó que esta etapa no afectó de forma importante la estructura nativa de la molécula. El caudal de permeado durante la diafiltración estuvo en un intervalo de 75 a 80 L·h-1·m-2 por lo tanto, no hubo acumulación adicional de sólidos sobre la membrana. Paulen et al. (2013) indicaron que los procesos de diafiltración son eficientes para la eliminación de impurezas y la purificación de compuestos. Sin embargo, es necesario tener en cuenta los parámetros del proceso para que esta etapa se lleve a cabo en menos tiempo y con menos impacto económico. La cantidad de agua que se empleó para remover el 88 % de los SST fue de 1,3 veces el volumen de retenido procesado (DV = 1,3).
La etapa de microfiltración del retenido resulta muy prometedora en cuanto a la obtención de productos con una alta concentración de licopeno y bajo contenido de azúcares, y su aplicación como colorante natural o componente en formulaciones de bajo aporte de calorías.
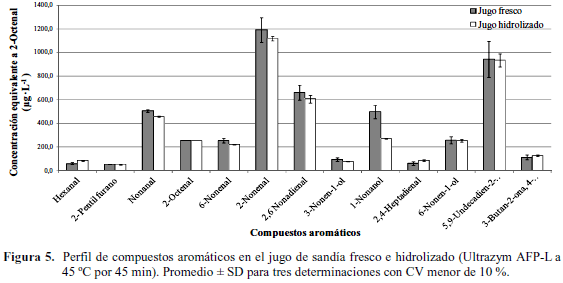
Distribución de los compuestos aromáticos. Se identificaron un total de 12 compuestos aromáticos en las muestras de jugo de sandía fresco, fundamentalmente aldehídos, los cuales fueron corroborados mediante la comparación de los índices de retención calculados (IRa) con los índices de referencia estándar (IRb). El perfil obtenido coincidió con el informado por Beaulieu y Lea (2006) quienes identificaron aldehídos, alcoholes, cetonas y un furano (2-pentil furano); el 3-buten-2-ona, 4-(2,6,6-trimetil-1-ciclohexen-1-il) o β-ionona no coincidió, pero ha sido documentado para sandía (Lewinsohn et al., 2005). Según las bases consultadas los compuestos volátiles identificados están asociados a los aromas de melón, pepino, haba verde, nuez. De acuerdo a Lewinsohn et al. (2005) los aromas de las frutas y otros vegetales son determinados por combinaciones únicas de compuestos volátiles. En ocasiones algunas frutas comparten características de aroma, sin embargo, cada una tiene un aroma característico que es una función de las proporciones de componentes volátiles claves. En la muestra de jugo fresco analizada se corroboró la presencia de los compuestos: hexanal, nonanal, 2-nonenal y 1-nonanol los cuales han sido identificados como componentes del aroma de la sandía (Beaulieu y Lea, 2006).
En la Figura 5 se muestran los valores promedios y desviación estándar de las concentración de los compuestos aromáticos en el jugo fresco y el jugo hidrolizado. Algunos compuestos identificados mostraron valores similares luego del tratamiento enzimático a 45 ºC por 45 min. Descenso apreciable se observó en el nonanal, 1-nonanol, cis-6-nonenal y cis-3-nonen-1-ol. La temperatura de hidrólisis y la incorporación de oxígeno durante la etapa de macerado pudieran ser las principales causas de esta modificación; sin embargo, el grado de afectación dependería del grupo funcional del compuesto.
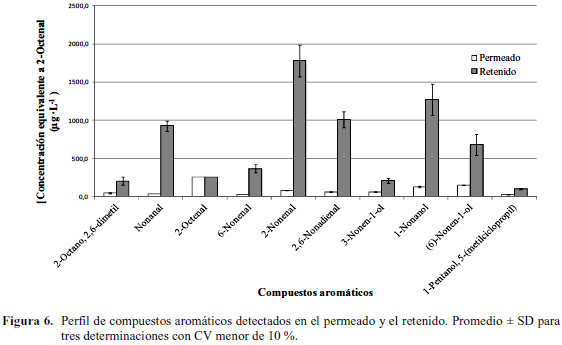
En el proceso de separación de la fracción de licopeno del zumo de sandía por microfiltración, algunos de los compuestos aromáticos también fueron retenidos por la membrana junto a los carotenos; sin embargo, solo 8 de los 12 compuestos identificados en el jugo fresco se detectaron en las fracciones de permeado y retenido (Fig. 6). Este aspecto hace suponer que durante la microfiltración se volatilizan algunos componentes aromáticos del jugo, o sufren modificaciones en su estructura, ya que surgieron dos compuestos (2-octano, 2,6-dimetil y 1-pentanol, 5-(metilciclopropil) los cuales no fueron identificados en el jugo fresco y el jugo hidrolizado. En función a esto se pudo inferir que los compuestos aromáticos pudieran tener diferente grado de asociación con la fracción sólida del jugo, concentrándose en el retenido junto a los SIS o sufren modificaciones por las condiciones del proceso.
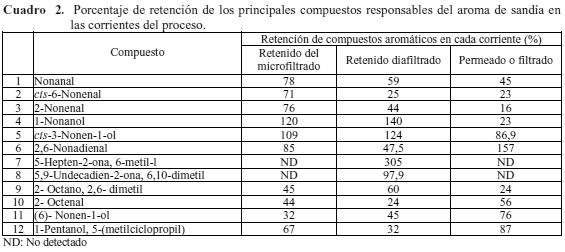
El porcentaje de retención de los principales compuestos volátiles responsables del aroma a sandía fue diferente para cada corriente del proceso lo que demuestra que la membrana posee variabilidad su capacidad de fraccionamiento (Cuadro 2). Los porcentajes de retención del 1-nonanol; cis-3-nonen-1-ol y el 5-hepten-2-ona, 6-metil-1 fueron superiores al 100 % en el retenido y el retenido diafiltrado. Esta característica indica que la membrana posee mayor grado de separación para estos compuestos, aunque un porcentaje de retención superior al 100% demuestra que existe un incremento en la concentración inicial del compuesto, posiblemente a la descomposición de otros, a causa de las condiciones del ensayo.
Publicaciones de Aguiló-Aguayo et al. (2010) y Liu et al. (2012) explican que el 5-hepten-2-ona, 6-metil-l y el 5,9-undecadien-2-ona, 6,10-dimetil (geranil acetona) son los principales responsables del característico aroma a sandía. Por su parte Kobori et al. (2014) exponen que las altas temperaturas de procesamiento pueden inducir la hidrólisis térmica de los glucósidos de la sandía produciendo 5-hepten-2-ona, 6-metil-l. En forma similar, Lewinsohn et al. (2005) indicaron que el 5,9-undecadien-2-ona, 6,10-dimetil puede proceder de la degradación de carotenoides.
Se puede aseverar que estos compuestos son producto de la degradación de otros que son detectados al final de la diafiltración. Bajo las condiciones ensayadas existieron cambios en la composición aromática del jugo que no obedecen a un patrón normal de distribución, ya que los porcentajes de retención varían incluso en compuestos del mismo grupo funcional. Esto pudiera ser atribuido a los cambios de estructura de los compuestos aromáticos analizados, debido a las condiciones de temperatura y presencia de oxígeno, en que se realizó el ensayo.
Conclusiones
El proceso de microfiltración produjo un retenido con una concentración de trans-licopeno 10 veces superior al jugo de alimentación sin afectar de forma importante la isomerización de la estructura nativa del carotenoide. La fracción de permeado no mostró trazas de licopeno, conservó los sólidos solubles totales y acidez titulable del jugo fresco, pero su composición de compuestos aromáticos fue diferente. La etapa de diafiltración redujo los componentes solubles del retenido y produjo compuestos derivados de la degradación térmica. El uso de jugo hidrolizado en la etapa de microfiltración permitió obtener un alto flujo de permeado, aunque la composición de compuestos aromáticos del jugo se modifica en este proceso.
LITERATURA CITADA
1. Aguiló-Aguayo, I., M. Montero-Calderón, R. Soliva-Fortuny y O. Martín-Belloso. 2010. Changes on flavor compounds throughout cold storage of watermelon juice processed by high-intensity pulsed electric fields or heat. Journal of Food Engineering, 100(1): 43-49. [ Links ]
2. Anese, M., G. Mirolo, A. Fabbro y G. Lippe. 2013. Lycopene bioaccessibility and bioavailability from processed foods. Journal of Scientific & Industrial Researche, 72(9-10): 543-547. [ Links ]
3. AOAC. 1990. Association of Official Analytical Chemist. Official Methods of Analysis. Washington, USA. [ Links ]
4. Beaulieu, J. y L. Jeanne. 2006. Characterization and semiquantitative analysis of volatiles in seedless watermelon varieties using solid-phase microextraction. Journal of Agricultural and Food Chemistry 54(20): 7789-7793. [ Links ]
5. Boon, C., D. McClements, D. Julian, J. Weiss y E. Decker. 2010. Factors influencing the chemical stability of carotenoids in foods. Critical Reviews in Food Science and Nutrition, 50(6): 515-532. [ Links ]
6. Cruz, A., R. Mattietto, C. Taxi, C. Araújo, L. Cabral, C. Donangelo y V. da Matta. 2011. Effect of microfiltration on bioactive components and antioxidant activity of açaí (Euterpe oleracea Mart.). Desalination and Water Treatment, 27: 97-102. [ Links ]
7. Cruz-Bojórquez, R., J. González-Gallego y P. Sánchez-Collado. 2013. Propiedades funcionales y beneficios para la salud del licopeno. Nutrición Hospitalaria, 28(1): 6-15. [ Links ]
8. Chhaya, Ch., P. Rai, G. Majumdar, S. Dasgupta y S. De. 2008. Clarification of watermelon (Citrullus lanatus) juice by microfiltration. Journal of Food Process Engineering, 31(6): 768-782. [ Links ]
9. Dahdouh, L., C. Wisniewski, A. Kapitan-Gnimdu, A. Servent, M. Dornier y M. Delalonde. 2015. Identification of relevant physicochemical characteristics for predicting fruit juices filterability. Separation and Purification Technology, 141: 59-67. [ Links ]
10. De Abreu, F., M. Dornier, A. Dionisio, M. Carail, C. Caris-Veyrat y C. Dhuique-Mayer. 2013. Cashew apple (Anacardium occidentale L.) extract from by-product of juice processing: a focus on carotenoids. Food Chemistry, 138(1): 25-31. [ Links ]
11. De Oliveira, R., R. Docê y S. de Barros. 2012. Clarification of passion fruit juice by microfiltration: analyses of operating parameters, study of membrane fouling and juice quality. Journal of Food Engineering, 111(2): 432-439. [ Links ]
12. Demiray, E., Y. Tulek y Y. Yilmaz. 2013. Degradation kinetics of lycopene, β-carotene and ascorbic acid in tomatoes during hot air drying. LWT-Food Science and Technology, 50(1): 172-176. [ Links ]
13. Dhuique-Mayer, C., M. Tbatou, M. Carail, C. Caris-Veyrat, M. Dornier y M. Amiot. 2007. Thermal degradation of antioxidant micro-nutrient in citrus juice: kinetic and newly formed compounds. Journal of Agricultural and Food Chemistry, 55(10): 4209-4216. [ Links ]
14. Dizge, N., G. Soydemir, A. Karagunduz y B. Keskinler. 2011. Influence of type and pore size of membranes on cross flow micro-filtration of biological suspension. Journal of Membrane Science, 366(1-2): 278-285. [ Links ]
15. García-Rujano, T., A. Torres, I. Escobar y R. Betancourt. 2014. Efecto del proceso de microfiltracion tangencial sobre las caracteristicas físicas y químicas del jugo de mango clarificado. Agrollanía 11: 29-36. [ Links ]
16. Gomes, F., P. Costa, M. Campos, R. Tonon, S. Couri y L. Cabral. 2013. Watermelon juice pretreatment with microfiltration process for obtaining lycopene. International Journal of Food Science & Technology, 48(3): 601-608. [ Links ]
17. Kobori, C., R. Wagner, M. Padula y D. Rodríguez-Amaya. 2014. Formation of volatile compounds from lycopene by autoxidation in a model system simulating dehydrated foods. Food Research International, 63(Part A): 49-54. [ Links ]
18. Lewinsohn, E., Y. Sitrit, E. Bar, Y. Azulay, M. Ibdah, M. Ayala et al. 2005. Not just colors-carotenoid degradation as a link between pigmentation and aroma in tomato and watermelon fruit. Trends in Food Science & Technology, 16(9): 407-415. [ Links ]
19. Liu, C., H. Zhang, Z. Dai, X. Liu, Y. Liu, X. Deng et al. 2012. Volatile chemical and carotenoid profiles in watermelons [Citrullus vulgaris Schrad (Cucurbitaceae)] with different flesh colors. Food Science and Biotechnology, 21(2): 531-541. [ Links ]
20. Meret, M., P. Brat, C. Mertz, M. Lebrun y Z. Günata. 2011. Contribution to aroma potential of Andean blackberry (Rubus glaucus Benth.). Food Research Internationa, 44(1): 54-60. [ Links ]
21. Padda, M., C. do Amarante, R. García, D. Slaughter y E. Mitcham. 2011. Methods to analyze physico-chemical changes during mango ripening: a multivariate approach. Postharvest Biology and Technology, 62(3): 267-274. [ Links ]
22. Paulen, R., M. Jelemenský, M. Fikar y Z. Kovács. 2013. Optimal balancing of temporal and buffer costs for ultrafiltration/diafiltration processes under limiting flux conditions. Journal of Membrane Science, 444: 87-95. [ Links ]
23. Perkins-Veazie, P. y J.K Collins. 2004. Flesh quality and lycopene stability of fresh-cut watermelon. Postharvest, Biology and Technology, 31(2): 159-166. [ Links ]
24. Quek, S., N. Chok y P. Swedlund. 2007. The physicochemical properties of spray-dried watermelon powders. Chemical, Engineering and Processing, 46(5): 386-392. [ Links ]
25. Rai, C., P. Rai, G. Majumdar, S. De y S. Das Gupta. 2010. Mechanism of permeate flux decline during microfiltration of watermelon (Citrullus lanatus) juice. Food and Bioprocess Technology, 3(4): 545-553. [ Links ]
26. Restrepo-Gallego, M. 2007. Sustitución de colorantes en alimentos. Revista Lasallista de Investigación, 4(1): 35-39. [ Links ]
27. Sharma, R., D. Kaur, D. Oberoi y D. Sogi. 2008. Thermal degradation kinetics of pigments and visual color in watermelon juice. International Journal of Food Properties, 11(2): 439-449. [ Links ]
28. Shi, X., Y. Xu, Y. Li, H. Zeng y Y. Sun. 2011. Optimization of extraction process of lycopene from watermelon (Citrullus lanatus) by response surface methodology. Applied Mechanics and Materials, 140: 385-393. [ Links ]
29. Tarazona-Díaz, M. y E. Aguayo. 2013a. Influence of acidification, pasteurization, centrifugation and storage time and temperature on watermelon juice quality. Journal of the Science of Food and Agriculture 93(15): 3863-3869. [ Links ]
30. Tarazona-Díaz, M., F. Alacid, M. Carrasco, I. Martínez y E. Aguayo. 2013b. Watermelon juice: potential functional drink for sore muscle relief in athletes. Journal of Agricultural and Food Chemistry, 61(31): 7522-7528. [ Links ]
31. Tarazona-Díaz, M., J. Viegas, M. Moldao-Martins y E. Aguayo. 2011. Bioactive compounds from flesh and by-product of fresh-cut watermelon cultivars. Journal of Science of Food and Agriculture, 91(5): 805-812. [ Links ]
32. Tlili, I., C. Hdider, M. Salvatore, I. Riadh, H. Jebari y G. Dalessandro. 2011. Bioactive compounds and antioxidant activities of different watermelon (Citrullus lanatus (Thunb.) Mansfeld) cultivars as affected by fruit sampling area. Journal of Food Composition and Analysis, 24: 307-314. [ Links ]
33. Vaillant, F., M. Cisse, M. Chaverri, A. Perez, M. Dornier, F. Viquez y C. Dhuique-Mayer. 2005. Clarification and concentration of melon juice using membrane processes. Innovative Food Science & Emerging Technologies, 6(2): 213-220. [ Links ]
34. Van Buggenhout, S., M. Alminger, L. Lemmens, I. Colle, G. Knockaert, K. Moelants, et al. 2010. In vitro approaches to estimate the effect of food processing on carotenoid bioavailability need thorough understanding of process induced microstructural changes. Trends in Food Science & Technology, 21(12): 607-618. [ Links ]
35. Wang, X., W. Liu, Z. Yan, S. Zhao, N. He, P. Liu y J. Dai. 2011. Changes of the contents of functional substances including lycopene, citrulline and ascorbic acid during watermelon fruits development. Scientia Agricultura Sinica, 44(13): 2738-2747. [ Links ]
36. Wenen, Z., L. Pin y G. Huihui. 2013. Studies on carotenoids in watermelon flesh. Agricultural Sciences, 4(7A): 13-20. [ Links ]