Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Bioagro
versión impresa ISSN 1316-3361
Bioagro vol.30 no.1 Barquisimeto abr. 2018
Capacidad antagónica in vitro de Trichoderma spp. frente a Rhizoctonia solani Kuhn y Fusarium verticillioides Nirenberg
Iraima C. Rodríguez1 y Joksan Flores1
1 Instituto de Química y Tecnología, Facultad de Agronomía, Universidad Central de Venezuela (UCV). Apdo. 4579. Maracay, Venezuela. e-mail: agronomia@agr.ucv.ve; iraima1408@gmail.com; joksanf@gmail.com
RESUMEN
La rizoctoniosis (Rhizoctonia solani) y la fusariosis (Fusarium verticillioides) son las enfermedades fúngicas de mayor relevancia en el cultivo de maíz, ocasionando pérdidas económicas y deterioro en la calidad de los granos. En este trabajo se determinó la capacidad antagónica in vitro de 16 aislamientos de Trichoderma spp. frente a R. solani y F. verticillioides, con el objeto de identificar aquellos aislamientos con mayor potencial para el control de los patógenos mencionados. Se realizaron pruebas de cultivo duales, utilizando platos Petri con medio papa dextrosa agar. La evaluación se realizó durante 14 días. Se empleó un diseño completamente al azar con cinco repeticiones por tratamiento. Los aislamientos de Trichoderma estudiados mostraron diferencias significativas en las variables de porcentaje de inhibición del crecimiento (PIC) y número de esclerocios formados en los enfrentamientos contra R. solani, y las variables de PIC y porcentaje de inhibición de la esporulación al enfrentar a F. verticillioides. Además, en general, se observaron tendencias a favor de la capacidad antagónica de Trichoderma en las variables de porcentaje de reducción de esclerocios, porcentaje de esclerocios parasitados y grado antagónico. Los aislamientos más promisorios frente a R. solani fueron Santa Lucía (F. koningii) y 06142 (Trichoderma croseum), mientras que frente a F. verticillioides fueron BAPSOS e I9 (ambos identificados como T. harzianum). Fusarium mostró una mayor resistencia a ser colonizado, en comparación a Rhizoctonia, por las especies evaluadas de Trichoderma.
Palabras clave adicionales: Control biológico, fusariosis, porcentaje de inhibición del crecimiento, rizoctoniosis
Antagonistic capacity of Trichoderma spp. in vitro against Rhizoctonia solani Kuhn and Fusarium verticillioides Nirenberg
ABSTRACT
The rizoctoniosis (Rhizoctonia solani) and scab (Fusarium verticillioides) are the most important fungal diseases in maize, causing economic losses and deterioration in the quality of the grains. In this research, the antagonistic capacity of Trichoderma spp. against R. solani and F. verticillioides was determined in vitro, in order to identify those isolates with the highest potential to control the mentioned pathogens. Dual culture tests were performed during 14 days, using Petri dishes with potato dextrose agar medium. The evaluation was conducted using a completely randomized design with five replicates. Trichoderma isolates showed significant differences in the variables of percentage of growth inhibition (PGI) and number of sclerotia formed in its interactions with R. solani, and the variables of PGI and percentage of sporulation inhibition in the interaction with F. verticillioides. Also, a general trend was observed favoring the antagonistic capacity of Trichoderma in the variables of percentage of reduction in the number of sclerotia, percentage of sclerotia parasitized and antagonistic degree. The most promising isolates against R. solani were Santa Lucía (T. koningii) and 06142 (T. croseum), while against F. verticillioides they were BAPSOS and I9 (both identified as T. harzianum). Fusarium showed greater resistance to colonization, when compared to Rhizoctonia, by the evaluated Trichoderma species.
Additional key words: Biocontrol, percentage of growth inhibition, rizoctoniosis, scab
Recibido: Mayo 18, 2017 Aceptado: Diciembre 4, 2017
INTRODUCCIÓN
La mancha bandeada o rizoctoniosis por Rhizoctonia solani y la pudrición del tallo y de la mazorca o fusariosis del maíz ocasionada por Fusarium verticillioides, son dos enfermedades que afectan a este cultivo en Venezuela. Cada una de ellas puede disminuir su rendimiento y ocasionar muerte de plantas (Cardona et al., 1999; García et al., 2006).
En Venezuela, el daño ocasionado por R. solani, ha venido ocupando lugares preponderantes en áreas maiceras de Portuguesa. Las lesiones causadas por este fitopatógeno se localizan en las hojas bandera, desde las cuales pueden avanzar hasta alcanzar las mazorcas (Rodríguez et al., 2003). Desde 1995, la presencia de la enfermedad se ha observado afectando tallos, hojas y mazorcas de las plantas con incidencias desde 32 hasta 90 %, caracterizadas por largas zonas decoloradas alternadas con bandas oscuras (Cardona et al., 1999).
En la Colonia Agrícola de Turén del estado Portuguesa, el hongo ha sido identificado por causar daños en maíz y en los últimos seis años ha ocasionado pérdidas en la cosecha por el orden del 75 % (Puentes y Mejías, 2003). Anteriormente esta enfermedad se asociaba en etapas avanzadas, pero desde 2003 se ha observado en etapas tempranas ocasionando pérdidas significativas en el rendimiento debido a la caída y muerte de plantas, además de un alto número de mazorcas enfermas.
Fusarium verticillioides, causante de la pudrición del tallo y de la mazorca, es capaz de colonizar el maíz durante todo el ciclo vegetativo de la planta incluyendo raíz, tallo, mazorca y en granos. En muchos casos, la presencia del hongo, no es perceptible, pues no causa daño visible en la semilla o en la plántula.
La importancia del control de estas enfermedades fúngicas (rizoctoniosis y fusariosis) no sólo radica en disminuir las pérdidas en rendimiento que ellas ocasionan, sino también en evitar la producción de fumonisinas sintetizadas por F. verticillioides, que tiene implicaciones en la calidad de los granos, en la salud pública y animal gracias a su gran poder toxigénico (Mazzani et al., 1999; García et al., 2006).
Las condiciones tropicales favorecen la incidencia de estos dos patógenos en el cultivo de maíz y en la actualidad su control se realiza con productos químicos, prácticas culturales y control biológico. Dentro de este último se están empleando fórmulas a base del hongo antagonista Trichoderma sp., el cual tiene comprobada acción sobre hongos del suelo como Rhizoctonia, Sclerotium y Fusarium (Fernandez, 2001; Infante et al., 2009; Guédez et al., 2012).
El uso de estas cepas comerciales no siempre tiene el efecto esperado y pueden presentar problemas con su persistencia en el suelo. Por esta razón se considera importante la obtención de aislamientos nativos del hongo antagonista, los cuales están mejor adaptados a las condiciones edafoclimáticas de la zona específica donde serán aplicados (González et al., 1999). Para lo cual se recomienda realizar pruebas in vitro que reflejen la capacidad y la variabilidad genética del antagonista, y la del fitopatógeno para resistir el antagonismo, permitiendo así la selección preliminar, para luego ser evaluados en condiciones de campo, determinando de esta forma su capacidad de inhibir o controlar el crecimiento del hongo fitopatógeno (Bell et al., 1982). Por tal motivo, se evaluó la capacidad antagónica de 16 aislamientos de Trichoderma provenientes de zonas agrícolas de los estados Aragua y Guárico frente a dos de los patógenos más importantes que afectan el cultivo de maíz (R. solani y F. verticillioides), con la finalidad de seleccionar los mejores y utilizarlos posteriormente en condiciones naturales.
MATERIALES Y MÉTODOS
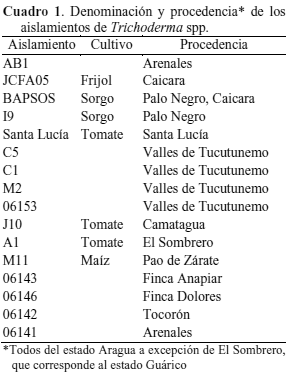
El estudio se realizó en el Laboratorio de Microbiología del Instituto de Química, Facultad de Agronomía de la Universidad Central de Venezuela. Se realizaron pruebas de enfrentamiento en cultivos duales entre 16 aislamientos de Trichoderma provenientes de algunas zonas agrícolas de los estados Aragua y Guárico y los patógenos Rhizoctonia solani y Fusarium verticillioides.
El aislamiento de R. solani se obtuvo mediante el método de siembra directa, a partir de muestras de material vegetal enfermo y esclerocios presentes en plantas de maíz con síntomas de rizoctoniosis, en una zona maicera de los Valles de Tucutunemo en el estado Aragua. El hongo aislado, una vez comprobada su patogenicidad en plantas de maíz, fue conservado en tubos de ensayo contentivos del medio papa dextrosa agar (PDA).
El aislamiento de F. verticillioides se aisló a partir de granos de maíz recién cosechados por el método de siembra directa en medio de cultivo malta sal agar. De las colonias fúngicas se tomó una muestra la cual fue sembrada en PDA, para su preservación y uso en las pruebas de enfrentamiento.
Los aislamientos de Trichoderma spp. utilizados pertenecen a la colección de hongos de la Clínica de Enfermedades de Plantas de la Facultad de Agronomía (UCV), los cuales se aislaron a partir de muestras de suelo de diferentes zonas agrícolas de los estados Aragua y Guárico (Cuadro 1). El método de siembra utilizado fue el de incorporación en placas y la siembra se realizó en el medio PDA. La incubación de las placas se hizo a 28 °C por un período de 3 a 5 días. Los aislamientos obtenidos se transfirieron a tubos de ensayo contentivos de PDA en cuña, se incubaron por 7 días y luego se conservaron a bajas temperaturas (5-10 °C).
Para evaluar el potencial antagónico de los aislamientos de Trichoderma spp. contra R. solani y F. verticillioides, se realizaron pruebas de cultivo dual, para ello se sembraron en la superficie de platos de Petri con PDA, discos de 5 mm de diámetro colonizados con micelio de Trichoderma en un lado de la cápsula y otro disco con micelio del patógeno en el otro extremo. El material se incubó por 14 días a temperatura ambiente y se realizaron las observaciones en el momento indicado para cada variable considerada.
Se realizaron 32 pruebas de enfrentamiento (16 aislamientos de Trichoderma vs R. solani y 16 aislamientos de Trichoderma vs F. verticillioides) con su testigo correspondiente (5 placas sólo con R. solani o F. verticillioides según el caso). Se utilizó un diseño completamente al azar de 34 tratamientos y cada tratamiento constó de cinco repeticiones, donde cada cápsula Petri se consideró una unidad experimental, para un total de 170 de placas.
En las interacciones evaluadas, se determinaron las siguientes variables: porcentaje de inhibición del crecimiento (PIC) y grado de antagonismo (GA). Para el caso de las combinaciones Trichoderma vs R. solani, se evaluó además de las indicadas, el porcentaje de reducción del número de esclerocios (PRE) y porcentaje de esclerocios parasitados (PEP), mientras que en los enfrentamientos entre Trichoderma vs F. verticillioides se determinó en adición el porcentaje de inhibición de la esporulación (PIE). Las mismas se midieron y analizaron como se indica a continuación:
Porcentaje de inhibición del crecimiento (PIC): Cada 24 h se midió el radio de la colonia del patógeno tanto en las interacciones como en los testigos, con ello se determinó el PIC mediante la fórmula: PIC = [(crecimiento del testigo-crecimiento del tratamiento)/ crecimiento del testigo] x 100. Los datos obtenidos se analizaron mediante Anova y prueba de Tukey.
Número de esclerocios formados (NEF): Culminada cada prueba de enfrentamiento, se contabilizó el número de esclerocios por placa, tanto en las placas testigo de R. solani como en las interacciones, y los resultados fueron cotejados con el testigo mediante la prueba de Dunnett.
Porcentaje de reducción de esclerocios (PRE): Para el cálculo de PRE se utilizó la siguiente fórmula: PRE= [(N° promedio de esclerocios formados en placas testigo de R solani - N° promedio de esclerocios formados en la interacción Trichoderma vs R. solani)/N° promedio de esclerocios formados en placas testigo de R. solani] x 100. Los resultados fueron analizados de manera descriptiva.
Parasitismo de esclerocios (PEP): Una vez culminadas las mediciones de crecimiento en las diferentes interacciones (Trichoderma vs R. solani), se tomó un tercio de los esclerocios formados/tratamiento y se desinfectaron por 30 s con hipoclorito de sodio al 3,5 %, luego se lavaron en agua destilada estéril, se secaron en papel de filtro estéril y se sembraron en PDA. El material se incubó por 5 días a la espera de que se desarrollara R. solani o Trichoderma a partir de los esclerocios sembrados. El PEP se obtuvo mediante la fórmula: PEP = [N° de esclerocios parasitados por Trichoderma/N° de esclerocios evaluados en cada tratamiento] x 100. Los resultados fueron analizados de manera descriptiva.
Grado de antagonismo (GA): Se midió según la escala utilizada por Bell et al. (1982) y Askew y Laing (1994), descrita a continuación y la cual relaciona el avance del crecimiento de Trichoderma frente al del patógeno. Clase 1: Trichoderma crece completamente sobre el patógeno y cubre toda la superficie del medio; clase 2; Trichoderma crece al menos sobre dos tercios de la superficie del medio; clase 3; Trichoderma coloniza el 50 % del medio y ningún organismo aparece dominado por el otro; clase 4: El patógeno coloniza al menos dos tercios de la superficie del medio; clase 5: El patógeno crece completamente sobre la superficie del medio.
Las evaluaciones se realizaron a los 5, 7, 10 y 14 días. Se consideró que un aislamiento era antagonista si presentaba la clase 1 ò 2 y no antagonista si se encontraba en las clases 3, 4 ó 5. El análisis de los resultados se efectuó de forma descriptiva.
Porcentaje de inhibición de la esporulación (PIE): Una vez finalizadas las pruebas de enfrentamiento (Trichoderma vs F. verticillioides), con el uso de la cámara de Neubauer, se realizó el contaje de conidios del patógeno por mL de solución según la metodología de French y Herbert (1980) y se calculó el PIE de acuerdo a la fórmula: PIE = [(Esporulación del testigo - esporulación del tratamiento)/ Esporulación del testigo] x 100.
Se realizaron cinco contajes de conidios/interacción. Los valores de PIE obtenidos de los 16 aislamientos de Trichoderma spp. fueron comparados utilizando Anova y prueba de Tukey.
Se identificaron los aislamientos de Trichoderma que resultaron más destacados en cuanto a su capacidad de controlar in vitro el crecimiento y producción de estructuras reproductivas tanto para el caso de F. verticillioides como de R. solani. La identificación se realizó mediante el método convencional, el cual contempló una descripción macroscópica y microscópica, y la comparación con las claves micológicas especializadas de Bissett (1991a; 1991b) y Rifai (1969).
Resultados Y DISCUSIÓN
Se evidenció la presencia de grupos estadísticamente diferentes, que variaron dependiendo del aspecto evaluado y de su interacción con el patógeno, F. verticillioides o R. solani. A pesar de las diferentes características de crecimiento y formación de estructuras reproductivas (conidios y esclerocios) que hay entre los patógenos mencionados, todos los aislamientos de Trichoderma spp., lograron inhibir significativamente el crecimiento micelial de ambos hongos (Cuadros 2 y 3); sin embargo, se evidenció que el control in vitro fue superior en el enfrentamiento contra Rhizoctonia.
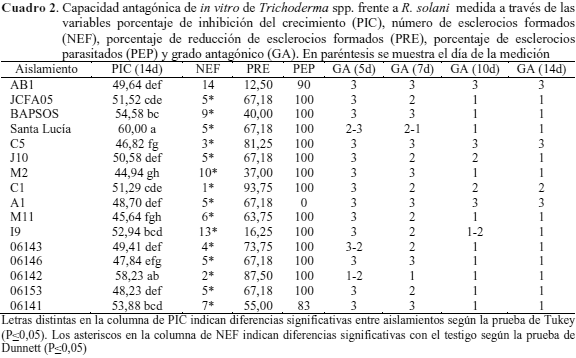
Porcentaje de inhibición del crecimiento (PIC) de Trichoderma spp. frente a R. solani. Todos los tratamientos inhibieron significativa-mente el crecimiento de R. solani. La mitad de los aislamientos presentó una inhibición superior al 50 %. Se destacan los aislamientos Santa Lucía, 06142, BAPSOS y 06141 con 60,0; 58,23; 54,58 y 53,88 % PIC, respectivamente (Cuadro 2). Estos resultados concuerdan con los obtenidos por Hernández et al. (2006), quienes en condiciones similares obtuvieron un PIC de 53 y 58 % cuando evaluaron a T. harzianum A-53 y A-34 contra R. solani. En una investigación reciente (Pérez et al., 2018) se encontró que la misma cepa A-34 de T. harzianum fue muy efectiva en el control de las enfermedades fúngicas mancha parda, pudrición de la vaina y tizón del arroz con niveles de eficiencia entre 70 y 90 %.
Reducción de esclerocios. Una vez finalizadas las pruebas de enfrentamiento, se determinó el NEF/interacción y se observaron diferentes niveles de reducción del número de esclerocios en las combinaciones evaluadas (Cuadro 2). Comparando el NEF en las placas testigo de R. solani con el obtenido en las pruebas de enfrentamiento, se encontró que todos los aislamientos de Trichoderma spp. evaluados, excepto AB1, lograron inhibir apreciablemente la formación de esclerocios. La menor cantidad de esclerocios formados ocurrió en la interacción con los aislamientos C1 y 06142, donde el promedio fue de 1 y 2 esclerocios por placa, respectivamente, muy inferior al promedio de las placas testigo (16 esclerocios por placa), mientras que la mayor formación de esclerocios la permitieron los aislamientos I9 y AB1 con 13 y 14 esclerocios por placa.
Con los resultados obtenidos se calcularon los porcentajes de reducción de esclerocios (PRE) derivados de los enfrentamientos de los 16 aislamientos de Trichoderma spp. sobre R. solani, los cuales oscilaron entre 93,7 y 12,5 % (Cuadro 2). La capacidad de reducir el número de esclerocios es una cualidad particularmente importante en hongos antagonistas, ya que tales estructuras permiten la sobrevivencia de algunos hongos en el suelo, entre ellos Rhizoctonia, por tanto cualquier efecto en disminuir su formación tiene consecuencias positivas en el cultivo susceptible y una reducción significativa en la fuente de inóculo para próximas siembras. Sobre este particular Durman et al. (1999) señalan una disminución en el crecimiento y la supervivencia de esclerocios de R. solani al aplicar aislamientos de Trichoderma spp., con resultados satisfactorios en el control de este patógeno en tomate bajo condiciones de invernadero.
Parasitismo de esclerocios. De las interacciones evaluadas, se distinguen tres grupos, el primero de ellos el conformado por AB1 y 06141 con un parasitismo parcial de 90 y 83 %, respectivamente, el segundo por A1 con 0 % de parasitismo y el último grupo formado por los 13 aislamientos restantes, con 100 % de parasitismo (Cuadro 2). Esta capacidad de hiperparasitismo ha sido señalada por Cundom et al. (2000) quienes señalan parasitismo total de esclerocios de R. solani, Sclerotinia sclerotiorum y Sclerotium rolfsii con el uso de Trichoderma spp. En las interacciones de Trichoderma 06141 y AB1 frente R. solani el hiperparasitismo de los esclerocios fue parcial, lo que pudiera ser una señal de una baja producción de metabolitos secundarios como carboximetilcelulosa y proteasas, responsables de la degradación de la pared celular de los esclerocios de Rhizoctonia, como lo afirman Stefanova et al. (1999).
Grado de antagonismo. Para el quinto día no se encontraron diferencias muy notorias entre los tratamientos, aun cuando se destacaron los aislamientos 06142 y Santa Lucía al alcanzar las mejores clases antagónicas, 1-2 y 2-3, respectivamente (Cuadro 2). Sin embargo, Alarcón et al. (2005) señalaron un aislamiento de T. harzianum con mayor agresividad frente a Rhizoctonia solani, el cual logró la clase antagónica 1 a los 5 días.
A los 7 días el aislamiento 06142 fue el único en alcanzar la clase antagónica 1, lo cual diferencia a 06142 del resto, indicando así que este aislamiento tiene la mayor capacidad de colonizar a Rhizoctonia en comparación a los restantes.
El grado antagónico entre los distintos tratamientos fue homogéneo a los 10 y 14 días; sin embargo, existe heterogeneidad en las clases antagónicas obtenidas en las distintas interacciones (Cuadro 2), las cuales variaron de la clase 3 (no antagónica) a la clase 2 y 1 (clases antagónicas).
Dada la agresividad y consistencia de los aislamientos Santa Lucía y 06142 ante las variables estudiadas, frente a Rhizoctonia, se puede asegurar que en condiciones in vitro son los aislamientos más antagónicos de los 16 evaluados (Cuadro 2). El hecho de que los aislamientos de Trichoderma mencionados, tuvieran contacto rápidamente con Rhizoctonia y lo cubrieran en su totalidad en 5 a 7 días, evidencia que crecen pronto y tienen agresividad; en este sentido Michel et al. (2013) señalaron que existe una gran agresividad de Trichoderma spp. y susceptibilidad de S. rolfsii, cuando se colocan en cultivos apareados, siendo el aislado Tcn-11 el que se desarrolló más rápido (50,80 mm), lo que demuestra mayor agresividad hacia el patógeno; mientras que la cepa Tcn-7 no presentó agresividad y creció sólo 27,5 mm. Ello confirma, que la velocidad de crecimiento que presentan las especies de Trichoderma es una característica de agresividad y competitividad que este microorganismo posee como antagonista para el control de hongos fitopatógenos (Cook y Baker, 1983).
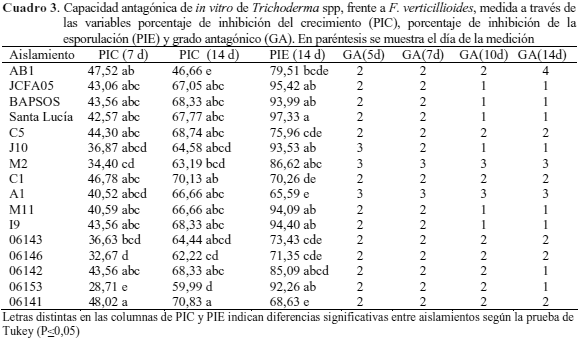
Porcentaje de inhibición del crecimiento (PIC) de F. verticillioides frente a Trichoderma spp. Los valores de PIC obtenidos en las interacciones de Trichoderma spp. y F verticillioides a los 7 días demuestran la formación de 5 grupos estadísticamente homogéneos (P≤0,05), siendo los aislamientos 06141 y AB1 los que mostraron los mayores PIC con 48,02 y 47,52 %, respectivamente, mientras que M2 (34,40 %), 06146 (32,67 %) y 06153 (28,71 %) presentaron los menores valores (Cuadro 3). Hernández et al. (2006) obtuvieron PIC de 48 % sobre F. subglutinans con el uso de T. atroviride y T. harzianum en el día 7 de evaluación, siendo estos valores similares a los conseguidos por 06141 (PIC = 48,02) y AB1 (PIC = 47,52) sobre F. verticillioides.
Así mismo, los PIC obtenidos a los 7 y 14 días de enfrentamiento de Trichoderma spp. contra F. verticillioides (Cuadro 3), parecen indicar que a medida que avanza el tiempo de enfrentamiento, aumenta la capacidad de biocontrol del antagonista frente al patógeno en referencia. Esta tendencia se observó en 15 de los 16 aislamientos ensayados (todos excepto AB1). Altuna et al. (2003) realizaron por separado, pruebas de enfrentamiento in vitro entre Trichoderma spp. y dos formas especiales de F. oxysporum [cubense (musáceas) y lycopersici (tomate)], el primero de los autores reportó PIC de 16 a 20 % a los 5 días, mientras los segundos obtuvieron PIC de 49 % a los 8 días. Esto pudiera ser indicativo de que al estudiar un mismo patógeno se pueden obtener diferentes valores de PIC, dependiendo del día que se realice la medición, por lo que resulta conveniente evaluar las interacciones patógeno-antagonista por largos períodos de tiempo, a fin de detectar si el patógeno tiene la capacidad de adaptarse y desarrollar algún mecanismo de defensa que le ayude a resistir y contraatacar a un posible antagonista.
De igual forma, al comparar los aislamientos de Trichoderma que lograron los PIC más altos frente a Fusarium (06141 y AB1) con los obtenidos con Rhizoctonia (Santa Lucía, 06142) se observa que no hubo coincidencia, dando lugar a señalar que existió diferencia en la capacidad antagónica y en la especificidad de acción del antagonista contra el patógeno. Tal como lo indican Carvajal et al. (2008) quienes muestran que el comportamiento micoparasítico de los aislamientos de Trichoderma spp. varía según se trate de Sclerotium rolfsii o Rhizoctonia solani, evidenciando una amplia especificidad del antagonista por su sustrato por lo que recomiendan realizar cuidadosas selecciones del aislamiento de Trichoderma que se utilice en programas de control de fitopatógenos.
Porcentaje de inhibición de la esporulación (PIE). Los valores de PIE obtenidos a partir de las diferentes interacciones hongo-antagonista muestran diferencias significativas entre los aislamientos, los cuales fueron agrupados de acuerdo a la prueba de Tukey en 5 categorías (Cuadro 3). Los PIE variaron entre 65,59 a 97,33 %, siendo los aislamientos Santa Lucía y JCFA05, los que mostraron los valores más altos (97,33 y 95,42 %, respectivamente), mientras que los más bajos lo manifestaron 06141 (68,63 %) y A1 (65,59 %).
Todos los aislamientos de Trichoderma lograron reducir significativamente la cantidad de macro y microconidios producidos por Fusarium al ser comparado con el testigo. Resultados estos similares a los obtenidos por Altuna et al. (2003) quienes encontraron un PIE de 77 % a los 8 días, cuando evaluaron in vitro a Trichoderma spp. y F. oxysporum f. sp. lycopersici. Castillo (2005) (datos no publicados), consiguió un PIE de 72 y 81 % a los 5 días, al enfrentar a Trichoderma spp. y F. oxysporum f. sp. cubense.
Cabe señalar, que en algunas interacciones Fusarium-Trichoderma, se presentaron relaciones entre las variables evaluadas diferentes a las esperadas, tal es el caso de las observadas con los aislamientos 06141 y C1, quienes a los 14 días de enfrentamiento evidenciaron altos valores de PIC (70,83 y 70,13 %, respectivamente) acompañados de PIE relativamente bajos (68,63 % y 70,26 %) en comparación con el obtenido en otras interacciones (> 90 %). Caso contrario se observó con 06153 quien redujo significativamente la esporulación (PIE=92,26 %), pero fue el que menos inhibió el crecimiento micelial (PIC = 28,71 %).
Grado de antagonismo (GA). Los aislamientos evaluados expresaron diferentes respuestas y clases antagónicas en el tiempo. C5, C1, 06143, 0614606141, M2 y A1 mantuvieron constantes sus clases antagónicas del día 5 hasta el 14, mientras que BAPSOS, I9, JCFA05,Santa Lucía y M11 lograron mejores clases antagónicas a medida que transcurría el tiempo, por último AB1 paso de la clase 2 a una no antagónica (clase 4) a los 14 días (Cuadro 3). Estas diferencias en los resultados obtenidos demuestran la alta variabilidad en la actividad antagónica de los diferentes aislamientos de Trichoderma sp. Ello pudiera estar relacionado con el origen de las cepas del antagonista, tal como lo señala Agamez (2009), quien menciona que probablemente la naturaleza nativa de los aislados, favorece a la afinidad que determinadas especies de Trichoderma puedan tener por un fitopatógeno en especial.
Al evaluar y analizar el comportamiento de Trichoderma spp. ante las variables estudiadas (PIC, PIE y GA) (Cuadro 3) se puede señalar que los aislamientos BAPSOS, I9, JCFA05 y Santa Lucía destacaron como los de mayor actividad antagónica in vitro frente a F. verticillioides; sin embargo, tomando en consideración que sólo se debían seleccionar dos aislamientos y que presentaban respuestas similares ante las variables señaladas, se tomó como referencia principal el PIC a la hora de escoger dentro de los cuatro indicados, a los que se iban a identificar. Los otros aislamientos fueron preservados para estudios posteriores y forman parte de la colección del laboratorio.
Identificación de los aislamientos de Trichoderma spp., con mayor capacidad antagónica in vitro. Los dos aislamientos con mayor capacidad antagónica in vitro frente a R. solani (06142 y Santa Lucía) y F. verticillioides (BAPSOS e I9) fueron identificados como Trichoderma croseum (06142), T. koningii (Santa Lucía) y T. harzianum (BAPSOS e I9), con base a sus características macro y microscópicas y su comparación con las claves micológicas de Bissett (1991; 1991b) y Rifai (1969) (Cuadro 4). Es de resaltar que los aislamientos de Trichoderma seleccionados resultaron diferentes para ambas especies de hongos fitopatógenos evaluados (R. solani y F. verticillioides) lo cual parece reafirmar que existe especificidad entre el antagonista y el patógeno y que la misma depende del aislamiento de Trichoderma en particular y no de la especie a la que pertenece, así como de su capacidad para atacar en forma concreta a cepas determinadas de hongos fitopatógenos (Hoyos et al., 2008). Ello ha sido particularmente observado en hongos formadores de esclerocios (Sclerotium rolfsii y Rhizoctonia solani) (Howell, 2006).
Se conoce que para el manejo de hongos del suelo, tales como R. solani y F. verticillioides, se deben poner en práctica varias estrategias de control, entre ellas el realizar aplicaciones de biocontroladores de manera preventiva, por lo tanto para que ello sea posible, es necesario no solo el elegir in vitro los aislamientos del antagonista que tengan una velocidad mayor de crecimiento que los patógenos a controlar, tal como ocurrió en esta investigación, sino el evaluar su capacidad antagónica bajo condiciones de umbráculo y de campo, y estudiar la posibilidad de utilizar mezclas de estos aislamientos en búsqueda de una acción combinada o sinergística que pueda ser traducida a un mayor control.
Conclusiones
Las variables utilizadas de porcentaje de inhibición del crecimiento (PIC) y de esporulación (PIE), grado antagónico (GA), porcentaje de reducción del número de esclerocios (PRE) y porcentaje de esclerocios parasitados (PEP) para R. solani y PIC, PIE y GA para F. verticillioides resultaron en conjunto suficientemente potentes para discriminar los aislamientos de Trichoderma más promisorios contra los patógenos en estudio; sin embargo, para el caso de los enfrentamientos contra Rhizoctonia prevaleció como criterio final de elección la variable GA, mientras que para Fusarium lo fue PIC.
Tomando como referencia los criterios mencionados, los aislamientos con mayor capacidad antagónica in vitro contra R. solani fueron 06142 (T. croseum) y Santa Lucía (T. koningii); mientras que contra F. verticillioides lo fueron I9 y BAPSOS (ambos T. harzianum).
De los patógenos estudiados, F. verticillioides fue el que mostró mayor resistencia al avance y colonización, frente a los aislamientos de Trichoderma spp. evaluados.
agradecimiento
A la Unidad de Servicio de Bacteriología de la Facultad de Agronomía (UCV), por facilitar materiales y suministros empleados en los ensayos de laboratorio y al personal técnico del Laboratorio de Microbiología, por colaborar en la preparación de los medios y reactivos utilizados. A Nelly Sanabria del Instituto de Botánica, al suministrar los aislamientos de R. solani y Trichoderma, y a Claudio Mazzani, del Instituto de Química y Tecnología, por haber facilitado el aislamiento de F. verticillioides.
LITERATURA CITADA
1. Agamez, E., J. Barrera y L. Oviedo. 2009. Evaluación del antagonismo y multiplicación de Trichoderma sp. en sustrato de plátano en medio líquido estático. Acta Biológica Colombiana 14(3): 1-9. [ Links ]
2. Alarcón, L., T. Rondón, G. Rodríguez y A. Pupo. 2005. Efectividad in vitro de Trichoderma harzianum (Rifai) en el biocontrol de Rhizoctonia solani Kühn y Pyricularia grisea (Sacc) en el cultivo de arroz (Oryza sativa L.). Fitosanidad 9(3): 57-60. [ Links ]
3. Altuna, G., N. Sanabría, C. Jiménez y M. Alcano. 2003. Control biológico in vitro de Fusarium oxysporum f. sp. Lycopersici causante de la marchitez en tomate (Lycopersicon esculentum L.). Fitopatol. Venez. 16(2): 49 (Resumen). [ Links ]
4. Askew, D. y M. Laing. 1994. The in vitro screening of 118 Trichoderma isolate for antagonism to Rhizoctonia solani and an evaluation of different environmental sites of Trichoderma as sources of aggressive strains. Plant and Soil 159: 277-181. [ Links ]
5. Bell, D., H. Wells y C. Markham. 1982. In vitro antagonism of Trichoderma species against six fungal plant pathogens. Phytopathology 72(49): 379-380. [ Links ]
6. Bissett, J. 1991a. A revision of the genus Trichoderma III. Section Pachybasium. Canadian Journal of Botany 69: 2373-2417. [ Links ]
7. Bissett, J. 1991b. A revision of the genus Trichoderma IV. Additional notes on section Longibrachiatum. Canadian Journal of Botany 69: 2418-2420. [ Links ]
8. Cardona, R., H. Rodríguez y H. Nass. 1999. Manchas bandeadas en maíz causada por Rhizoctonia solani en el estado Portuguesa, Venezuela. Fitopatol. Venez. 12(2): 32-33. [ Links ]
9. Cook, R. y K. Baker. 1983. The nature and practice of biological control of plant pathogens: American Society of Phytopathology. Stn Paul, Minnesota. 539 p. [ Links ]
10. Cundom, M., S. Mazza, M. Mazzanti y S. Gutiérrez. 2000. Evaluación de Trichoderma spp. contra Rhizoctonia solani in vitro e invernáculo. Universidad Nacional del Nordeste. http://www1.unne.edu.ar/cyt/2001/5-Agrarias/A-051.pdf (consulta del 20/11/2015). [ Links ]
11. Durman, S., A. Menéndez y A. Godeas. 1999. Evaluation of Trichoderma spp. as antagonistic of Rhizoctonia solani in vitro and as biocontrol in greenhouse tomato plants. Revista Argentina de Microbiología 31: 13-18. [ Links ]
12. Fernandez-Larrea, O. 2001. Microorganismos antagonistas para el control control fitosanitario. Manejo Integrado de Plagas 62: 96-100. [ Links ]
13. French, E. y T. Hebert. 1980. Métodos de Investigación Fitopatológica. Editorial IICA. pp. 176-179. [ Links ]
14. García, R., R. Riera, C. Zambrano y L. Gutiérrez. 2006. Desarrollo de un fungicida biológico a base de la cepa del hongo Trichoderma harzianum proveniente de la Región Andina Venezolana. Fitosanidad 10(2): 115-121. [ Links ]
15. González, S., A. Puertas, M. Fonseca, E. Suarez y R. Blaya. 1999. Actividad antagónica de Trichoderma sp. aislada de un suelo de la provincia Granma, Cuba frente a Alternaria solani Sor. Revista de la Facultad de Agronomía 16: 167-173. [ Links ]
16. Guédez, C., L. Cañizalez, C. Castillo y R. Olivar. 2012. Evaluación in vitro de aislamientos de Trichoderma harzianum para el control de Rhizoctonia solani, Sclerotium rolfsii y Fusarium oxysporum en plantas de tomate. Revista de la Sociedad Venezolana de Microbiología 32: 44-49. [ Links ]
17. Hernández, A., A. Sierra y A. Carr. 2006. Evaluación in vitro del antagonismo de especies de Trichoderma sobre hongos fitopatógenos que afectan las vitroplantas de piña Ananas comosus (L.) Merr. Revista de Fitosanidad 10(2): 105-108. [ Links ]
18. Howell, C. R. 2006. Understanding the mechanisms employed by Trichoderma virens to effect biological control of cotton diseases. Phytopathol. 96(2): 178-180. [ Links ]
19. Hoyos-Carvajal, L., P. Chaparro, M. Abramsky, I. Chet. y S. Orduz. 2008. Evaluación de aislamientos de Trichoderma spp. contra Rhizoctonia solani y Sclerotium rolfsii bajo condiciones in vitro y de invernadero. Agronomía Colombiana 26(3): 451-458. [ Links ]
20. Infante, D., B. Martínez, N. González y Y. Reyes. 2009. Mecanismos de acción de Trichoderma frente a hongos fitopatógenos. Revista de Protección Vegetal 24(1): 14-21. [ Links ]
21. Mazzani, C., O. Borges, O. Luzón, V. Barrientos y P. Quijada. 1999. Incidencia de Aspergillus flavus Fusarium verticillioides, aflatoxinas y fumonisinas en ensayos de híbridos de maíz en Venezuela. Fitopatol. Venez. 12: 9-13. [ Links ]
22. Michel-Aceves, A., M. Otero-Sánchez, R. Ariza-Flores, A. Barrios-Ayala, N. Alarcón-Cruz. 2013. Eficiencia biológica de cepas nativas de Trichoderma spp., en el control de Sclerotium rolfsii Sacc. en cacahuate. Avances en Investigación Agropecuaria 17(3): 89-107. [ Links ]
23. Pérez-Torres, E., A. Bernal-Cabrera, P. Milanés-Virelles, Y. Sierra-Reyes, M. Leiva-Mora, S. Marín-Guerra et al. 2018. Eficiencia de Trichoderma harzianum y sus filtrados de cultivo en el control de tres enfermedades fúngicas foliares en arroz. Bioagro 30(1): 17-26. [ Links ]
24. Puentes, R. y J. Mejías. 2003. Taspa (propiconazole + difenoconazole) fungicida sistémico como alternativa para el manejo de Rhizoctonia solani, en maíz. Fitopatol. Venez. 16(29): 52 (resumen). [ Links ]
25. Rifai, C. 1969. A revisión of the Trichoderma. Commonwealth Mycologycal Institute. Kew Survey, England. Mycological Papers 116: 1156. [ Links ]
26. Rodríguez, H., L. Rodríguez y G. Zambrano. 2003. Período crítico para la inoculación con esclerocios de Rhizoctonia solani en el desarrollo de la lesión de maíz. Fitopatol. Venez. 16(1): 22-23. [ Links ]
27. Stefanova, M., A. Leiva, L. Larrinaga y F. Coronado. 1999. Actividad metabólica de cepas de Trichoderma spp. para el control de hongos fitopatógenos del suelo. Revista Facultad de Agronomía (LUZ) (16): 509-516. [ Links ]