Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Salus
versão impressa ISSN 1316-7138
Salus vol.17 supl.1 Valencia dez. 2013
Cambios morfológicos, proteicos, glicoproteicos y antigénicos de Trypanosoma cruzi cultivado en medio axénico con tensiones de oxígeno diferentes
Diana Graterol1, Rosa Yanet Arteaga1, Ángel Castillo1, Gabriel Díaz1, Oriana Mundaray1, Wilmer Pineda1, María Consuelo Navarro1, María Isabel Domínguez1, Ana Rita De Lima1, Víctor Tulio Contreras2
1 Laboratorio de Protozoología. Instituto de Biología Molecular de Parásitos (BioMolP). Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Edo. Carabobo, Venezuela.
2 Facultad Experimental de Ciencias y Tecnología (FACYT). Universidad de Carabobo. Valencia, Edo. Carabobo, Venezuela
Correspondencia: Víctor T. Contreras. E-mail: convictu@cantv.net
RESUMEN
Se ha reportado cultivo axénico de amastigotas de Trypanosoma cruzi derivados de epimastigotas. Se cuestiona si formas redondas en cultivos axénicos son verdaderos amastigotas. Aquí se compararon los cambios biológicos y moleculares de epimastigotas creciendo en alta y baja tensión de oxígeno. T. cruzi (EPm6) se creció en frascos con diferentes alturas de medio LITB (condición horizontal 3 mm y vertical 83 mm). Se colectaron masas de parásitos de diferentes tiempos de crecimiento para análisis proteico, glicoproteico y antigénico. Se estudiaron los cambios morfológicos, incremento de inóculo y resistencia al complemento por microscopia de fases y tinción con Giemsa. Los cambios proteicos y glicoproteicos se compararon por SDS-PAGE. Los cambios antigénicos se analizaron por Western blot con suero de conejo y anticuerpos IgY contra formas amastigotas. En condición vertical, los epimastigotas mantuvieron su morfología típica a lo largo de la curva de crecimiento y no mostraron cambios moleculares significativos. En condición horizontal al 4to y 6to día predominaron formas redondas con capacidad de resistir la lisis por complemento. A partir del 4to día se observaron cambios en los perfiles proteicos y glicoproteicos, concomitantemente con los cambios morfológicos. El suero anti-amastigotas reveló un antígeno amastigota-específico transitorio de 55 kDa en parásitos de 4 días en la condición horizontal, mientras el anticuerpo IgY anti-amastigotas no reveló diferencias entre parásitos creciendo en ambas condiciones. Estas evidencias sugieren que epimastigotas de T. cruzi condicionados a sobrevivir en alta tensión de oxígeno puede mimetizar propiedades biológicas y antigénicas propias del estadio amastigota.
Palabras Clave: Trypanosoma cruzi, tensión de oxígeno, formas redondas, cultivo axénico.
Morphological, protein, glycoprotein and antigenic changes of Trypanosoma cruzi cultured in axenic medium with different oxygen tensions
ABSTRACT
Axenic culture of epimastigote-derived amastigotes of Trypanosoma cruzi has been reported. Have been inquired why round forms appear in culture media and if are true amastigotes. Our proposal was study molecular and biological changes in epimastigotes growing in high and low oxygen tension. T. cruzi (EPm6) were grown in flasks with different height of LITB medium (horizontal condition 3 mm and vertical 83 mm). Parasites were collected masses of different times of growth for proteins, glycoproteins and antigenic analysis. Morphological changes, increase of inoculum and resistance to complement lyses were studied in phases microscopy and Giemsa-stained smears. Protein and glycoprotein changes were compared by SDS-PAGE. Antigenic changes were analyzed by Western blot with rabbit serum and IgY antibody against amastigote forms. In vertical condition, the epimastigote maintained its typical morphology along the growth curve and not showed significant molecular changes. In horizontal condition round forms prevailed at 4 and 6 days with capacity to resist lyses by complement. From the 4th day changes in proteins and glycoproteins profiles were observed, concomitantly with the morphological changes. Anti-amastigotes serum revealed a 55 kDa transitory amastigote-specific antigen in four day parasites from horizontal condition, while IgY antibody anti-amastigotes dont revealed differences between parasites grown in both conditions. These evidences suggest that epimastigotes of T. cruzi conditioned to survive in high oxygen tension can mimic biological and antigenic properties own the amastigote-stage.
Key Words: Trypanosoma cruzi, oxygen tension, round forms, axenic culture.
INTRODUCCIÓN
En su ciclo vital, T. cruzi, agente causal de la enfermedad de Chagas, transita por distintos microambientes y en cada uno de ellos presenta estadios con morfologías diferentes. Se presume que factores microambientales específicos afectan estas morfologías. El cultivo axénico de T. cruzi, permite mantener el parásito en el laboratorio sin usar un modelo animal y sin la laboriosidad que demanda el cultivo de tejido y células in vitro. T. cruzi cultivado en tubos o erlenmeyer, en reposo y a temperatura ambiente (27°C) crece según una curva sigmoidea con tres fases: latencia, exponencial y estacionaria (1); siendo la morfología predominante epimastigota. La forma de la curva y los parásitos varía si crecen en agitación y con inóculos altos, porque rápidamente agotan el medio y entran en fase estacionaria (2).
Las formas redondas (esferomastigotas) que aparecen al inicio de la fase logarítmica y en la fase estacionaria tardía de T. cruzi en medios axénicos, no son iguales. Tyler y Engman (3) propusieron que las formas redondeadas al inicio son formas epimastigotas redondeadas con flagelo corto, producto de la presencia de glucosa en el medio y su depleción conduce a epimastigotas típicos. Las formas redondeadas presentes en la fase estacionaria son formas en degeneración producto de la toxicidad del medio. Se ha sugerido que la hipertonía del microambiente en tripanosomas africanos afecta la morfología del parásito (4). Ellenbogen et al (5) observaron que al aumentar la temperatura, en cultivos sucesivos de Crithidia fasciculata, se incrementaba el porcentaje de formas redondeadas. Efecto que era prevenido
aumentando la osmolaridad con NaCl en los medios de cultivo, cuando la temperatura se incrementaba hasta 32°C. Andrade y Almeida (6) cultivaron Herpetomonas samuelpessoai en tubos de ensayo (15 x 150 mm), variando la tensión de oxígeno disuelto (TOD) en función de la altura de la columna de medio (60, 160 y 260 mm) con volúmenes diferentes. Observaron que una caída en la TOD y consecuentemente del pH, provocaba la ocurrencia de formas de transición. Ellos destacaron la importancia de la TOD en la morfogénesis de este tripanosomatideo.
Para garantizar la reproducibilidad de fenómenos de diferenciación como metaciclogénesis, amastigogénesis y epimastigogénesis de T. cruzi en medios axénicos es necesario trabajar con poca altura de medio para ofrecer adecuada TOD (7). Graterol et al (8) reportaron que durante la epimastigogénesis de T. cruzi, la duración de la morfología amastigotas en su transición desde tripomastigota sanguíneo a epimastigota se reduce cuando se incrementa la altura del medio por exponer los parásitos a una condición de hipoxia. Se ha reportado la obtención de amastigotas de T. cruzi y su mantenimiento en cultivos, a partir de formas epimastigotas adaptadas a microambientes particulares en temperatura, nutrientes y tensión de oxígeno (9,10).
Aun en estudios de morfogénesis de tripanosomatideos, se cuestiona cuándo se está frente a un amastigotas genuino, en contraste a flagelados redondeados. Por lo que se ha recurrido a incluir en la valoración criterios morfológicos finos, expresión génica, propiedades biológicas, y características metabólicas y antigénicas (11). Estos criterios han sido complementados proponiendo como fundamental que el estadio en cuestión cumpla con la secuencia natural de eventos que ocurren en el ciclo natural del parásito (7).
En este trabajo, se compara el crecimiento de T. cruzi en dos condiciones ambientales diferentes, analizando los cambios biológicos y moleculares para evidenciar sí un estadio acondicionado en un microambiente puede mimetizar propiedades biológicas y antigénicas genuinas de otro estadio.
MATERIALES Y MÉTODOS
Parásitos y estadios. Se trabajó con Trypanosoma cruzi MHOM/Ve/1967/EPm6 EPm6, tipificado genéticamente como perteneciente al linaje filogenético TcI. El parásito fue clonado y mantenido por pases sucesivos alternos triatomino/ratón (12). Los estadios epimastigota y amastigota extracelular secundario (AES) usado como control se obtuvieron en medio LITB (2) y medio MEMTAU (13), respectivamente. Para el análisis morfológico, resistencia al complemento y análisis molecular, se emplearon parásitos de diferentes días (0 a 12 días) de la curva de crecimiento de las condiciones vertical y horizontal, respectivamente. Para el análisis molecular, los parásitos se procesaron como descrito previamente (8).
Crecimiento de parásitos en la condición vertical y horizontal. Se siguió el protocolo utilizado para epimastigogénesis por Graterol y col. (8). Las curvas de crecimiento de los flagelados se hicieron por triplicado incubando los parásitos en 35 mL de medio LITB a 27ºC por tiempos variables entre 0 y 12 días. La condición vertical correspondiente a bajo tenor de oxígeno, se realizó en tubos cónicos de polipropileno (50 mL) para una altura de 83 mm, y la condición horizontal correspondiente a alto tenor de oxígeno, en frascos de cultivo de poliestireno (T-160 cm2) para una altura de 3 mm. Los inóculos de flagelados empleados en cada condición oscilaron entre 2 y 3 x 106 parásito/mL. Se hizo recuento diferencial bajo microscopía de contraste de fases para estimar (a) incremento del inóculo (Nt/N0); (b) porcentaje de epimastigotas; (c) porcentaje de formas redondas y formas en diferenciación; (d) porcentaje de metacíclicos y (e) porcentaje de formas inmóviles. La morfología de los parásitos se estudió en láminas teñidas con Giemsa–ácido (14), con un aumento final de 1000X en microscopio óptico (Nikon, Eclipse 400) contando al menos 300 formas para determinar porcentajes morfológicos. Las morfologías más representativas se fotografiaron con cámara digital (Nikon, Coolpix, 4500).
Resistencia a la lisis por complemento y obtención de extractos proteicos totales. Parásitos de diferentes tiempos de cultivo en la condición vertical y horizontal fueron sometidos a la acción del complemento y posterior lisis de las masas húmedas obtenidas para extracción de proteínas siguiendo protocolos ya previamente descritos (8).
Electroforesis de proteínas en geles de poliacrilamida (SDS-PAGE) y comparación antigénica por Western Blot. El fraccionamiento de los extractos proteicos mediante electroforesis en SDS-PAGE, seguida de electro-transferencia a membranas de nitrocelulosa, y el desarrollo del Western Blot se realizó siguiendo los protocolos habituales (15,16). Los cambios proteicos y glicoproteicos se compararon mediante geles teñidos con Coomassie-Plata para proteínas ó Acido periódico-Alcian Blue-Glutaraldehído-Plata (APABGP) para glicoproteínas según Barrios et al (17). Para el análisis de los cambios antigénicos, se colocaron por canal 4 μg de proteínas de parásitos de tiempos variables entre 0 y 12 días obtenidos de las curvas de crecimiento de la condición vertical y horizontal, proteínas de epimastigotas de 6 días (control) y de amastigotas extracelulares primarios (control). Los antígenos se revelaron usando anticuerpos primarios producidos contra amastigotas extracelulares secundarios: a) suero preparado en conejo (suero anti-AES; 1/3.000) y (b) IgY preparado en gallina (IgY anti-AES; 1/1.000) (8). Como anticuerpos secundarios se usó anti-IgG de conejo producida en cabra (1/10.000) y anti-IgY de gallina preparado en conejo (1/10.000), ambos conjugados a peroxidasa. Los inmunocomplejos se revelaron mediante quimioluminiscencia, empleando luminol como sustrato (Super Signal, Pierce) y los luminogramas a partir de películas de Rayos X (Medical Film Konica Minolta).
Digitalización, registro fotográfico y análisis. Los luminogramas se digitalizaron en densitómetro (Bio-Rad, Imaging Densitometer, Modelo GS-690) y analizaron con el Software (Bio-Rad Molecular Analyst®/PC 1,2 Software package). Las figuras y fotografías se procesaron por Microsoft Power Point 2007.
RESULTADOS
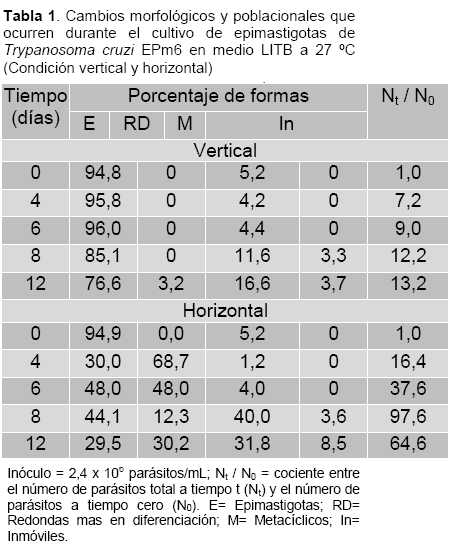
La tabla 1 muestra los cambios morfológicos y poblacionales que ocurrieron durante el crecimiento de T. cruzi EPm6 en medio LITB a 27ºC en condición vertical y horizontal. En condición vertical, se aprecia que el porcentaje de epimastigotas se mantiene en torno al 95,8% en los primeros 6 días de cultivo, luego decrece entre el día 6 y 12 (96,0 a 76,6%), mientras que las formas metacíclicas se incrementan de 4,4% (día 6) a 16,6% (día 12). En esta condición de baja TOD, no se observaron formas redondeadas y la epimastigota fue la morfología predominante a lo largo de la curva de crecimiento. En condición horizontal, al 4° día se aprecia un fuerte incremento de 16,4 veces el inóculo, luego, un incremento abrupto a 97,6 veces al 8° día y una acentuada caída de hasta 64,6 veces el inóculo al 12° día. Se aprecia que en la condición de alta TOD, varía la morfología predominante, a lo largo de la curva de crecimiento. Al inicio predominan los epimastigotas (94,9%, día 0), seguidamente las formas redondas (68,7%, día 4), al 8° día se incrementa significativamente los metacíclicos (40%) y al 12° día se distribuyen equitativamente las tres morfologías (29,5% epimastigotas, 30,2% formas redondeadas y 31,8% metacíclicos).
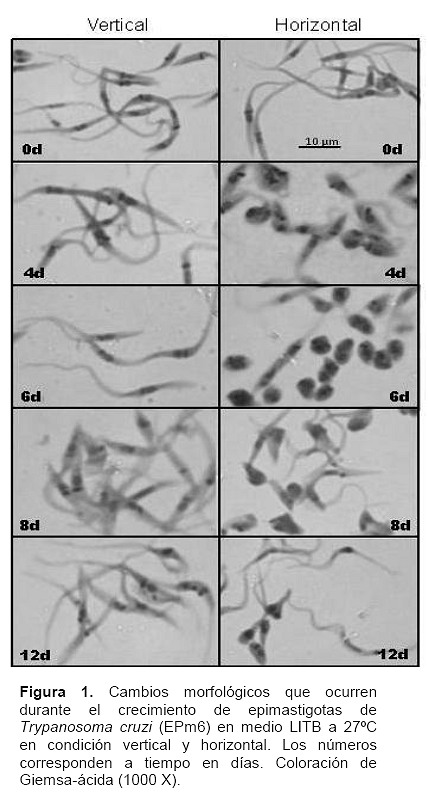
La comparación de las cinéticas de crecimiento de epimastigotas de T. cruzi crecidos en igualdad de inóculo, volumen, medio de cultivo y temperatura, variando solo la tensión de oxígeno mostró al cabo de 12 días un incremento del inóculo (Nt /N0) de 64,6 veces en alta TOD respecto a 13,2 veces en la condición de bajo TOD. La relación del incremento del inóculo de la condición horizontal sobre la vertical entre los 0 y 8 días muestra una progresión geométrica (día 4, 16,4/7,2 = 2,3 veces; día 6, 37,6/9,0 = 4,1 veces; día 8, 97,6/12,2 = 8,0 veces). Estos cambios morfológicos se siguieron por microscopia óptica y coloración de Giemsa observándose en la figura 1 que los parásitos crecidos en baja TOD (vertical) muestran la forma epimastigota típica en los diferentes días de la curva de crecimiento (Fotos 0d a 12d, vertical), similarmente a lo observado el día 0 de condición horizontal (Foto 0d, horizontal). Al 4° y 6° día de incubación en la condición de alta TOD (horizontal) se observaron formas redondas que recuerdan la morfología de los amastigotas y formas en diferenciación caracterizados por el acortamiento del cuerpo del epimastigota (Fotos 4d y 6d, horizontal). Los días 8 y 12 se aprecian formas redondas, algunas con flagelo y formas metacíclicos (Fotos 8d y 12d, horizontal).
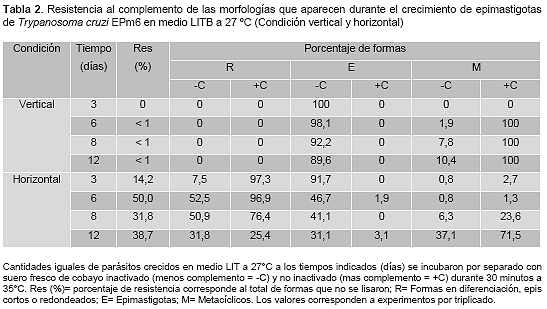
La tabla 2 muestra el porcentaje de resistencia al complemento de las morfologías que aparecen durante el crecimiento de epimastigotas en condición vertical y horizontal.
En condición vertical el día 3, no se observaron formas resistentes al complemento (0%) y desde el día 6 al día 12 el porcentaje de formas resistentes fue menor a 1% (vertical, columna Res).
Ese 1% de la población total de formas resistentes correspondieron a formas metacíclicas que se incrementaron en el cultivo desde 1,9% el día 6 a 10,4% el día 12 (vertical, columna –C, M) y que fueron 100% resistentes al complemento (vertical, columna +C, M).
Cuando los parásitos crecieron en condición horizontal se observó un incremento progresivo en el porcentaje de formas resistentes desde 14,2% el día 3 hasta 38,7% el día 12 (horizontal, columna Res).
Esos porcentajes de formas resistentes estuvieron constituidos predominantemente por formas redondas y metacíclicos.
Las formas redondas incrementaron desde un 7,5% el día 3, alcanzaron un pico de 52,5% el día 6 y decrecieron a 31,8% el día 12 (horizontal, columna –C, R) y fueron formas cuya resistencia disminuyó desde 97,3% el día 3 a 25,4% el día 12 (horizontal, columna +C, R).
Las formas metacíclicas incrementaron desde un 0,8% el día 3 hasta un 37,1% el día 12 (horizontal, columna –C, M) y presentaron una resistencia variable al complemento un 2,7% el día 3, un 1,3% el día 6, un 23,6% el día 8 y un 71,5% el día 12 (horizontal, columna +C, M
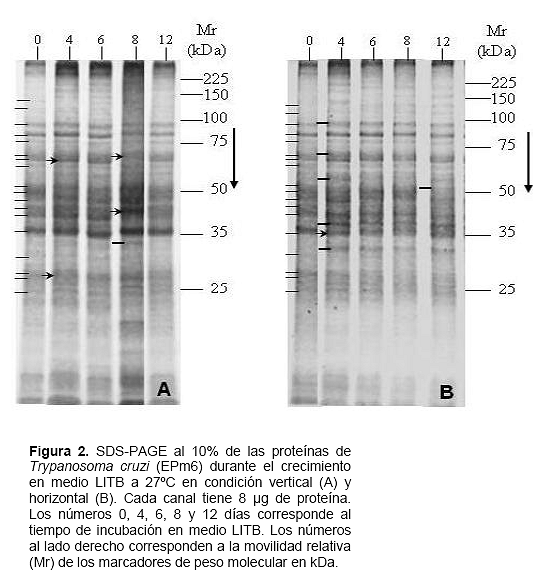
La figura 2 muestra el análisis de los perfiles proteicos durante el crecimiento en la condición vertical (A) y horizontal (B). El análisis muestra al día 0 para ambas condiciones, un perfil común caracterizado por al menos 18 bandas proteicas de diferente espesor e intensidad (130, 120, 90, 85, 80, 70, 65, 63, 52, 50, 47, 45, 40, 35, 32, 29, 27 y 25 kDa, trazos a la izquierda de los canales 0, Figuras 2A y 2B). Este perfil se conserva hasta el día 12 en la condición vertical y se observan pequeños cambios representados por engrosamiento de dos bandas proteicas al día 4 (65 y 27 kDa, puntas de flecha canal 4, Figura 2A), dos bandas el día 8 (70 y 45 kDa, puntas de flecha canal 8, Figura 2A) y la aparición de una banda de 34 kDa en ese mismo día (trazo corto canal 8, Figura 2A). En la condición horizontal (Figura 2B) se observan cambios mayores, representados por la aparición el día 4 de al menos cinco bandas (95, 72, 55, 38 y 34 kDa, trazos cortos canal 4, Figura 2B) e intensificación de la banda de 35 kDa (punta de flecha canal 4, Figura 2B), los cuales se mantienen hasta el día 12 donde se observa la aparición de una banda de 51 kDa (trazo corto canal 12, Figura 2B).
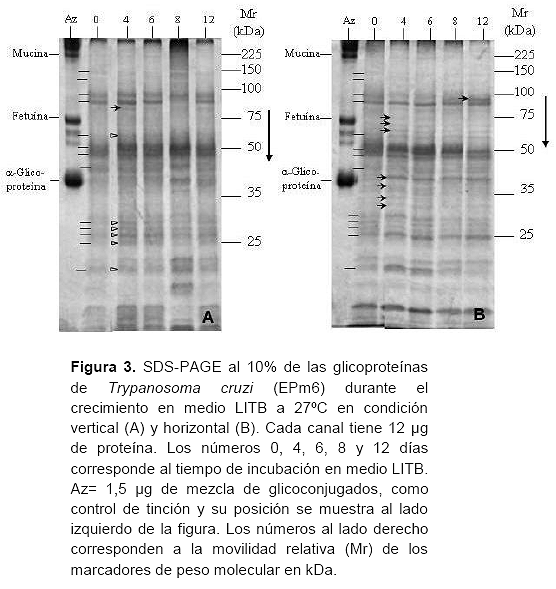
La figura 3 muestra el análisis de los perfiles glicoproteicos durante el crecimiento en la condición vertical (A) y horizontal (B). El análisis muestra al día 0 para ambas condiciones, un perfil común caracterizado por al menos 13 bandas glicoproteicas de diferente espesor e intensidad (145, 130, 95, 82, 60, 50, 46, 40, 30, 29, 27, 25 y 21 kDa, trazos a la izquierda de los canales 0, Figuras 3A y 3B).
En la condición vertical a partir del día 4 se intensifican seis bandas glicoproteicas (60, 30, 29, 27, 25 y 21 kDa, triángulos claros canal 4, Figura 3A) y aparece una glicoproteína bien definida (80, punta de flecha canal 4, Figura 3A).
En la condición horizontal los cambios más acentuados ocurrieron al 4° día con la aparición de siete bien definidas glicoproteínas (75, 70, 65, 38, 36, 34 y 33 kDa, puntas de flecha canal 4, Figura 3B) que se mantuvieron posteriormente y aparición el día 12 de una glicoproteína de 90 kDa (punta de flecha canal 12, Figura 3B).
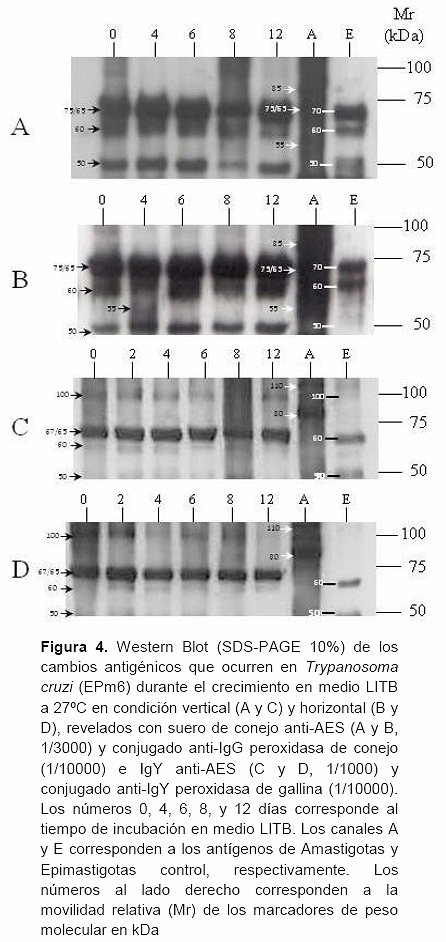
La figura 4 compara los cambios antigénicos que ocurren durante el crecimiento de T. cruzi en la condición vertical (A y C) y horizontal (B y D), revelados con anticuerpos que reconocen antígenos comunes y específicos de amastigotas.
El suero anti-AES preparado en conejo reveló en la condición vertical tres perfiles antigénicos bien definidos (Figura 4A), uno para los epimastigotas caracterizado por al menos tres bandas antigénicas bien definidas e intensas (70, 60 y 50 kDa, trazos a la izquierda del canal E, Figura 4A), otro para los amastigotas control que muestra un grupo de antígenos no resueltos entre los marcadores de 100 y 50 kDa, donde sobresalen al menos tres bandas antigénicas muy intensas (85, dupleta 75/65 y 55 kDa, puntas de flecha blancas a la izquierda del canal A, Figura 4A) y un tercer perfil caracterizado por tres bandas antigénicas intensas (dupleta 75/65, 60 y 50 kDa, puntas de flecha canal 0, Figura 4A) que se mantiene entre los días 0 y 12 de la curva de crecimiento (canales 0, 4, 6, 8 y 12, Figura 4A).
Los cuatro antígenos que identifica el suero anti-AES en parásitos de 0 a 12 días (dupleta 75/65, 60 y 50 kDa) son una combinación de los antígenos controles identificados en los epimastigotas (70, 60 y 50 kDa, canal E) y amastigotas (dupleta 75/65, canal A).
En la condición horizontal, el suero anti-AES reveló un perfil antigénico (dupleta 75/65, 60 y 50 kDa, puntas de flecha a la izquierda del canal 0, Figura 4B) muy similar al identificado en la condición vertical.
La diferencia antigénica más relevante entre ambas condiciones fue la presencia de un antígeno de 55 kDa en los parásitos de 4 días de la condición horizontal (punta de flecha a la izquierda del canal 4, Figura 4B) coincidente con el antígeno de 55 kDa revelado en los amastigotas controles (canales A, Figura 4A y 4B). Vale destacar que el día 4 de la curva de crecimiento en la condición horizontal, predominaron las formas redondas (68,7%, columna RD; horizontal Tabla 1). La IgY anti-AES preparada en gallina reveló en la condición vertical tres perfiles antigénicos bien definidos (Figura 4C), uno para los epimastigotas caracterizado por tres bandas antigénicas de diferente intensidad (100, 60 y 50 kDa, trazos a la izquierda del canal E, Figura 4C), otro para los amastigotas control que muestra dos bandas antigénicas intensas y bien definidas (110 y 80 kDa, flechas blancas a la izquierda del canal A, Figura 4C) y un tercer perfil caracterizado por cuatro bandas antigénicas, una ancha e intensa y tres de poca intensidad (100, dupleta 67/65, 60 y 50 kDa, puntas de flecha canal 0, Figura 4C) que se mantiene su expresión desde el día 0 al 12 de la curva de crecimiento (canales 0, 2, 4, 6, 8 y 12, Figura 4C).
Tres de los antígenos que el antisuero identifica en los parásitos de 0 a 12 días (100, 60 y 50 kDa), corresponden a los antígenos revelados en los epimastigotas control.
En los parásitos de la condición horizontal, el anticuerpo IgY reveló cuatro bandas (100, dupleta 67/65, 60 y 50 kDa, puntas de flecha canal 0, Figura 4D) idénticas a las reveladas en la condición vertical (Figura 4C). Es de hacer notar que el anticuerpo IgY anti-AES no identificó en parásitos de la condición vertical y horizontal ningún antígeno de los revelados en los amastigotas controles.
DISCUSIÓN
En este trabajo se evidenció que las formas epimastigotas de T. cruzi crecidas en un microambiente con alta tensión de oxígeno se adaptan morfológica y molecularmente de forma tal que mimetizan algunas propiedades biológicas y antigénicas del estadio amastigota pero son básicamente formas epimastigotas redondas y no amastigotas genuinos.
En la revisión bibliográfica no se encontraron reportes de cultivos de T. cruzi en ambientes equivalentes a la condición horizontal (amplia superficie y poca altura del medio sobrenadante) y si bien no se determinó experimentalmente la TOD, es obvio que en la condición horizontal hay una mayor difusión de oxígeno al medio que en la vertical. La TOD es fundamental para el crecimiento y sobrevivencia de los linajes celulares mantenidos in vitro. Concentraciones de O2 en el medio menor que 2% de la tensión de oxígeno atmosférica, llevan al cese del crecimiento celular, mientras que exceso de oxígeno disuelto en el medio (95%) es tóxico para células en cultivo (18). El estudio del contenido de oxígeno pericelular en cultivos de diferentes linajes celulares mostró que varía en un amplio rango (110 y 0,2 mm de Hg) y depende de la línea celular en cuestión (19). Se ha reportado que T. cruzi creciendo en erlenmeyer con agitación, alcanza mayores rendimiento de parásitos/mL indicando que a mayor TOD se acorta el tiempo de generación del parásito (20). Nuestros resultados indican que trabajando con igual inóculo, medio y volumen, y cultivando los parásitos en una condición con mayor TOD hay incremento exponencial del inóculo respecto al cultivo en baja TOD, sugiriendo un aumento en la velocidad de crecimiento (Tabla 1). Esto puede ser debido a que siendo T. cruzi un fermentador-aeróbico al incubarlo en una condición de alto tenor de oxígeno usa principalmente un metabolismo oxidativo (21).
Hay evidencias indicando que T. cruzi responde a cambios morfológicos en respuesta a los cambios microambientales (7). Pan (22) desarrolló dos medios de cultivo para T. cruzi, el F-29 y el F-32 que difieren en la proporción de suero fetal bovino (SFB) y plasma de pollo. Por adaptación progresiva a diferentes temperatura desde 29,5°C hasta 35,5°C consiguió mantener por sub-cultivos sucesivos las formas amastigotas proponiendo que en el SFB existen uno o varios factores involucrados en la morfogénesis hacia amastigotas y que la temperatura actúa como un mecanismo selectivo. Pan (22) hace notar que se debe mantener volúmenes pequeños de cultivo, para obtener reproducibilidad en las proporciones de amastigotas y tripomastigotas para inducir esos estadios de T. cruzi en los medios F-29 y F-32 (20). El hecho que estos amastigotas tengan una procedencia primaria desde epimastigotas a 28°C y no de tripomastigotas sanguíneos de 37°C como en el ciclo natural resta significación biológica a estos amastigotas. En nuestra condición horizontal encontramos formas redondas sin flagelo con aspecto de amastigotas (Figura 1) que son resistentes a complemento, en contraste con la morfología típica de epimastigotas sensibles a complemento de la condición vertical, lo que indica que esas formas redondas a temperatura ambiente adquieren propiedades equivalentes a los amastigotas de 37°C.
Los cambios morfológicos durante las curvas de crecimiento están acompañados con cambios moleculares. Así, en la condición horizontal los días 4, 8 y 12, tanto en proteínas como en glicoproteínas, es donde se aprecian los cambios más significativos (Figuras 2B y 3B) y corresponden a predominio de las formas redondas (día 4), predominio de metacíclicos (día 8) y donde los porcentajes de las tres morfologías (epimastigotas, formas redondas y metacíclicos) son equitativos (día 12). En apoyo de esta afirmación se aprecia que en condición vertical el perfil del día 0 se conserva sin cambios significativos hasta el día 8, a partir del cual se notan algunos cambios menores concomitantemente con el incremento del porcentaje de metacíclicos (Figuras 2A y 3A, Tabla 1). En consecuencia los cambios morfológicos, la mayor tasa de multiplicación y la resistencia al complemento inducidos por una mayor TOD, no son un artefacto metodológico sin significado biológico sino que implican que en las formas redondas se están expresando genes de otros estadios del parásito.
Si las formas redondas que aparecen en la condición horizontal son efectivamente amastigotas es de esperar que expresen antígenos amastigota específicos. Se acepta que la expresión del antígeno amastigota específico ssp-4 de T. cruzi en una morfología de transición, valida su condición de amastigota (23). Reportes previos trabajando con sueros anti-estadios mostraron que el suero anti-AES detectó al menos catorce (175, 135, 120, 105, 95, 75, 72, 64, 60, 55, 51, 47 y 12/5 kDa) bandas antigénicas comunes y específicos de amastigotas intra y extracelulares (24). Durante la epimastigogénesis de T. cruzi, se identificó una morfología de transición como amastigota usando el anticuerpo IgY anti-AES, el cual mostró una alta capacidad discriminante y reconoció cinco bandas antigénicas (130, 110, 95, 80, y 52 kDa) como específicas de amastigotas (8). Como en los parásitos creciendo en la condición vertical no hubo cambios morfológicos durante toda la curva de crecimiento, era de esperar que el suero anti-AES no revelara ningún cambio antigénico y detectara los antígenos comunes con los epimastigotas controles (70, 60 y 50 kDa). En la condición horizontal donde si hubo cambios morfológicos, los perfiles antigénicos revelados confirman que los antígenos reconocidos por el suero anti-AES fueron mayoritariamente los comunes entre amastigotas (dupleta 75/65 kDa) y epimastigotas (70, 60 y 50 kDa). Sin embargo, el antígeno de 55 kDa revelado solo en los amastigotas controles, aparece tenue y transitoriamente en los parásitos del día 4, sugiriendo que al menos transitoriamente coincidieron características morfológicas, biológicas y antigénicas del estadio amastigotas en parásitos sometidos a una alta TOD.
Los resultados obtenidos con el anticuerpo IgY anti-AES confirman su alta capacidad discriminante al no revelar en los amastigotas controles, antígenos comunes con los epimastigotas controles. El hecho que la IgY anti-AES no encontrara diferencias a lo largo de la curva de crecimiento de la condición horizontal y que sea idéntico el perfil a la condición vertical indica que esas formas redondas son esencialmente epimastigotas.
En conjunto estas evidencias sugieren que T. cruzi posee una plasticidad morfogenética para adaptarse a un microambiente determinado mimetizando propiedades biológicas y antigénicas de otro estadio.
Agradecimiento: Al Sr. Jhonny Albanese por la asistencia infraestructural.
Financiamiento: FONACIT S1-2001000683; CDCH-UC FCS: Proyectos 2003-005; 2006-006; 00212-07; 2010-001; Investigaciones Menores 021-2013; 011-2011; 180-2011; 0394-2010, 0461-2010; Equipamiento Institucional 2005-012.
REFERENCIAS
1. Chang SL, Negherbon WO. Studies on haemoflagellates. II. A study of the growth rates of Leishmania donovani, Leishmania brasiliensis, Leishmania tropica and Trypanosoma cruzi in culture. J Infect Dis. 1947; 80(2):172-184. [ Links ]
2. Goitia-Aular M, Boiso JF. Cultivo de Trypanosoma cruzi (cepa Elpidio Padrón) en un medio semidefinido. Efecto de algunas variaciones en la composición y condiciones del mismo. Acta Cient Venez. 1982; 33(6):488-496. [ Links ]
3. Tyler KM, Engman DM. The life cycle of Trypanosoma cruzi revisited. Int J Parasitol. 2001; 31(5-6):472-481. [ Links ]
4. Cross GAM, Manning JC. Cultivation of Trypanosoma brucei sspp in semi-defined and defined media. Parasitology. 1973; 67(3):315-331. [ Links ]
5. Ellenbogen BB, Hutner SH, Tamburro KM. Temperature-enhanced osmotic growth requirement of Crithidia. J Protozool. 1972; 19(2):349-354. [ Links ]
6. Andrade PP y Almeida DF. Environmental factors determining structural transition in Herpetomonas samuelpessoai. J Parasitol. 1980; 66(2):250-254. [ Links ]
7. Contreras VT, De Lima AR, Navarro MC. Revisión: Morfogénesis de Trypanosoma cruzi: factores relevantes para la diferenciación in vitro. Acta Biol Venez. 2006; 26(2):49-60. [ Links ]
8. Graterol D, Arteaga RY, Navarro MC, Domínguez MI, De Lima AR, Contreras VT. El estadio amastigota precede la evolución del epimastigota durante la epimastigogénesis in vitro de Trypanosoma cruzi. Rev Soc Venez Microbiol. 2013; 33(1):72-79. [ Links ]
9. Pan SC. Trypanosoma cruzi: Ultrastructure of morphogenesis in vitro and in vivo. Exp Parasitol. 1978; 46(1):92-107. [ Links ]
10. Zaidenberg A, Tournier HA, Schinella GR, Buschiazzo HO. Trypanosoma cruzi: Obtención de amastigotes extracelulares y estudio de su crecimiento en diferentes condiciones de cultivo. Rev Latinoam Microbiol. 2000; 42(1):21-26. [ Links ]
11. Schuster FL, Sullivan JJ. Cultivation of clinically significant hemoflagellates. Clin Microbiol Rev. 2002; 15(3):374–389. [ Links ]
12. Contreras V. Factores importantes en el estudio de la relación parásito-huésped. Virulencia de 4 aislados de Trypanosoma cruzi. En: Vicerrectorado Académico Universidad de Carabobo Editores. Elementos de apoyo para trabajar en enfermedad de Chagas. 1er. Ed. Clemente Editores. Valencia Venezuela 1994; p 11-40. [ Links ]
13. Navarro MC, De Lima AR, Askue J, Contreras VT. Morphological comparison of axenic amastigogenesis of trypomastigotes and metacyclic forms of Trypanosoma cruzi. Mem Inst Oswaldo Cruz. 2003; 98(1):83–91. [ Links ]
14. Carvalho ALM. Estudos sobre a posição sistemática, a biologia e a transmissão de tripanosomatídeos encontrados em Zelus leucogrammus (Perty, 1834) (Hemiptera, Reduviidae). Rev Pat Trop. 1973; 2:223-274. [ Links ]
15. Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227(5259):680-685. [ Links ]
16. Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci USA 1979; 76(9):4350-4354. [ Links ]
17. Barrios JG, Contreras O, Graterol D, Navarro MC, Contreras VT, De Lima AR. Trypanosoma cruzi: Epimastigogénesis en condiciones axénicas. Cambios morfológicos, peptídicos, glicopeptídicos y antigénicos. Acta Cient Venez. 2008; 59(1):29-38. [ Links ]
18. Nahapetian AT, Thomas JN, Thilly WG. Optimization of environment for high density Vero cell culture: effect of dissolved oxygen and nutrient supply on cell growth and changes in metabolites. J Cell Sci. 1986; 81:65-103. [ Links ]
19. Metzen E, Wolff M, Fandrey J, Jelkmann W. Pericellular PO2 and O2 consumption in monolayer cell cultures. Respir Physiol. 1995; 100(2):101-106. [ Links ]
20. Evans DA. Methods of cultivating parasites in vitro. In Taylor AER and Baker JR, Editors. Kinetoplastida. 1r Ed. Academic Press Inc, London 1978; p 55-88. [ Links ]
21. Engel JC, Franke de Cazzulo BM, Stoppani AO, Cannata JJ, Cazzulo JJ. Aerobic glucose fermentation by Trypanosoma cruzi axenic culture amastigote-like forms during growth and differentiation to epimastigotes. Mol Biochem Parasitol. 1987; 26(1-2):1-10. [ Links ]
22. Pan CT. Cultivation and morphogenesis of Trypanosoma cruzi in improved liquid media. J Protozool. 1971; 18(4):556-560. [ Links ]
23. Andrews NW, Hong KS, Robbins ES, Nussenzweig V. Stage-specific surface antigens expressed during the morphogenesis of vertebrate forms of Trypanosoma cruzi. Exp Parasitol. 1987; 64(3):474–484. [ Links ]
24. Contreras VT, Navarro MC, De Lima AR, Arteaga R, Duran F, Askue J, Franco Y. Production of amastigotes from metacyclic trypomastigotes of Trypanosoma cruzi. Mem Inst Oswaldo Cruz. 2002; 97(8):1213-1220. [ Links ]