Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. v.9 n.9 Mérida abr. 2011
Adrenomedulina: ¿Más que una simple hormona?
Marcos M. Lima 1, Christopher Torres 2, Francisco Rosa 2, Eduardo Romero-Vecchione3,Ernesto Guerra2, José Zerpa1.
1Unidad de Endocrinología. Instituto Autónomo Hospital Universitario de los Andes. Mérida. 2Laboratorio de Estudios Cardiovasculares y Neurociencias. Universidad de Oriente. Núcleo Bolívar. 3Laboratorio de Estudios Cardiovasculares, Escuela de Medicina JM Vargas, Facultad de Medicina, Universidad Central de Venezuela. Caracas.
Dirigir correspondencia a: Dr. Marcos M. Lima: marcoslimamedical@hotmail.com
RESUMEN
La adrenomedulina es un péptido vasodilatador, presente en el sistema cardiovascular, riñón, pulmón, glándula adrenal y en el adipocito. Este péptido ha venido adquiriendo una importancia creciente en los últimos años, ya que se han descrito niveles elevados del mismo en patologías como el síndrome metabólico, diabetes mellitus tipo 2, hipertensión arterial y en aterosclerosis, lo cual pone de manifiesto su relevancia en la fisiopatología de estos trastornos y su posible uso como marcador de riesgo cardiometabólico. A nivel cardíaco, el efecto inotrópico positivo de este péptido parece estar mediado por un aumento del calcio citosólico, independiente de AMP cíclico; reduce la hipertrofia de los miocardiocitos y en la insuficiencia cardíaca los niveles plasmáticos de adrenomedulina están incrementados. La adrenomedulina tiene efecto vasodilatador sistémico y pulmonar y se encuentra incrementada en el plasma de sujetos con hipertensión arterial esencial y en hipertensos con hiperaldosteronismo primario. En riñón, la adrenomedulina induce efecto diurético y natriurético, aumento de la filtración glomerular y disminución de la reabsorción tubular distal de sodio; sus niveles están elevados en la insuficiencia renal crónica. La adrenomedulina está elevada en pacientes diabéticos con mal control metabólico, pero su papel patogénico en la enfermedad no está claro.
Palabras clave: Adrenomedulina, hipertensión, insuficiencia cardiaca, insuficiencia renal, síndrome metabólico.
ABSTRACT
Adrenomedullin is a vasodilatory peptide found in the cardiovascular system, kidneys, lungs, adrenal glands and adipocytes. This peptide has been rising interest during the last years because increased plasma levels of it have been found in several pathological conditions such as the metabolic syndrome, type 2 diabetes mellitus, arterial hypertension and atherosclerosis, pointing to a possible physiopathologic role in these diseases and the potential use as a clinical cardiometabolic marker. In the heart, adrenomedullin has a positive inotropic action, probably mediated through cytosolic increase of calcium concentration, independent of cyclic AMP; it also can reduce cardiomyocites hypertrophy. In heart failure, adrenomedullin levels are increased and show systemic and pulmonar vasodilator effect; its plasma levels are increased in patients with essential arterial hypertension and hypertensives with primary hyperaldosteronism. In the kidneys, adrenomedullin is natriuretic and diuretic, it elevates glomerular filtration rate and reduce distal tubules sodium reabsorption; in patients with renal failure, adrenomedullin levels are increased. In diabetic patients, adrenomedullin plasma levels are increased; however, its pathogenic role in this disease is not yet clear.
Key words: Adrenomedullin, hypertension, heart failure, kidney failure, metabolic syndrome.
Artículo recibido en: Julio 2010. Aceptado para publicación en: Septiembre 2010.
La adrenomedulina es un potente péptido vasodilatador aislado a partir de feocromocitoma humano en el año 1993 por Kitamura y cols., por lo cual se pensó que era producido de forma exclusiva a nivel de la médula adrenal, de allí su nombre1. Este péptido tiene homología del 27% con el péptido relacionado al gen de la calcitonina (CGRP, del inglés calcitonin gene-related peptide), lo cual sugiere que este péptido pertenece a esta superfamilia2.
La distribución tisular de la adrenomedulina es amplia, y está especialmente presente en el sistema cardiovascular, riñón, pulmón, glándula adrenal y en el adipocito1-4. Este péptido ha venido adquiriendo una importancia creciente en los últimos años, ya que se han descrito niveles elevados del mismo en patologías como el síndrome metabólico, diabetes mellitus tipo 2, hipertensión arterial y en aterosclerosis, lo cual pone de manifiesto su relevancia en la fisiopatología de estos trastornos y su posible uso como marcador de riesgo cardiometabólico.
1. ESTRUCTURA QUÍMICA DE LA ADRENOMEDULINA
La adrenomedulina es un péptido de 52 aminoácidos con un puente disulfuro que forma un anillo de 6 residuos de aminoácidos y una tirosina amidada en el extremo C- terminal. El precursor de la adrenomedulina humana también conocido como preproadrenomedulina tiene 185 aminoácidos y es degradado al péptido de 164 aminoácidos denominado proadrenomedulina mediante escisión del péptido señal. La proadrenomedulina tiene a su vez dos péptidos vasoactivos, la adrenomedulina y el péptido N-terminal de proadrenomedulina (PAMP, del inglés proadrenomedullin N-terminal peptide), el cual también tiene propiedades vasodilatadoras. Recientemente, se ha descrito que a partir de la proadrenomedulina se forma adrenomedulina-glicina, una forma intermedia de 53 aminoácidos, a partir de la cual tiene lugar la forma madura de la adrenomedulina (52 aminoácidos) mediante amidación enzimática1,2.
El gen de la adrenomedulina se encuentra localizado en un único locus en el cromosoma 11, está formado por 4 exones y 3 intrones; el cuarto exon es el que codifica la forma madura de la adrenomedulina5.
2. DISTRIBUCIÓN Y RECEPTORES DE ADRENOMEDULINA
La adrenomedulina es sintetizada por una amplia variedad de tejidos, incluyendo médula adrenal, corazón, pulmón, riñones, células de los islotes pancreáticos y recientemente se describió a nivel del tejido adiposo, siendo considerada una nueva adipocitoquina1-4. Asimismo, la adrenomedulina es expresada de manera significativa a nivel de las células endoteliales, las células musculares lisas vasculares, fibroblastos y neuronas6,7.
Se ha descrito que la adrenomedulina se une selectivamente a un receptor específico estructuralmente similar al receptor de CGRP. Este receptor consta de siete dominios transmembrana y tiene una analogía estructural con otros miembros de la superfamilia de receptores acoplados a proteínas G8. McLatchie y cols., describieron que el receptor similar al receptor de calcitonina (CRLR, del inglés calcitonin receptor-like receptor) funciona como receptor de CGRP o de adrenomedulina dependiendo de cambios moleculares accesorios debidos a la acción de las proteínas modificadoras de la actividad del receptor (RAMP, del inglés receptor activity modifying protein)9.
El CRLR es un receptor que tiene siete dominios transmembrana, característico de la superfamilia de receptores ligados a proteína G. Por su parte los RAMP son proteínas de un único dominio transmembrana, del cual se han descrito tres subtipos, RAMP 1, 2 y 3. La RAMP 1 se encarga de presentar al CRLR como una glicoproteína madura en la superficie celular para formar el receptor de CGRP; mientras que la RAMP 2 y 3 transportan el receptor CRLR hacia la superficie celular y lo presentan como receptor de adrenomedulina, lo cual sugiere que la naturaleza del RAMP es la que determina la propiedad farmacológica del receptor, y que además la expresión del CRLR en ausencia de RAMP conlleva a que éste sea retenido a nivel intracelular, no pudiendo por ende alcanzar la superficie celular, lo cual hace suponer que los RAMP actúan como moléculas chaperonas que facilitan la maduración y que además determinan la actividad del receptor9,10.
Se ha demostrado que la adrenomedulina una vez unida a su receptor es capaz de inducir un aumento en la producción de AMP cíclico y dependiendo de la célula diana sobre la cual actúe, ejerce su efecto a través de mecanismos de acción diferentes.
Así por ejemplo, el efecto hipotensor de este péptido depende de al menos dos mecanismos; un efecto directo sobre las células musculares lisas vasculares al aumentar los niveles de AMPc intracelular y la estimulación de la sintasa de óxido nítrico mediado por calcio citosólico a nivel de las células endoteliales11. Recientemente se ha descrito que el efecto miorelajante vascular de adrenomedulina también podría estar mediado por una tercera vía, a través de canales de potasio activados por calcio12.
A nivel cardíaco, el efecto inotrópico positivo de este péptido parece estar mediado por un aumento del calcio citosólico, independiente de AMP cíclico, probablemente a través de la activación de la proteinquinasa C13.
3. EFECTOS BIOLÓGICOS E IMPLICACIONES CLÍNICAS DE LA ADRENOMEDULINA
3.1 Cardiovasculares: en diversas especies incluyendo humanos, la adrenomedulina tiene potentes efectos vasodilatadores a nivel sistémico y pulmonar. Diversos estudios han demostrado que la adrenomedulina causa vasodilatación e hipotensión en animales de experimentación e incrementa el flujo sanguíneo a los pulmones, corazón, riñones y glándulas adrenales14,15.
Los estudios realizados en hombres reportan resultados similares. En un estudio aleatorizado, controlado con placebo, la infusión intravenosa de adrenomedulina a sujetos normales indujo un descenso de la presión arterial sin aumentos compensatorios de la frecuencia cardíaca, o cambios en la actividad de la renina plasmática, o de los niveles de adrenalina y noradrenalina. Este efecto de la adrenomedulina sucedió a niveles plasmáticos de 11,4±2,1 pmol/L similares a los alcanzados en determinadas patologías16.
A nivel cardíaco, la adrenomedulina aumenta el gasto cardíaco y la contractilidad del ventrículo izquierdo in vivo, además la adrenomedulina inhibe la hipertrofia de los miocardiocitos17,18.
3.1.1. Hipertensión arterial: la concentración plasmática de adrenomedulina se encuentra incrementada en sujetos con hipertensión arterial y el grado de la elevación se corresponde con la severidad de la misma, así como el grado de hipertrofia ventricular izquierda y de disminución de la distensibilidad carotídea19. Por otro lado, se han descrito niveles elevados de adrenomedulina en formas secundarias de hipertensión arterial, como en el hiperaldosteronismo primario20.
Posiblemente el aumento de adrenomedulina en pacientes hipertensos, sea un mecanismo compensatorio que se genera con el fin de contrarrestar el aumento de presión arterial y los mecanismos subyacentes en esta patología.
3.1.2. Aterosclerosis: la adrenomedulina puede ser un biomarcador muy útil de aterosclerosis, puesto que los pacientes con cierto grado de aterosclerosis presentan niveles elevados de adrenomedulina independientemente de los valores de presión arterial, o de la presencia de otros factores de riesgo21. Los niveles elevados de adrenomedulina se correlacionan con la severidad de la esclerosis arterial, aterosclerosis de la arteria carotídea y enfermedad arterial oclusiva periférica22,23.
A pesar de encontrarse elevados los niveles plasmáticos de adrenomedulina en la aterosclerosis, ésta posee propiedades antiaterogénicas y antiinflamatorias, ya que es capaz de inhibir la migración y proliferación de las células musculares lisas vasculares, así como la apoptosis de las células endoteliales y la producción de endotelina-1, por lo cual el incremento en su producción podría ser un mecanismo de defensa de las células endoteliales para inhibir el proceso de aterosclerosis24-27.
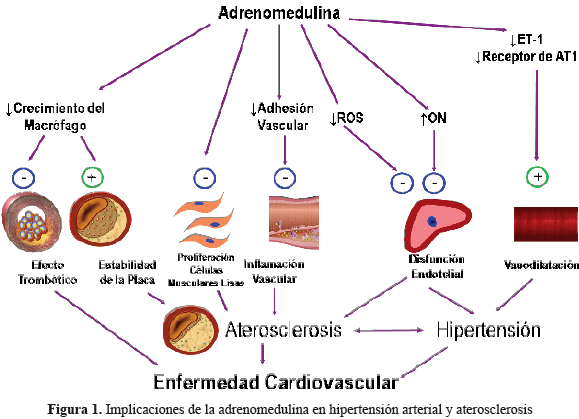
Por otra parte, la adrenomedulina tiene propiedades antioxidantes, ya que es capaz de antagonizar el stress oxidativo y las especies reactivas de oxígeno inducidas por la angiotensina II28. Las implicaciones de la adrenomedulina en hipertensión arterial y aterosclerosis se resumen en la figura 1.
3.1.3. Insuficiencia cardíaca: la adrenomedulina en el sistema cardiovascular puede participar en el proceso de transición de hipertrofia del ventrículo izquierdo a insuficiencia cardíaca29.
En esta patología, los niveles plasmáticos de adrenomedulina están incrementados y el grado de elevación depende de la severidad de la insuficiencia cardíaca30. Los niveles en plasma de adrenomedulina se correlacionan con la presión arterial pulmonar e inversamente con la fracción de eyección del ventrículo izquierdo30,31. Asimismo, se ha demostrado que la infusión intravenosa de adrenomedulina en pacientes con insuficiencia cardíaca durante 30 minutos tiene efectos beneficiosos hemodinámicos, renales y hormonales, ya que reduce la presión arterial sistémica, la presión pulmonar media, la presión capilar pulmonar enclavada, además aumenta la diuresis y la natriuresis y reduce los niveles de aldosterona, previniendo también el remodelado cardíaco al inhibir la hipertrofia de los miocardiocitos32.
3.2. Renales: la adrenomedulina a nivel renal induce efectos diuréticos y natriuréticos, los cuales se asocian con un aumento en la tasa de filtración glomerular y una disminución de la reabsorción tubular distal de sodio. El aumento de la tasa de filtración glomerular se asocia con la vasodilatación arteriolar aferente mediada por el óxido nítrico33,34.
Además la adrenomedulina inhibe la proliferación mesangial y reduce la activación de la proteinquinasa activada por mitógenos (MAPK, del inglés mitogen-activated protein kinase), lo cual hace pensar que este péptido tiene propiedades antiproliferativas a nivel renal35.
3.2.1. Insuficiencia Renal Crónica: en la insuficiencia renal los niveles plasmáticos de adrenomedulina se encuentran elevados, existiendo una correlación positiva entre niveles de adrenomedulina y niveles de creatinina en plasma36,37.
De igual manera, los niveles de adrenomedulina están elevados en pacientes con insuficiencia renal crónica terminal en programa de hemodiálisis38. Asimismo, los niveles de adrenomedulina están más elevados en pacientes hipertensos en hemodiálisis que en sujetos normotensos en igual tratamiento sustitutivo renal, lo cual sugiere un efecto protector de este péptido frente a los aumentos tensionales de estos pacientes39.
3.3.Endocrino-metabólicos: la adrenomedulina también se expresa a nivel de los islotes de Langerhans, predominantemente en las células F (ubicadas en la periferia del islote), siendo cosecretada con el polipéptido pancreático40. De igual forma, se ha demostrado por métodos inmunohistoquímicos y de inmunofluorescencia la presencia de los componentes del receptor de adrenomedulina (CRLR y RAMP 2/3) en la célula β pancreáica, siendo considerada esta célula el blanco principal de la adrenomedulina a nivel del páncreas41.
3.3.1. Síndrome metabólico: el síndrome metabólico, comúnmente encontrado en sujetos obesos, es una constelación de factores de riesgo tales como dislipidemia aterogénica, hipertensión arterial, obesidad abdominal, hiperglicemia asociada con resistencia a la insulina, estado protrombótico y proinflamatorio42. Tanto en animales experimentales como en el humano se ha demostrado que en el tejido adiposo se expresa la adrenomedulina2,43 Paulmyer-Lacroix y cols., demostraron que en mujeres obesas los niveles de adrenomedulina en el tejido adiposo eran significativamente mas altos que en mujeres delgadas44.
Torres y cols, demostraron que los niveles plasmáticos de adrenomedulina eran significativamente más elevados en pacientes con síndrome metabólico (3,21± 0,52ng/ml), que en pacientes controles (1,27±0,13ng/ml), la concentración de adrenomedulina se correlaciona positivamente con el grosor de la grasa epicárdica medido por ecocardiografía, un marcador importante de adiposidad visceral (8,33±1,2 mm vs 6,36±1,08mm, respectivamente)45,46.
Posiblemente los adipocitos del paciente con síndrome metabólico expresan altos niveles de adipocitoquinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α, del inglés tumoral necrosis factor-α) el cual a su vez puede inducir la expresión de adrenomedulina en el adipocito de forma autocrina o paracrina47. La secreción de adrenomedulina por parte del adipocito pudiera tener efectos protectores ya que este péptido tiene efectos antioxidantes que atenuarían el desarrollo de resistencia a la insulina, dado el efecto deletéreo de los radicales libres en el proceso de disfunción de la célula β pancreáica48.
3.3.2. Diabetes Mellitus: la presencia del receptor de adrenomedulina a nivel de la célula β pancreáica sugiere que este pétido pudiera jugar algún papel en la regulación de la secreción insulínica40,41,49. La adición de adrenomedulina a islotes de Langerhans aislados de ratones produce una inhibición en la secreción insulínica dosis dependiente. De igual manera, el uso de anticuerpos monoclonales dirigidos contra la adrenomedulina, incrementa hasta 5 veces más la secreción insulínica por parte de la célula β40. Los experimentos realizados in vivo corroboran los resultados obtenidos en islotes aislados, ya que la administración de adrenomedulina indujo inhibición en la secreción de insulina con el incremento concomitante de la glicemia40.
Resulta interesante, que la amilina, otro miembro de la familia del CGRP y que es co-secretada con la insulina por la célula β, tiene igualmente efectos inhibitorios sobre la secreción de la insulina49.
Para entender el papel de la adrenomedulina en el desarrollo de diabetes mellitus se estudiaron dos grupos poblacionales con diagnóstico reciente de diabetes. El hecho de que sean pacientes de reciente diagnóstico permitió excluir la presencia de complicaciones que pudieran ocasionar daño endotelial vascular, con la consiguiente elevación de adrenomedulina plasmática. Una población incluyó 83 pacientes que se encontraban en un estudio clínico en fase 1 para un agonista β-3 que causaba hiperglucemia en rango diabético.
En este grupo los niveles plasmáticos de adrenomedulina se encontraban elevados con respecto al grupo control. La segunda población estaba constituida por 30 mujeres embarazadas de origen latinoamericano con y sin diagnóstico de diabetes gestacional. Se encontró que las mujeres embarazadas tenían niveles de adrenomedulina superiores a las mujeres no embarazadas y dentro del grupo de las embarazadas no hubo diferencias significativas entre las pacientes con diabetes gestacional y las pacientes sin diabetes gestacional, por lo cual la asociación de adrenomedulina como agente causal de diabetes mellitus sigue estando poco clara50.
Resulta más clara la asociación de adrenomedulina con complicaciones crónicas de la diabetes. García-Unzueta y cols. compararon los niveles de adrenomedulina y AMPc, en un grupo de 103 pacientes con diabetes tipo 1 (46 de ellos sin complicaciones, 24 solo con retinopatía, 14 con microalbuminuria pero función renal normal, y 19 con insuficiencia renal) con los de 41 voluntarios sanos.
Se demostró un incremento en los niveles de adrenomedulina en los pacientes con insuficiencia renal o retinopatía; mientras que el resto de los pacientes diabéticos no tenían cambios significativos con respecto a los controles51. Asimismo, Hayashi y cols52 compararon los niveles plasmáticos de adrenomedulina en un grupo de 13 pacientes diabéticos tipo 2 con mal control metabólico, pero sin insuficiencia renal u otras complicaciones crónicas, con un grupo de 20 voluntarios sanos, encontrando niveles plasmáticos de adrenomedulina muy elevados en los pacientes con mal control metabólico, aún en ausencia de insuficiencia renal o complicaciones crónicas. Esto sugiere que la adrenomedulina pudiese ser un marcador eficaz de control metabólico ya que su aumento pudiera deberse al daño endotelial ocasionado por la hiperglucemia.
4. CONCLUSIONES
En conclusión, la adrenomedulina puede ser un marcador de severidad y de evolución de enfermedades como la insuficiencia cardiaca y renal, así como posiblemente también de la hipertensión arterial y la obesidad. Adicionalmente, por su acción vasodilatadora, natriurética y diurética podría ser de utilidad en el tratamiento de la insuficiencia cardíaca y renal, con el inconveniente de requerir administración intravenosa por tratarse de un péptido; no obstante, queda la puerta abierta en el futuro para la aparición de agonistas no peptídicos de sus receptores, con el potencial de producir los mismos efectos beneficiosos comentados anteriormente.
AGRADECIMIENTO
Los autores agradecen a la Lic. Rosalía Gumina en la Biblioteca del Hospital Universitario de los Andes por la colaboración prestada en la obtención del material bibliográfico utilizado en la presente revisión.
REFERENCIAS BIBLIOGRÁFICAS
1. Kitamura K, Kangawa K, Kawamoto M, Ichiki Y, Nakamura S, Matsuo H, Eto T. Adrenomedullin, a novel hypotensive peptide isolated from human phaeochromocytoma. Biochem Biophys Res Commun 1993; 192:553-560. [ Links ]
2. Li Y, Jiang C, Wang X, Zhang Y, Shibahara S, Takahashi K. Adrenomedullin is a novel adipokine: adrenomedullin in adipocytes and adipose tissues. Peptides 2007;28:1129-1143. [ Links ]
3. Takahashi K, Kikuchi K, Maruyama Y, Urabe T, Nakajima K, Sasano H, Imai Y, Murakami O, Totsune K. Immunocytochemical localization of adrenomedullin 2/intermedin – like immunoreactivity in human hypothalamus, heart and kidney. Peptides 2006;27:1383-1389. [ Links ]
4. Ichiki Y, Kitamura K, Kangawa K, Kawamoto M, Matsuo H, Eto T. Distribution and characterization of immunoreactive adrenomedullin in human tissue and plasma. FEBS Lett 1994;338:6-10. [ Links ]
5. Ishimitsu T, Miyata A, Matsuoka H, Kangawa K. Transcriptional regulation of human adrenomedullin gene in vascular endothelial cells. Biochem Biophys Res Commun 1998; 243:463-470. [ Links ]
6. Hinson JP, Kapas S, Smith DM. Adrenomedullin: a multifunctional regulatory peptide. Endocrine Review 2000;21:138-167. [ Links ]
7. Sugo S, Minamino N, Shogi H, Kangawa K, Kitamura K, Eto T, Matsuo H. Production and secretion of adrenomedullin from vascular smooth muscle cell: augmented production by tumor necrosis factor. Biochem Biophys Res Commun 1994;203:719-726. [ Links ]
8. Kapas S, Catt KJ, Clark AJL. Cloning and expression of cDNA encoding a rat adrenomedullin receptor. J Biol Chem 1995;270:25344-25347. [ Links ]
9. McLatchie LM, Fraser NJ, Main MJ, Wise A, Brown J, Thompson N, Solari R, Lee MG, Foord SM. RAMPs regulate the transport and ligand specificity of the calcitonin-receptor-like receptor. Nature 1998;393:333-339. [ Links ]
10. Bouvier M. Oligomerization of G-protein-coupled transmitter receptor. Nat Rev Neurosci 2001;2:274-286. [ Links ]
11. Shimekake Y, Nagata K, Ohta S, Kambayashi Y, Teraoka H, Kitamura K, Eto T, Kangawa K, Matsuo H. Adrenomedullin stimulates two signal transduction pathways, cAMP accumulation and calcium mobilization in bovine aortic endothelial cells. J Biol Chem 1995;270:4412-4417. [ Links ]
12. Bayram Z, Golbasi I, Ozdem SS. The role of nitric oxide and potassium channels in the effect of adrenomedullin in human internal thoracic arteries. Regul Pept 2010;161: 92-96. [ Links ]
13. Samson WK. Adrenomedullin and the control of fluid and electrolyte homeostasis. Annu Rev Physiol 1999;61:363-389. [ Links ]
14. De Matteo R, May CN. Direct coronary vasodilator action of adrenomedullin is mediated by nitric oxide. Br J Pharmacol 2003;140:1414-1420. [ Links ]
15. Eto T, Kitamura K, Kato J. Biological and clinical roles of adrenomedullin in circulation control and cardiovascular diseases. Clin Exp Pharmacol Physiol 1999;26: 371-380. [ Links ]
16. Lainchbury JG, Cooper GJS, Coy DH, Jiang NY, Lewis LK, Yandle TG, Richards AM, Nicholls MG. Adrenomedullin a hypotensive hormone in man. Clin Sci 1997;92:467-472. [ Links ]
17. Parkes DG, May CN. Direct cardiac and vascular actions of adrenomedullin in conscious sheep. Br J Pharmacol 1997;120:1179-1185. [ Links ]
18. Tsuruda T, Kato J, Kitamura K, Kuwasako K, Imamura T, Koiwaya Y, Tsuji T, Kangawa K, Eto T. Adrenomedullin: a possible autocrine or paracrine inhibitor of hypertrophy of cardiomyocytes. Hypertension 1998;31:505-510. [ Links ]
19. Savoia C, Schiffrin EL. Significance of recently identified peptides in hypertension: endothelin, natriuretic peptides, adrenomedullin, leptin. Med Clin N Am 2004;88:39-62. [ Links ]
20. Kato J, Kitamura K, Kuwasako K, Tanaka M, Ishiyama Y, Shimokubo T, Ichiki Y, Nakamura S, Kangawa K, Eto T. Plasma adrenomedullin in patients with primary aldosteronism. Am J Hypertens 1995;8:997-1000. [ Links ]
21. Shinomiya K, Ohmori K, Ohyama H, Hosomi N, Takahashi T, Osaka K. Association of plasma adrenomedullin with carotid atherosclerosis in chronic ischemic stroke. Peptides 2001;22:1873-1880. [ Links ]
22. Ishimitsu T, Ono H, Minami J, Matsuoka H. Pathophysiologic and therapeutic implications of adrenomedullin in cardiovascular disorders. Pharmacol Ther 2006;111: 909-927. [ Links ]
23. Bunton DC, Petrie MC, Hillier C, Johnston F, McMurray JJV. The clinical relevance of adrenomedullin: a promising profile?. Pharmacol Ther 2004;103:179-201. [ Links ]
24. Kato J, Tsuruda T, Kita T, Kitamura K, Eto T. Adrenomedullin: a protective factor for blood vessels. Arterioscler Thromb Vasc Biol 2005;25:2480-2487. [ Links ]
25. Pan CS, Zhang J, Yu F, Teng X, Cao CQ, Wu W, Tang CS, Qi YF. Adrenomedullin ameliorates the development of atherosclerosis in apoE -/- mice. Peptides 2010;31: 1150-1158. [ Links ]
26. Rossi F, Bertone C, Petricca S, Santiemma V. Adrenomedullin antagonizes angiotensin II-stimulated proliferation of human aortic smooth muscle cells. Peptides 2006;27:2935-2941. [ Links ]
27. Sata M, Kakoki M, Nagata D, Nishimatsu H, Suzuki E, Aoyagi T, Sugiura S, Kojima H, Nagano T, Kangawa K, Matsuo H, Omata M, Nagai R, Hirata Y. Adrenomedullin and nitric oxide inhibit human endothelial cell apoptosis via a cyclic-GMP independent mechanism. Hypertension 2000;36:83-88. [ Links ]
28. Yoshimoto T, Fukai N, Sato R, Sugiyama T, Ozawa N, Shichiri M, Hirata Y . Antioxidant effect of adrenomedullin on angiotensin II-induced reactive oxygen species generation in vascular smooth muscle cells. Endocrinology 2004;145:3331-3337. [ Links ]
29. Nishikimi T, Tadokoro K, Mori Y, Wang X, Akimoto K, Yoshihara F, Minamino N, Kangawa K, Matsuoka H. Ventricular adrenomedullin system in the transition from LVH to heart failure in rats. Hypertension 2003;41:512-518. [ Links ]
30. Jougasaki M, Grantham JA, Redfield RR, Burnett Jr. JC. Regulation of cardiac adrenomedullin in heart failure. Peptides 2001;22:1841-1850. [ Links ]
31. Jougasaki M, Rodeheffer RJ, Redfield RR, Yamamoto K, Wei CM, McKinley LS, Burnet Jr JC. Cardiac secretion of adrenomedullin in human heart failure. J Clin Invest 1996; 97:2370-2376. [ Links ]
32. Nagaya N, Satoh T, Nishikimi T, Uematsu M, Furuichi S, Sakamaki F, Oya H, Kyotani S, Nakanishi N, Goto Y, Masusa Y, Miyakate K, Kangawa K. Hemodynamic, renal and hormonal effects of adrenomedullin infusion in patients with congestive heart failure. Circulation 2000;101:498-503. [ Links ]
33. Jougasaki M, Wei CM, Aarhus LL, Heublein DM, Sandberg SM, Burnett Jr. JC. Renal localization and actions of adrenomedullin: a natriuretic peptide. Am J Physiol 1995; 268: F567-F663. [ Links ]
34. Ito K, Yoshii H, Asano T, Seta K, Mizuguchi Y, Yamanaka M, Tokonabe S, Hayakawa M, Asano T. Adrenomedullin increases renal nitric oxide production and ameliorates renal injury in mice with unilateral ureteral obstruction. J Urol 2010;183:1630-1635. [ Links ]
35. Segawa K, Minami K, Sata T, Kuroiwa A, Shigematsu A. Inhibitory effect of adrenomedullin on rat mesangial cell mitogenesis. Nephron 1996;74:577-579. [ Links ]
36. Malyszko J. Mechanism of endothelial dysfunction in chronic kidney disease. Clin Chim Acta 2010;411:1412-1420. [ Links ]
37. Ishihara T, Yokota N, Hisanaga S, Fujimoto S, Hirayama N, Kato J, Kitamura K, Eto T. Increased plasma levels of mature form of adrenomedullin in patients with chronic renal failure. Clin Nephrol 1999;52:119-123. [ Links ]
38. Sato K, Hirata Y, Imai T, Iwashina M, Marumo F. Characterization of immunoreactive adrenomedullin in patients on hemodialysis. Life Sci 1995;57:189-194. [ Links ]
39. Cases A, Esforzado N, Vera M, Lario S, López-Pedret J, Jiménez W, Rivera-Fillat F. Niveles elevados de adrenomedulina en pacientes hipertensos en programa de hemodiálsis. Nefrologia 2000;20:424-430. [ Links ]
40. Martínez A, Weaver C, Lopez J, Bhathena SJ, Elsasser TH, Miller MJ, Moody TW, Unsworth EJ, Cuttitta F. Regulation of insulin secretion and blood glucose metabolism by adrenomedullin. Endocrinology 1996;137:2626-2632. [ Links ]
41. Martínez A, Kapas S, Miller MJ, Ward Y, Cuttitta F. Coexpression of receptors for adrenomedullin, calcitonin gene-related peptide, and amylin in pancreatic beta – cells. Endocrinology 2000;141:406-411. [ Links ]
42. Lima M, Rosa F, Marin A. Síndrome Metabólico y adiponectina. Infor Med 2008;10: 195-201. [ Links ]
43. Nambu T, Arai H, Komatsu Y, Yasoda A, Moriyama K, Kanamoto N. Expression of the adrenomedullin gene in adipose tissue. Regul Pept 2005;132:17-22. [ Links ]
44. Paulmyer-Lacroix O, Desbriere R, Poggi M, Achard V, Alessi MC, Boudouresque F, Ouafik LH, Vuaroqueaux V, Labuhn M, Dutourand A, Grino M. Expression of adrenomedullin in adipose tissue of lean and obese women. Eur J Endocrinol 2006;155: 177-185. [ Links ]
45. Torres Ch, Lima M, Rosa F, Saadtjian M, Guerra E, Rodney H, Rodney M, Zagala M, Romero-Vecchione E, Bonoli S. Niveles de adrenomedulina en pacientes con síndrome metabólico. Avances Cardiol 2010;30 (sup. 1):S40. [ Links ]
46. Torres Ch, Rosa F, Lima M, Zagala M, Rodney M, Rodney H, Romero-Vecchione E, Guerra E. Asociación entre adrenomedulina plasmática y tejido adiposo epicárdico como predictor de riesgo cardiovascular en pacientes con síndrome metabólico. Avances Cardiol 2010;30 (sup. 1):S32. [ Links ]
47. Li Y, Totsune K, Takeda K, Furuyama K, Shibahara S, Takahashi K. Differential expression of adrenomedullin and resistin in 3T3-L1 adipocytes treated with tumor necrosis factor-alpha. Eur J Endocrinol 2003;149:231-238. [ Links ]
48. Shimosawa T, Ogihara T, Matsui H, Asano T, Ando K, Fujita T. Deficiency of adrenomedullin induces insulin resistance by increasing oxidative stress. Hypertension 2003;41:1080-1085. [ Links ]
49. Zudaire E, Cuttitta F, Martínez A. Regulation of pancreatic physiology by adrenomedullin and its binding protein. Regul Pept 2003;112:121-130. [ Links ]
50. Martínez A, Elsasser TH, Bhathena SJ, Pío R, Buchanan TA, Macri CJ, Cuttitta F. Is adrenomedullin a causal agent in some cases of type 2 diabetes?. Peptides 1999;20: 1471-1478. [ Links ]
51. García-Unzueta MT, Montalban C, Pesquera C, Berrazueta JR, Amado JA. Plasma adrenomedullin levels in type 1 diabetes. Relationship with clinical parameters. Diabetes Care 1998; 21:999-1003. [ Links ]
52. Hayashi M, Shimosawa T, Isaka M, Yamada S, Fujita R, Fujita T. Plasma adrenomedullin in diabetes. Lancet 1997;350:1449-1450. [ Links ]