Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. v.9 n.2 Mérida ago. 2011
Efectos de exposición ocupacional a plaguicidas sobre la integridad de la cromatina espermática
Roald Gómez-Pérez1, Gerardo Rojas1, Leticia Miranda-Contreras2, Ibis Cruz1, Lisbeth Berrueta3, Siham Salmen3, Carlos A. Contreras4, Alirio Balza2, Leisalba Zavala2, Melisa Colmenares2, Silvio Barreto2, Yasmín Morales2, Jesús A. Osuna.1
Unidad de Endocrinología1, IAHULA, Laboratorio de Andrología. Laboratorio de Neuroquímica2, Centro de Microscopía Electrónica "Dr. Ernesto Palacios Prü". Instituto de Inmunología Clínica3. Facultad de Medicina. Ingeniería de Sistemas4, Facultad de Ingeniería. Universidad de Los Andes, Mérida, Venezuela.
Dirigir correspondencia a: Dr. Roald Gómez-Pérez. E-mail: roaldg@hotmail.com
RESUMEN
Objetivo: Evaluar los efectos de la exposición a plaguicidas organofosforados y carbamatos sobre la integridad de cromatina espermática en trabajadores agrícolas.
Métodos: Se evaluaron 64 trabajadores del campo, con edades entre 18 y 55 años, de la comunidad rural de Bailadores, Municipio Rivas Dávila, Estado Mérida, Venezuela, expuestos directamente a plaguicidas. Para el diagnóstico de exposición a plaguicidas, fueron determinados los niveles de las colinesterasas eritrocitaria (AChE) y plasmática (PChE). Para evaluar la fertilidad masculina, a cada trabajador se le realizó seminograma y se les evaluó la integridad de la estructura de cromatina espermática mediante la técnica "Sperm Chromatin Structure Assay" (SCSA).
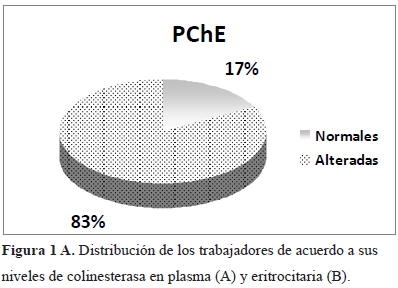
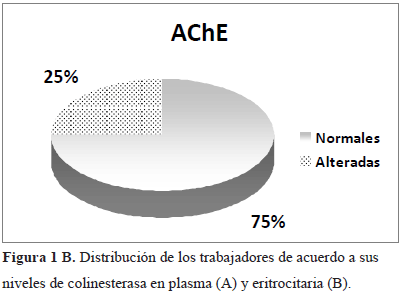
Resultados: El 25% de los trabajadores agrícolas presentó niveles deprimidos de AChE y el 83% con niveles anormales de PChE, con una reducción <75% del nivel normal. El grupo con edades entre 18 y 28 años fue el más afectado. Diferencias significativas fueron obtenidas en los promedios de los niveles de colinesterasas entre los casos normales y alterados, tanto para AChE (3,95±0,42 vs. 2,72±0,16, ρ<0,0001) así como para PChE (2,08±0,25 vs. 1,43±0,32, ρ<0,0001). El 69,7% de los trabajadores con niveles anormales de PChE presentó alteración en el ADN espermático. Se encontró una correlación negativa significativa entre el Índice de Fragmentación de ADN (IDF) espermático y los niveles de PChE (ρ=0,02).
Conclusiones: En trabajadores agrícolas expuestos directamente a plaguicidas organofosforados y carbamatos, un alto porcentaje presentó niveles anormalmente deprimidos de PChE, junto con alteración en el ADN espermático. Estos resultados demuestran que los trabajadores se encuentran con alto riesgo de exposición a los efectos tóxicos de plaguicidas, lo cual efectivamente se comprueba con los resultados de análisis de las enzimas colinesterasas y la aplicación de la técnica SCSA para determinar la integridad de la cromatina espermática.
Palabras claves: Organofosforados y carbamatos, colinesterasas, cromatina espermática.
ABSTRACT
Objective: To evaluate the effects of exposure to organophosphate and carbamate pesticides on the integrity of sperm chromatin in farm workers.
Methods: In this study, we evaluated 64 farm workers, aged between 18 and 55 years, from the rural community of Bailadores, Municipality of Rivas Dávila, Mérida State, Venezuela, directly exposed to pesticides. For the diagnosis of pesticide exposure, levels of erythrocyte (AChE) and plasma (PchE) cholinesterases. were determined. To evaluate male fertility, each worker underwent semen analysis and the integrity of sperm chromatin structure was assessed using the "Sperm Chromatin Structure Assay (SCSA) technique.
Results: The results of this study showed that 25% of agricultural workers had depressed levels of AChE and a majority, 83%, was found with abnormal levels of PChE. The group with corresponding ages between 18 and 28 years was the most affected. Significant differences were obtained in the average cholinesterase levels between normal and altered cases for both AChE (3.95 ± 0.42 vs. 2.72 ± 0.16, p < 0.0001) and PChE (2.08 ± 0.25 vs. 1.43 ± 0.32, ρ < 0.0001). Among workers with abnormal PChE levels, 69.7% presented alterations of sperm chromatin structure. There was a significant negative correlation between sperm DNA Fragmentation Index (DFI) and the levels of PChE (ρ = 0.02).
Conclusions: In agricultural workers directly exposed to organophosphate and carbamate pesticides, a high percentage showed abnormally depressed PChE, along with altered sperm chromatin structure. These results show that farm workers are at high risk of exposure to the toxic effects of pesticides, which were effectively demonstrated with the results of analysis of cholinesterase enzymes and the implementation of the SCSA technique for determining the status of the sperm chromatin structure.
Keywords: Organophosphates and carbamates, cholinesterase, sperm chromatin.
Artículo recibido en: Noviembre 2010. Aceptado para publicación en: Febrero2011.
INTRODUCCIÓN
La función reproductiva masculina es altamente sensible a muchos agentes disruptores endocrinos generados por las actividades industriales y agrícolas1,3. Los disruptores endocrinos son elementos químicos, físicos y ambientales capaces de bloquear o activar los receptores hormonales y afectar particularmente los niveles de hormonas sexuales, tanto testosterona como estradiol. La mayoría de los plaguicidas, particularmente los organofosforados y carbamatos, actúan como disruptores endocrinos4. Yucra y colaboradores5 hallaron una disminución significativa en los niveles séricos de LH de individuos expuestos a plaguicidas organofosforados y carbamatos, en contraste con otros trabajos que reportaron incremento en los niveles séricos de LH y FSH mientras que los niveles de testosterona estuvieron en descenso6,7.
Los plaguicidas organofosforados y carbamatos producen daño al combinarse con las colinesterasas, inactivándolas y aumentando la actividad de la acetilcolina. Con ello se produce una activación del receptor muscarínico de la acetilcolina con aumento del tono parasimpático. Si la acción de los fosforados es más intensa y persistente se observa efectos neuromusculares por activación de receptores nicotínicos (temblores, convulsiones y por último, parálisis muscular) que conlleva a la muerte8,10. La medición de la actividad de colinesterasas en sangre es usada como un marcador biológico de contaminación por organofosforados y carbamatos. Una reducción del 50% de la actividad de colinesterasa en plasma es un indicador de toxicidad aguda por estos agroquímicos. La actividad de AChE disminuye más lentamente en relación con la actividad de la PChE, por lo que su medición indica la exposición crónica a organofosforados y carbamatos11. Aunque el monitoreo de colinesterasas tiene la ventaja de proporcionar una medición de respuesta fisiológica, esto tiene también desventajas. La interpretación del monitoreo de AChE es complicada por la variación de la actividad enzimática inter e intraindividual y el uso de otros plaguicidas inhibidores de colinesterasas como los carbamatos12. De la misma manera, la ausencia de valores basales para cada sujeto hace difícil conocer si los niveles observados de la actividad de AChE ó PChE representa una depresión por la exposición a un organofosforado, ó si el valor es normal para cada sujeto.
Estudios en ratas han podido comprobar que existen muchos mecanismos posibles para la acción antigonadal de los plaguicidas organofosforados y carbamatos; así, puede ejercer directamente una acción inhibitoria sobre los testículos o afectar la hipófisis y causar cambios en la concentración de gonadotropinas con el subsiguiente daño testicular13. Los organofosforados y carbamatos producen un incremento en la morfología anormal de los espermatozoides14. Altas dosis del organofosforados "quinalpos" daña los túbulos seminíferos reduciendo el área tubular debido al colapso del epitelio seminífero13.
Una consecuencia obvia e indeseable de los compuestos tóxicos es la infertilidad, definida como la incapacidad de concebir después de un año de cópulas sin protección que concierne aproximadamente al 15% de parejas en los países occidentales15,16. En nuestros días, existe un incremento de riesgo potencial de los agentes ambientales físicos, químicos y genéticos sobre la infertilidad masculina, por lo que no es de extrañar que la media de la concentración de espermatozoides en varones se haya reducido progresivamente en los últimos 100 años3,17. El daño tóxico a los testículos puede resultar en disminución en el volumen seminal y la producción de espermatozoides defectuosos. Los plaguicidas organofosforados y carbamatos también pueden influir en el factor genético, además de que son compuestos tóxicos testiculares que causan alteraciones citotóxicas y citocinéticas reversibles en las células germinales18. Existe una acción directa del Paratión y Paraoxón en la vitalidad espermática como también en la integridad de la membrana espermática19.
Las anormalidades en el genoma se pueden evidenciar a través del daño al ADN espermático, las cuales no se evidencian en el análisis tradicional del semen, siendo necesaria la realización de otros análisis complementarios que permiten estudiar lesiones en la estructura del material genético del espermatozoide. A mayor número de lesiones menor será la integridad del material genético y las probabilidades de que se logre la fertilización y un embarazo a término20. Los espermatozoides con altos niveles de fragmentación tienen baja probabilidad de fertilizar aunque morfológicamente parezcan normales según los parámetros tradicionales de análisis del semen. Pacientes con niveles de fragmentación mayor al 30% tienen una reducción significativa en la tasa de embarazos, con un porcentaje duplicado de abortos20. Estos espermatozoides con ADN dañado pueden fertilizar ovocitos en metafase II con la misma eficacia que espermatozoides con ADN intacto. El ADN dañado podría ser reparado por el ovocito después de la fertilización, pero éste depende de la calidad citoplasmática y genómica del ovocito y el grado de daño en las cadenas del espermatozoide que haya fecundado al ovocito21.
En la última década, se ha reconocido que el daño del ADN de los espermatozoides puede ser la explicación de un elevado porcentaje de estos casos idiopáticos de infertilidad 22,23, de tal modo que el estudio de fragmentación del ADN de los espermatozoides es un tema de intensa investigación con numerosas publicaciones en revistas especializadas 24-35. Todos los estudios ponen en evidencia que los espermatozoides con ADN defectuoso pueden tener una morfología, motilidad y capacidad de fecundación normal, pero no generar embarazos viables, por lo que la valoración de la integridad del ADN se convertiría en un nuevo parámetro de fertilidad independiente de los demás, que debe añadirse a las pruebas de estudio de fertilidad en el hombre.
Por lo anteriormente expuesto y realizando nuestras actividades en una región eminentemente agrícola, donde hemos constatado que no se aplican las medidas de protección en cuanto a preparación y aplicación de los plaguicidas, a pesar que se conocen sus efecto sobre la salud, no sólo de las personas, sino también sobre el medio ambiente, y con base al posible efecto de estos compuestos químicos sobre el sistema reproductor masculino, planteamos realizar un estudio para conocer la relación entre los niveles de exposición de obreros del campo a los plaguicidas, con su función reproductiva y en particular con la calidad del semen.
MATERIALES Y MÉTODOS
Se realizó un estudio clínico epidemiológico, de tipo transversal, en el cual se evaluaron 64 hombres, con edades comprendidas entre 18 y 55 años de edad, seleccionados al azar, con participación voluntaria, quienes realizan diariamente trabajos del campo en diferentes cultivos de la comunidad rural de Bailadores, Municipio Rivas Dávila, Estado Mérida, Venezuela, y con historia de exposición a plaguicidas organofosforados y carbamatos en forma directa. Se tomaron como criterios de exclusión todas aquellas patologías que modificaban los niveles de colinesterasa en plasma y en los glóbulos rojos (enfermedades hepáticas y renales, metabólicas, etc.) así como todas aquellas patologías que afectaran la reproducción masculina (testiculares: orquitis, varicocele, criptorquidia, etc.; enfermedades de transmisión sexual recientes). Cada participante firmó un Consentimiento Informado, de acuerdo con las Normas internacionales establecidas en la Declaración de Helsinski para la protección de los sujetos de investigación, el cual fue aprobado por el Comité de Ética del Consejo de Desarrollo Científico Humanístico, Tecnológico y de las Artes (CDCHTA) de la Universidad de Los Andes, explicándosele la naturaleza del estudio y la importancia del mismo. Se les elaboró una historia clínica, registrándose los datos demográficos de cada uno de ellos, sus antecedentes personales patológicos y no patológicos, antecedentes familiares, hábitos psicobiológicos y los hallazgos del examen físico. Se le realizó un examen físico completo evaluándose cada uno de los aparatos y sistemas (cardiovascular, respiratoria, abdominal, neurológico), presencia o no de bocio y ginecomastia. Se hizo énfasis en el área endocrinológica y en el examen de los genitales externos, contenido de las bolsas escrotales, dimensiones y forma de los testículos, descartar la presencia de dilataciones venosas del plexo pampiniforme y dimensiones del pene.
Análisis de Semen: las muestras de semen, se obtuvieron siguiendo instrucciones especiales y según las normas de las OMS. En cada semen se realizaron dos estudios: con la muestra en fresco se evaluaron los parámetros seminales convencionales (características físicas y estudio citomorfológico), según Manual de la OMS36. El análisis fue realizado por los miembros del Laboratorio de Andrología de la ULA, determinándose: pH, concentración espermática/mL y total, porcentaje de motilidad, vitalidad y morfología espermática, descartar leucocitospermia. En el segundo estudio, con la muestra fijada y trasladada al Instituto de Inmunología "Luis Pasteur", se evaluó la integridad de la cromatina espermática mediante citometría de flujo utilizando el procedimiento para SCSA, basado en el método de Evenson y Jost37 con modificaciones menores por Cruz y col.38. Los resultados del Índice de Fragmentación del ADN espermático (IDF) fueron expresados en porcentajes y considerados como normales cuando los mismos se encontraron por debajo del 30%.
Análisis de Colinesterasas: Los niveles de colinesterasas AChE y PChE se determinaron en muestras de sangre capilar, empleando un procedimiento cinético basado en el Método de Ellman39, utilizando un equipo portátil para el trabajo de campo, Test-Mate OP field kit (EQM Research Inc., USA); el Test Mate Assay Kit Modelo 460 fue empleado para la determinación de AChE y el Modelo 470, para PChE. Se realizó usando 10 μL de sangre obtenido por capilaridad, el cual se colocó en un vial conteniendo los correspondientes reactivos y pasado al analizador, previamente agitado por 15 segundos, luego se retiró del mismo y se le colocó el Reactivo de Ellman, nuevamente fue colocado en el analizador y luego de un minuto de incubación, se leen los valores de AChE. El mismo procedimiento se aplica para la determinación de PChE utilizando 10 μL de muestra de plasma en vez de sangre total. Se consideran anormales los valores menores a 75% y 70% de actividad de colinesterasas plasmática y eritrocitaria, respectivamente, respecto a los valores normales, los cuales indican exposición a organofosforados ó carbamatos aunque los síntomas pueden no aparecer hasta que las cifras de estas enzimas se han reducido a 20% o menos 4,11,12.
Análisis estadístico: Los datos fueron procesados en SPSS 15 y se presentaron en tablas y gráficos; las variables categóricas en números y porcentajes, las variables continuas en promedios y desviaciones estándar. Para establecer diferencias entre las variables continuas, en vista de que mostraron distribución normal, se utilizaron el análisis de varianza (ANOVA) para comparar los grupos de edad y la T de Student para muestras independientes, para las demás variables. Para establecer la asociación entre las variables categóricas se aplicó el Chi Cuadrado. Se realizó una matriz de correlación de Pearson entre las variables. Se consideró una ρ < 0.05 como estadísticamente significativa.
RESULTADOS
Se estudiaron 64 trabajadores agrícolas expuestos ocupacionalmente a plaguicidas, cuyas edades se distribuyeron según las siguientes: la edad del grupo con mayor número de participantes (37%) fue entre 18-28 años, seguida del grupo entre 29-39 años (33%) y finalmente el grupo de mayores de 40 años (30%).
De acuerdo al tiempo de exposición, la mayor proporción (56%) de los participantes tienen más de 3 años de exposición continua a plaguicidas, el 21% tienen de 2 - 3 años de exposición y finalmente el grupo de < 1 año de exposición constituye un 9%.
Según el número de días laborables de exposición por semana, encontramos que la mayoría de los trabajadores (68%) se dedican al trabajo de fumigación de 1 a 3 días por semana, el 3% fumiga diariamente y el 8% una ó dos veces al mes. El 3% de los encuestados, no son fumigadores pero trabajan manipulando plaguicidas como vendedores de estos productos o como encargados de su almacenaje.
Al realizar la distribución de los pacientes de acuerdo a los niveles de PChE, encontramos que un 83% de los trabajadores presenta niveles alterados, con valores menores del 75% de la actividad enzimática normal, siendo este resultado un indicativo de exposición reciente a plaguicidas organofosforados y carbamatos (Figura 1A).
Con respecto al nivel de AChE, un biomarcador de exposición crónica a los plaguicidas organofosforados y carbamatos, encontramos que el 25% de los trabajadores presentó valores anormales de AChE, que corresponden a valores menores del 70% de la actividad enzimática normal (Figura 1B).
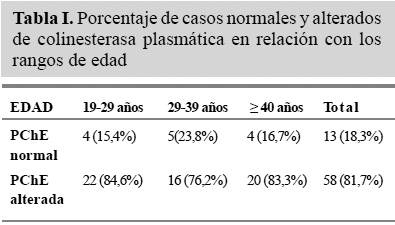
Distribuidos por edad (Tabla I), la mayor proporción de trabajadores expuestos (30%) correspondió al grupo menor de 28 años, debido a que la mayoría de los fumigadores ó los que manejan plaguicidas son jóvenes que no se protegen adecuadamente, no usan todos los elementos de protección recomendados y en muchos casos utilizan solamente botas cuando realizan esta actividad.
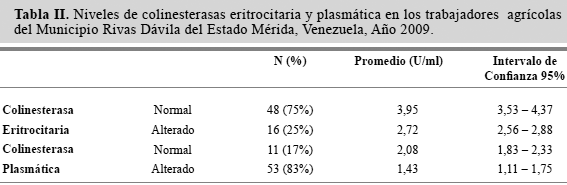
En la Tabla II se presentan los niveles de las colinesterasas eritrocitaria y plasmática en los trabajadores agrícolas que laboran en Bailadores, Municipio Rivas Dávila, Estado Mérida, Venezuela. En general, se puede apreciar una disminución significativa en los promedios de la actividad de colinesterasas entre los casos normales y alterados, tanto para la colinesterasa eritrocitaria (ρ < 0,0001) asícomo para la plasmática (ρ< 0,0001).
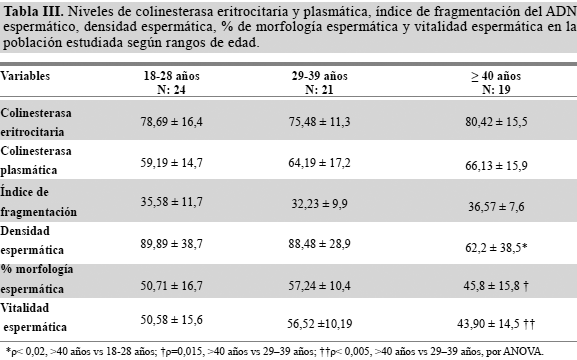
Con respecto a la integridad de la cromatina espermática (Tabla III), encontramos que el 72% de la muestra (N=46) presentó alteración de la misma, en comparación con apenas el 28% de aquellos con niveles normales del ADN espermático (X= 35±12). Al distribuir los trabajadores con base a sus edades y los diferentes parámetros del semen estudiados, se encontró una diferencia estadísticamente significativa en relación con la densidad espermática del grupo > 40 años vs el grupo de 29–39 años (62,2 ± 38,5 y 88,48 ± 28,9, respectivamente; ρ<0,02); el porcentaje de morfología espermática del grupo > 40 años vs el grupo de 29–39 años (45,8 ± 15,8 y 57,24 ± 10,4, respectivamente; ρ=0,015) y la vitalidad espermática también del grupo > 40 años vs el grupo de 29-39 años (43,90 ± 14,5 y 56,52 ± 10,19, respectivamente; ρ<0,005).
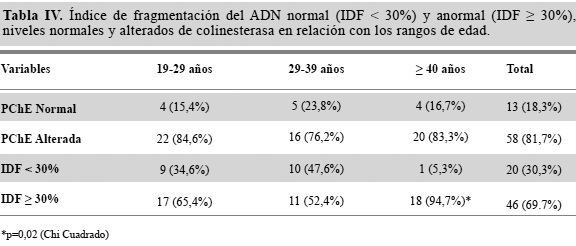
Al distribuir los trabajadores con base a la fragmentación del ADN espermático y de acuerdo a los niveles de colinesterasa plasmática (Tabla IV), se encontró que el grupo que tenía el porcentaje más elevado del ADN fragmentado era el grupo que tenía niveles bajos de colinesterasa plasmatica (66%). Cuando se separaron los trabajadores con base a grupos de edad, el grupo que mostró mas afectación fue el mayor de 40 años, con una asociación estadísticamente significativa entre los niveles anormales de colinesterasa y la mayor frecuencia de anormalidades en el IDF espermático (p=0,02).
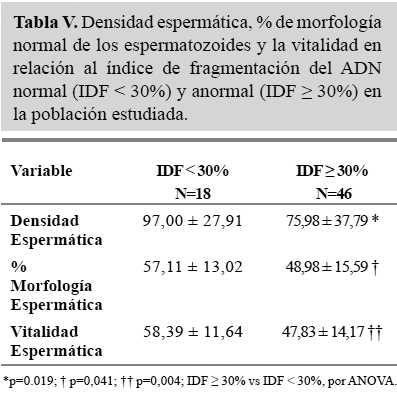
Al asociar el IDF espermático normal (IDF < 30%) y anormal (IDF ≥ 30%) con las diferentes variables del semen evaluadas según la OMS (Tabla V), se encontró una relación importante entre el ADN más alterado y la menor densidad espermática (75,98 ± 37,79 vs 97,00 ± 27,91; p=0.019), menor porcentaje de morfología normal (48,98 ± 15,59 vs 57,11 ± 13,02; p=0,041) y menor vitalidad espermática (47,83 ± 14,17 vs 58,39 ± 11,64; p=0,004).
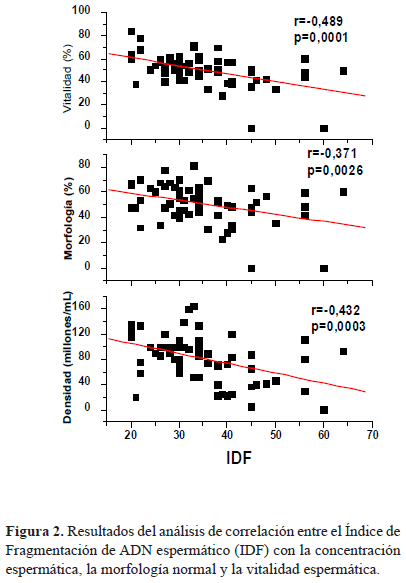
Al establecer una relación entre las variables IDF espermático, la densidad espermática (millones/mL), la morfología normal (%), y la vitalidad espermática se encontró una correlación lineal negativa o inversa, es decir, a medida que se incrementa el IDF espermático disminuyen las densidades espermáticas, la morfología normal de los espermatozoides y la vitalidad de los mismos (Figura 2).
DISCUSIÓN
En este grupo de hombres se analizó el grado de fragmentación del ADN espermático mediante la técnica SCSA, junto con el análisis del semen, según los criterios de la OMS, y los niveles de colinesterasas en sangre.
La determinación de la actividad de colinesterasas, tanto plasmática como eritrocitaria, nos permitió establecer que los trabajadores de esta muestra habían estado expuestos a plaguicidas y en particular a organofosforados y carbamatos. Los niveles de colinesterasa plasmática revelaron que del total de la población, 53 trabajadores, lo cual representa un 83% de la muestra, presentaron niveles alterados de la enzima. Distribuidos por edad, la mayor proporción correspondió al grupo menor de 28 años, debido tal vez a que por desinformación no siguieron las recomendaciones mínimas para el uso de los plaguicidas.
Cuando relacionamos el Índice de Fragmentación del ADN espermático con los niveles de colinesterasas, observamos que los trabajadores con valores más altos del Índice de Fragmentación del ADN espermático fueron los que presentaron niveles anormalmente bajos de colinesterasa, lo cual predominó en los trabajadores mayores de 40 años.
Al evaluar el semen en fresco de todos los trabajadores, siguiendo los criterios establecidos por la OMS, encontramos una diferencia significativa entre el grupo mayor de 40 años con relación a los otros grupos. Llama la atención que aunque estos parámetros seminales están alterados, no alcanzan a estar por debajo de los valores de referencia para considerarlos anormales. Todos estos cambios podrían estar relacionados con el factor edad de los pacientes, al cual se suma el efecto nocivo de los plaguicidas.
Nuestros hallazgos se asemejan a los obtenidos en los trabajos de Padungtod y col.40, quienes encontraron reducción significativa de la concentración espermática (35,9 x 106 vs 62,8 x 106, ρ < 0,01) y del porcentaje de la motilidad (57% vs 61%, ρ = 0,13) en sujetos expuestos a plaguicidas. Observaciones similares son las comunicadas por Yucra y col.5, los cuales concluyeron que en todos aquellos trabajadores expuestos a estas sustancias, presentaron reducciones significativas en el volumen seminal, el porcentaje de motilidad, el porcentaje de espermatozoides con morfología normal, los niveles de hormona luteinizante, de testosterona y la concentración de zinc, así como un aumento de la licuefacción, pH, porcentaje de espermatozoides inmaduros y la concentración de leucocitos. Recio-Vega y col.41, demostraron disminuciones significativas en la concentración de espermatozoides.
La investigación de Contreras y cols.42 demostró que la vitalidad y la integridad de la membrana espermática disminuyen de manera significativa, en relación dosis dependiente, como consecuencia de la acción de estas sustancias sobre el ADN y las proteínas, debido a sus propiedades alquilantes y electrofílicas.
Más recientemente en nuestro país, Mármol y col.43 encontraron que al evaluar un grupo de trabajadores expuestos a plaguicidas, encontraron alteraciones en diferentes variables espermáticas, tales como la concentración espermática, la motilidad y la vitalidad.
De los pacientes de nuestro estudio, 46 presentaron IDF espermático igual ó superior al 30%, lo que representa un 69,7% de la muestra. La distribución por grupos de edades muestra que los más afectados son los mayores de 40 años, lo cual podría explicarse por el efecto edad, puesto que a medida que aumenta la edad aumenta el grado de fragmentación del ADN espermático. Sin embargo, es de hacer notar que el grupo que le sigue es de los más jóvenes, entre 18 y 28 años, en quienes los mecanismos protectores que eliminan y/o reparan los espermatozoides alterados son más eficientes; por lo tanto, es posible que otros factores presentes en el medio ambiente sean los causantes de esa alteración.
Cuando estudiamos la relación entre el IDF espermático y los parámetros seminales, se encontró que los hombres con IDF ≥ 30% presentaron niveles más bajos de densidad espermática que aquellos con IDF < 30%, menor porcentaje de morfología espermática normal y menor vitalidad espermática, valores que no estuvieron por debajo de los mínimos de referencia para considerarlos alterados. Estos hallazgos se corresponden con los del estudio de Evenson y Wixon44 en el cual un grupo de hombres jóvenes que vivían en una zona rural expuestos a plaguicidas tenían altos niveles de abortos y altas tasas de infertilidad, con parámetros seminales normales según la OMS, que no explicaban los problemas mencionados. Cuando a esos trabajadores se les realizó el análisis de la fragmentación del ADN espermático, los autores encontraron niveles elevados de los mismos, estableciendo una correlación importante entre la fragmentación del ADN de los espermatozoides y las altas tasas de abortos e infertilidad. Además, se comprobó una correlación negativa entre la cromatina espermática alterada y los parámetros seminales, lo cual nos permitió concluir que el SCSA es una excelente herramienta para el diagnóstico y pronóstico de la infertilidad masculina.
Nuestras observaciones aportan información sobre el manejo inadecuado de agroquímicos y de plaguicidas en particular, y sus efectos nocivos sobre la salud de los trabajadores del campo, lo cual no es un hecho aislado como el que hemos podido constatar en Bailadores,
sino que es general en la explotación de la tierra en nuestro país. A pesar de que existe legislación sobre el uso de los agroquímicos, ocurre como en otras actividades, el irrespeto a las leyes, creando mayores riesgos para nuestro deteriorado medio ambiente y para nuestros recursos naturales.
CONCLUSIONES
Con base a los resultados de este estudio y las evidencias recogidas en la comunidad rural de Bailadores, podemos afirmar que la mayoría de las personas que allí trabajan en labores agrícolas, no cumplen con las normas fundamentales para el manejo de agroquímicos y de plaguicidas en particular, sufriendo las consecuencias de la exposición diaria a esas sustancias tóxicas, las cuales no solo afectan su salud, sino también contribuyen al deterioro del medio ambiente, provocando además daños irreversibles en la biodiversidad.
Encontramos un alto porcentaje de alteraciones en el material genético (ADN) de los espermatozoides en este grupo de trabajadores, expresado a través de una nueva técnica de estudio, el SCSA, cuyos resultados contrastan con los obtenidos de las variables del semen, las cuales encontramos con mínimas alteraciones.
Este estudio además nos permitió poner en práctica una tecnología para evaluar la capacidad funcional de los espermatozoides, la cual, de acuerdo con los resultados de diferentes investigadores en biología y medicina de la reproducción, abre nuevos horizontes en la investigación de la infertilidad masculina.
AGRADECIMIENTOS
Este trabajo recibió financiamiento del Consejo de Desarrollo Científico Humanístico, Tecnológico y Artes (CDCHTA) de la Universidad de Los Andes con el Proyecto M-911-07-07-A y Proyecto M-912-07-07-C, así como del FONACIT Proyecto S1-2002000281.
REFERENCIAS BIBLIOGRÁFICAS
1. Vingaard AM, Hnida C, Breinholt V, Larsen JC. Screening of selected pesticide for inhibition of CYPi19 aromatase activity in vitro. Toxicol In Vitro 2000; 14: 227-234. [ Links ]
2. Bonde J. Environmental factors. In: Comhaire FH (ed). Male infertility, clinical investigation, cause evaluation and treatment. London: Chapman and Hall; 1996. p. 267-284. [ Links ]
3. Spira A, Multigner L. The effect of industrial and agricultura pollution on human spermatogenesis. Hum Reprod 1998; 13: 2041-42. [ Links ]
4. Jaga K, Dharmani C. Sources of exposure to and public health implications of organophosphate pesticides. Rev Panam Salud Publica 2003; 14: 171-85. [ Links ]
5. Yucra S, Rubio J, Gasco M, Gonzales C, Steenland K, Gonzales GF. Semen quality and reproductive sex hormone levels in Peruvian pesticide sprayers. Int J Occup Environ Health 2006; 12:355-361. [ Links ]
6. Padungtod C, Lasley BL, Christiani DC, Ryan LM, Xu X. Reproductive hormone profile among pesticides factory workers. J Occup Environ Med 1998; 40(12): 1038-1047. [ Links ]
7. Recio R, Ocampo-Gómez G, Morán-Martínez J, Borja-Aburto V, López-Cervantes M, Uribe M, Torres-Sánchez L, Cebrián ME. Pesticide exposure alters follicle – stimulating hormone levels in Mexican agricultural workers. Environ Health Perspect 2005; 113: 1160-1163. [ Links ]
8. Heano S, Finkelman J, Albert L, De Koning H. Plaguicidas y salud en las Américas. Washington DC: OPS; 1993. [ Links ]
9. Azaroff L. Biomarkers of exposure to organophosphorus insecticides among farmers families in rural El Salvador: Factor associated with exposure. Environ Res 1999; 80:138-147. [ Links ]
10. Reigart JR, Roberts JR. Recognition and Management of pesticide poisoning. 5th ed. Washington DC: Environmental Protection Agency; 1999. [ Links ]
11. Cabanillas Moruno JL, Tamayo MF, Laynez Bretones F, Ledesma de Miguel J, López Miranda A, Planas de Alfonso C, Serrano Ramírez JL, Ventura Jiménez A (2001). Plaguicidas: Protocolos de Vigilancia Sanitaria Específica. Salud Laboral, OSALAN, Instituto Vasco de Seguridad y Salud Laborales, Abril,. Disponible: www.euskadi.net [ Links ]
12. Office of Environmental Health Hazard Assessment, Pesticide and Environmental Toxicology Section, California Environmental Protection Agency, Guidelines for physicians who supervise workers exposed to cholinesterase-inhibiting pesticides, 2002. Disponible: http://oehha.ca.gov/pesticides/pdf/docguide2002.pdf. [ Links ]
13. Sarkar R, Mohanakumar KP, Chowdhury M. Effects of an organophosphate pesticide, quinalphos, on the hypothalamus-pituitary-gonadal axis in adult male rats. J Reprod Fertil 2000; 118: 29-38. [ Links ]
14. Mathew G, Vijayalaxmi KK, Abdul Rahiman M. Methyl parathion-induced sperm shape abnormalities in mouse. Mutat Res 1992; 280: 169-73. [ Links ]
15. Thonneau P, Spira A. Prevalence of infertility: international data and problems of measurement. Eur J Obstet Gynecol Reprod Biol 1991; 38: 43-52. [ Links ]
16. Irvine DS. Epidemiology and etiology of male infertility. Hum Reprod 1998; 13(Supp.1): 33-44. [ Links ]
17. Oliva A, Spira A, Multigner L. Contribution of environmental factors to the risk of male infertility. Hum Reprod 2001; 16: 1768-1776. [ Links ]
18. Sobarzo C, Bustos-Obregón E. Sperm quality in mice acutely treated with parathion. Asian J Androl 2000; 2: 147-150. [ Links ]
19. Contreras HR, Badilla J, Bustos-Obregón E. Morphofunctional disturbances of human sperm after incubation with organophosphorate pesticides. Biocell 1999; 23: 135-141. [ Links ]
20. Poirot C, Cherruau B. Infertilidad masculina. Aspectos clínicos e investigaciones biológicas. Acta Bioquím Clín Latinoamer 2005; 39(2):225-241. [ Links ]
21. Sociedad Española de Fertilidad. Utilidad del estudio de la estructura de la cromatina espermática en el diagnóstico y tratamiento de la infertilidad. 2006. [ Links ]
22. Evenson DP, Jost LK, Marshall D, Zinaman MJ, Clegg E, Purvis K, de Angelis P, Claussen OP. Utility of the sperm chromatin structure assay as a diagnostic and prognostic tool in the human fertility clinic. Human Reprod 1999; 14:1039-1049. [ Links ]
23. Larson KL, De Jonge CJ, Barnes AM, Jost LK, Evenson DP. Sperm chromatin structure assay parameters as predictors of failed pregnancy following assisted reproductive techniques. Human Reprod 2000; 15:1722. [ Links ]
24. Evenson DP, Larson KL, Jost LK. Sperm Chromatin Structure Assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques. J Androl 2002; 23:25-43. [ Links ]
25. Muratori M., Piomboni P, Baldi E, Filimberti E, Pecchioli P, Moretti E, Gambera L, Baccetti B, Biagiotti R, Forti G, Maggi M. Functional and ultrastrucutral features of DNA-fragmented human sperm. J Androl 2000; 21:903-912. [ Links ]
26. Duru NK, Morshedi MS, Schuffner A, Oehninger S. Cryopreservation thawing of fractionated human spermatozoa is associated with membrane phosphatidylserine externalization and not DNA fragmentation. J Androl 2001; 22:646-651. [ Links ]
27. Weng SL, Taylor SL, Morshedi M, Schuffner A, Duran EH, Beebe S, Oehninger S. Caspase activity and apoptotic markers in ejaculated human sperm. Mol Hum Reprod 2002; 8:984-991. [ Links ]
28. Benchaid M, Braun V, Lornage J, Hadj S, Salle B, Lejeune H, Guérin JF. Sperm DNA fragmentation decreases the pregnancy rate in an assited reproductive technique. Hum Reprod 2003; 18:1023. [ Links ]
29. Oger I, Da Cruz C, Panteix G, Menezo Y. Evaluating human sperm DNA integrity: relationship between 8-hydroxydeoxyguanosine quantification and the sperm chromatin structure assay. Zygote 2003; 11:367-371. [ Links ]
30. Tao Y, Zhou B, Xia G, Wang F, Wu Z, Fu M. Exposure to L-ascorbic acid tocopherol facilitates the development of porcine denuded oocytes from metaphase I to metaphase II and prevents cumulus cells from fragmentation. Reprod Domest Anim 2004; 39:52. [ Links ]
31. Tesarik J, Greco E, Mendoza C. Late, but not early, paternal effect on human embryo development is related to sperm DNA fragmentation. Hum Reprod 2004; 19:611-615. [ Links ]
32. Lambard S, Galeraud-Denis I, Martin G, Levy R, Chocat A, Carreau S. Analysis and significance of mRNA in human ejaculated sperm from normozoospermic donors: relationship to sperm motility and capacitation. Mol Hum Reprod 2004; 20:125-129. [ Links ]
33. Ståhl O, Eberhard J, Jepson K, Spano M, Cwikiel M, Cavallin-Ståhl E, Giwercman A. The impact of testicular carcinoma and its treatment on sperm DNA integrity. Cancer 2004; 15:1137-1144. [ Links ]
34. Sergerie M, Laforest G, Bujan L, Bissonnette F, Bleau G. Sperm DNA fragmentation: threshold value in male fertility. Hum Reprod 2005; 20:3446-3451. [ Links ]
35. Schmid TE, Eskenazi B, Baumgartner A, Marchetti F, Young S, Weldon R, Anderson D, Wyrobek AJ. The effects of male age on sperm DNA damage in healthy non-smokers. Hum Reprod 2007; 22:180-187. [ Links ]
36. Organización Mundial de la Salud. Manual de laboratorio de la OMS para el examen del semen humano y de la interacción entre el semen y el moco cervical. Cuarta edición. Editorial Panamericana 2001. [ Links ]
37. Evenson D, Jost L. Sperm chromatin structure assay: DNA denaturability. Methods Cell Biol 1994;42 Pt B:159-176. [ Links ]
38. Cruz I, Colmenares M, Berrueta-Carrillo L, Gomez-Perez R, Montes H, Berrueta L, Salmen S, Osuna JA. Evaluación de la calidad del espermatozoide humano: comparación entre la integridad del AND espermático y variables del semen. Invest Clin 2010;51:87-99. [ Links ]
39. Ellman GL, Courtney D, Andres V Jr, Featherstone RM. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 1961; 7:88-95. [ Links ]
40. Cabanillas Moruno, J.L., Tamayo, M.F., Laynez Bretones, F., Ledesma de Miguel. J., López Miranda, A., Planas de Alfonso, C., Serrano Ramírez, J.L., Ventura Jiménez, A. Plaguicidas: Protocolos de Vigilancia Sanitaria Específica. Salud Laboral, OSALAN, Instituto Vasco de Seguridad y Salud Laborales, Abril, 2001. Disponible: www.euskadi.net. [ Links ]
41. Padungtod C, Savitz DA, Overstreet JW, Christiani DC, Ryan LM, Xu X. Occupational pesticide exposure and semen quality among Chinese workers. J Occup Environ Med 2000; 42:982-992. [ Links ]
42. Recio-Vega R, Ocampo-Gómez G, Borja-Aburto VH, Moran-Martínez J, Cebrian-Garcia ME. Organophosphorus pesticide exposure decreases sperm quality: association between sperm parameters and urinary pesticide levels. J Appl Toxicol. 2008; 28(5):674-680. [ Links ]
43. Contreras HR, Badilla J, Bustos-Obregón E. Morphofunctional disturbances of human sperm after incubation with organophosphate pesticides. Biocell 1999; 23:135-41. [ Links ]
44. Mármol ML, Fernández DJ, Sánchez B, Sirit Y. Perfil seminal en trabajadores expuestos a plaguicidas inhibidores de la colinesterasa. Invest Clin 2003; 44:105-117. [ Links ]
45. Evenson DP, Wixon R. Environmental toxicants cause sperm DNA fragmentation as detected by the Sperm Chromatin Structure Assay (SCSA). Toxicol Appl Pharmacol 2005; 207 (2 Suppl):532-537. [ Links ]