Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.10 supl.1 Mérida oct. 2012
Complicaciones macrovasculares de la diabetes mellitus: cardíacas, vásculocerebrales y enfermedad arterial periférica.
Dr. Jesús Isea, Dr. José L. Viloria, Dr. Carlos I. Ponte N., Dr. José R. Gómez M.
INTRODUCCIÓN
Como es ampliamente conocido las complicaciones vasculares de la diabetes mellitus (DM) se clasifican en macrovasculares y microvasculares, incluyéndose dentro de las primeras la enfermedad arterial coronaria, la enfermedad cerebrovascular y la enfermedad arterial obstructiva periférica.
Las complicaciones macrovasculares constituyen la causa principal de morbilidad y mortalidad en los pacientes con DM en todo el mundo: Al menos 65% de los diabéticos muere con alguna forma de enfermedad cardíaca o cerebrovascular, y la frecuencia de muerte cardiovascular en adultos diabéticos es 2 a 4 veces mayor que en sus contrapartes no diabéticos1. Los pacientes con DM, en comparación a los normales, también experimentan una reducción en la expectativa de vida y en el número de años vividos libres de enfermedad cardiovascular: Los hombres y las mujeres diabéticas de 50 años de edad viven un promedio de 7,5 y 8,2 años menos; mientras que las diferencias en expectativa de vida libre de enfermedad cardíaca se reducen en 7,8 y 8,4 años, respectivamente2.La duración de la DM parece afectar el riesgo de enfermedad cardiovascular: datos longitudinales de Framingham sugieren que por cada 10 años de duración de la DM, el riesgo relativo de enfermedad coronaria es 1,38 veces mayor (IC 95% 0,99- 1,92) y el riesgo de mortalidad por esta misma causa es 1,86 veces más alto (IC 95% 1,17-2,93)3. A pesar de la tendencia a la reducción en las cifras de morbimortalidad cardiovascular en las últimas décadas, los pacientes diabéticos continúan experimentando un riesgo mayor de hospitalizaciones y de complicaciones4.
FISIOPATOLOGÍA DE LAS COMPLICACIONES MACROVASCULARES DE LA DM
Múltiples anormalidades vasculares, metabólicas y de coagulación explican la alta prevalencia de la enfermedad aterosclerótica y sus complicaciones en los pacientes diabéticos: La DM produce disfunción del endotelio vascular con aumento de la liberación de agentes vasoconstrictores como la angiotensina-II y la endotelina-1, y reduce la actividad de la enzima óxido nítrico sintetasa endotelial, la disponibilidad de óxido nítrico (ON) y la vasodilatación mediada por el endotelio. La disfunción endotelial, favorece también la expresión de moléculas que incrementan la infiltración leucocitaria a la íntima arterial. De la misma manera, en la DM hay una mayor producción de radicales libres de oxígeno e incremento de la liberación de citoquinas que reducen la síntesis de colágeno por las células de músculo liso vascular y aumentan la producción de metaloproteinasas de matriz que favorecen la degradación del ya existente; estas dos acciones combinadas comprometen la estabilidad de la cápsula fibrosa de la placa aterosclerótica y favorecen su ruptura5.Varias alteraciones de la función plaquetaria y de la coagulación se encuentran presentes en los pacientes con DM y favorecen la trombosis sobre las placas ateroscleróticas: aumento del fibrinógeno, del factor inhibidor del activador de plasminógeno (PAI-1), de los factores de coagulación VII y VIII, de la molécula de adhesión de células vasculares (VCAM-1), de las glicoproteínas adhesivas IIb/IIIa de la superficie plaquetaria, de la producción de tromboxano A-2; además incrementos de la agregabilidad y adhesión plaquetaria, y de la glicosilación de proteínas de las plaquetas; y, simultáneamente, disminución de los niveles de antitrombina III, de las proteínas C y S, de la prostaciclina y de la disponibilidad de ON plaquetario6. Todas estas acciones proaterogénicas y protrombóticas explican la alta prevalencia de la aterosclerosis y sus consecuencias en la DM.
ENFERMEDAD ARTERIAL CORONARIA (EAC)
La DM es un factor principal de riesgo para el desarrollo de EAC; adicionalmente, la presencia de otros factores de riesgo – hipertensión arterial, dislipidemia, obesidad - frecuentemente coexisten con la DM, lo que condiciona un riesgo 2 a 4 veces mayor de desarrollar EAC. Además, en el grupo de pacientes que desarrollan un síndrome coronario agudo (SCA) más del 17% son portadores de DM, y tienen cifras de mortalidad temprana y tardía significativamente mayores en comparación a los no diabéticos
7.Se ha sugerido, en base a un estudio observacional8, que los pacientes con DM sin infarto del miocardio (IM) previo tienen un riesgo de nuevos eventos coronarios similar a los no diabéticos que han tenido un IM, por lo que los portadores de DM deberían ser tratados como si fuesen cardiópatas isquémicos conocidos.
Esta visión de la DM como un equivalente de EAC ha sido recientemente puesta en duda como resultado de un meta-análisis hecho con 45108 pacientes provenientes de 13 estudios diferentes, que mostró que los diabéticos sin IM previo tienen un 43% menos de riesgo (IC 95%: 0,53-0,60) de desarrollar eventos coronarios totales en comparación a los pacientes con IM previo sin DM9.
La morfología de la placa aterosclerótica aislada en las arterias coronarias del paciente diabético es similar a la del paciente sin diabetes; y, la prevalencia de placas vulnerables en las arterias responsables de un SCA es similar en ambos grupos de pacientes, pero los pacientes diabéticos tienen una mayor cantidad de placas vulnerables en otras arterias coronarias10,11 y más enfermedad en vasos de pequeño calibre, lo que hace una morfología global más compleja tal y como ha sido demostrado en estudios angioscópicos12.
Los pacientes diabéticos pueden presentar síntomas atípicos o, incluso, ser asintomáticos y mostrar sólo isquemia silente en registros electrocardiográficos continuos.
Esta situación, que se ha considerado como debida a la presencia de neuropatía diabética subyacente que deteriora la percepción nociceptiva, puede incrementar el riesgo de estos pacientes, los cuales tienden a consultar mas tardíamente al momento de un SCA y perder el beneficio de la ventana del tiempo de las terapias de reperfusión miocárdica
13.ESTIMACIÓN DEL RIESGO Y DETECCIÓN DE LA ENFERMEDAD CORONARIA
Las lesiones ateroscleróticas ocurren de manera ubicua, con una muy alta prevalencia, se desarrollan lentamente a lo largo de varias décadas y sólo cuando han alcanzado un grado avanzado es cuando presentan manifestaciones clínicas, lo cual implica que un sujeto dado puede tener una o varias lesiones en pleno desarrollo sin saberlo. Esta circunstancia particular hace que la detección de la aterosclerosis subclínica sea de capital importancia para iniciar un tratamiento precoz y detener su progresión. Sin embargo, a pesar que en la actualidad se dispone de métodos para detectar estos cambios precoces, no hay un acuerdo unánime sobre su uso y la mejor aproximación a la detección temprana de la aterosclerosis se fundamenta en el nivel de riesgo que una persona tenga para presentar la enfermedad, según sea determinado por los esquemas tradicionales de cálculo de riesgo14,15.
Por otro lado, en los casos con evidencia clínica de aterosclerosis, su presencia y extensión debe ser evaluada por el médico especialista, pero los métodos a emplear varían según los distintos escenarios clínicos:
1. En el paciente asintomático: Constituye un grupo muy heterogéneo por cuanto incluye aquellos con categorías diferentes de riesgo para EAC que, en base a las características individuales, podrían dividirse en bajo, intermedio y alto; y, según el nivel en que se encuentre cada paciente se seleccionarían las pruebas.
En este grupo debe estar en la detección de los factores clínicos y paraclínicos de riesgo para enfermedad coronaria, y en la búsqueda de aterosclerosis subclínica para lo cual los métodos más ampliamente utilizados son la medición del grosor de la íntima-media carotídea y del calcio coronario.
Podría también hacerse una valoración no invasiva del estado de la vasculatura mediante la prueba de hiperemia reactiva en la arteria braquial, la cual detecta la capacidad de vasodilatación arterial como indicador de disfunción endotelial; o, evaluarse la velocidad de onda de pulso y el índice de aumentación que son indicadores de la rigidez arterial que pudiera estar alterada por la DM y por otros factores de riesgo que frecuentemente coexisten.
En el subgrupo de riesgo alto, o cuando se hayan detectado anormalidades que pudieran sugerir la presencia de EAC, la exploración debe ser exhaustiva a fin de encontrar evidencias objetivas de la enfermedad (Figura 1).
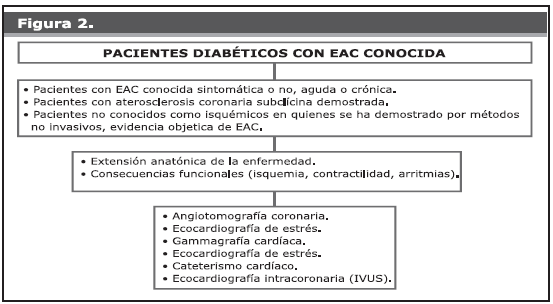
2. El paciente sintomático: En el paciente con síntomas o signos sugestivos de isquemia, o donde se ha demostrado isquemia miocárdica en los estudios paraclínicos, debe comprobarse objetivamente su presencia y significado, evaluando la extensión de la aterosclerosis coronaria y sus consecuencias funcionales (isquemia, contractilidad y arritmias) (Figura 2) para lo cual se emplean métodos no invasivos que pueden clasificarse en:
a. Funcionales: Muestran la presencia y severidad de la isquemia miocárdica; dentro de estas, la prueba de esfuerzo (PE) es la más frecuentemente realizada, aunque con diversas limitaciones basadas en las características del electrocardiograma de base, la habilidad del paciente para ejercitarse y la baja sensibilidad y especificidad de esta exploración; sin embargo, su facilidad de realización, reproducibilidad y bajo costo garantizan su uso como prueba diagnóstica inicial en la mayoría de los pacientes. La aparición de signos electrocardiográficos de isquemia en la PE debe ser corroborada mediante gammagrafía cardíaca o ecocardiografía de esfuerzo, las cuales, aparte de agregar especificidad al hallazgo, permiten inferir cuáles y cuántos son los lechos arteriales comprometidos. La gammagrafía cardíaca contribuye a detectar la presencia de áreas de necrosis o de isquemia, su relación con los diferentes lechos arteriales y cuantificar las alteraciones de la contractilidad miocárdica inducidas por la isquemia. Es altamente sensible y específica, pero su alto costo y las dificultades logísticas para su realización en nuestro país (disponibilidad de recursos materiales y humanos) limitan su uso.
La ecocardiografía dinámica
ambulatoria (Holter) se ha recomendado como evaluación inicial en algunos pacientes que no pueden ejercitarse, pero su sensibilidad es menor a la de la PE; sin embargo, la detección del número y duración del total de episodios de isquemia (silenciosa o no) determina la carga total, lo cual tiene implicaciones pronósticas.b. Imagenológicos: Evalúan la precencia y
extensión de las lesiones obstructivas en el lecho arterial coronario. La angiotomografía es la única prueba no invasiva, actualmente disponible, que permite la visualización directa de las arterias coronarias. Los equipos multicortes modernos lo hacen altamente sensible y específico; sin embargo, su alto costo, limitada disponibilidad y la preocupación inherente al alto nivel de radiación que recibe el paciente, especialmente si hay estudios repetidos, limitan su uso.La ecocardiografía transtorácica y transesofágica, ésta última empleada en casos especiales con mala ventana acústica, permiten observar las consecuencias funcionales de la isquemia miocárdica, toda vez que muestran alteraciones cuantificables en la contractilidad ventricular, regional o total. Son altamente sensibles y específicas, muy reproducibles y de relativo bajo costo.
c. Mixtos: La utilización progresiva de cargas crecientes de esfuerzo físico progresivo o de infusión de dobutamina puede inducir, en los pacientes con EAC obstructiva, alteraciones reversibles en la motilidad regional o total que evidencian la presencia de isquemia.
Estas pruebas también son altamente sensibles, específicas y seguras, muy reproducibles y de relativo bajo costo.
3. Pacientes con EAC. demostrada y considerada de alto riesgo, que sean susceptibles de terapia de revascularización, deben emplearse métodos diagnósticos invasivos que permitan la visualización directa de la obstrucción de la luz y/o de las características de la pared arterial coronaria. Existen actualmente dentro de esta categoría dos métodos ampliamente utilizados: la angiografía coronaria de contraste y el ultrasonido intravascular.
a. Angiografía coronaria: Considerada el estándar de oro para la evaluación de la anatomía coronaria. Muestra en dos dimensiones el calibre y características de los bordes de la luz de las arterias, pero no el estado de la pared. Inclusive, puede crear la falsa impresión de ausencia de una enfermedad coronaria significativa cuando existe remodelado vascular excéntrico significativo (fenómeno de Glagov). Es de alto costo y su realización conlleva un bajo nivel de morbimortalidad.
b. Ultrasonido intravascular: Permite evaluar en dos y tres dimensiones el estado de la pared arterial coronaria, determinando la presencia, extensión y características de las placas coronarias y el calibre de la luz arterial. El ultrasonido intravascular constituye el complemento ideal de la angiografía coronaria. Su uso está actualmente limitado por su alto costo y baja disponibilidad.
c. Tomografía óptica de coherencia y caracterización tisular con ecos dispersos. Ambas son técnicas que aplican procesamiento avanzado de los ecos producidos con ultrasonido intravascular. Constituyen la realización de una auténtica histología virtual, toda vez que permiten caracterizar, con una gran capacidad de resolución, el estado de la pared vascular, el grosor de la cápsula fibrosa, el contenido lipídico, la celularidad y la calcificación existentes en la placa
aterosclerótica. Actualmente ambas técnicas son experimentales pero quizás lleguen a ser clínicamente exitosas en un futuro16,17.ENFERMEDAD ARTERIAL PERIFÉRICA
El espectro de las enfermedades vasculares incluye la enfermedad arterial obstructiva periférica en miembros superiores e inferiores (EAP), la estenosis carotídea y la enfermedad aneurismática de la aorta y de las arterias periféricas.
La EAP es una de las manifestaciones de la ateroesclerosis, que afecta a diferentes lechos vasculares. Es un marcador de riesgo aterotrombótico en otros territorios, especialmente el coronario y el cerebral. Es conocido que la prevalencia de la EAP aumenta con la edad y llega al 20% en los mayores de 65 años
18.Se estima que el número de portadores de EAP en Europa y en América del Norte puede estar subestimado, ya que la mayoría de los pacientes son asintomáticos o no presentan el síntoma clásico de la enfermedad, la claudicación intermitente
19.Los pacientes con EAP tienen un riesgo 3,1 veces superior de fallecer por cualquier causa, y de 6,6 veces mayor a consecuencia de la EAC que los pacientes sin EAP
20.En el caso de los hombres, se ha observado en estudios de seguimiento que la mortalidad a los 10 años es del 61,8% en comparación al 16,9% en sus pares sin EAP
20. El correspondiente porcentaje de mortalidad para las mujeres es de 33,3% y 11,6% respectivamente. El riesgo de ictus está incrementado en un 40%. En el estudio ARIC los hombres con EAP de miembros inferiores tenían de 4 a 5 veces más posibilidad de sufrir un ictus21.Los factores de riesgo para EAP son similares a los de la enfermedad ateroesclerótica, sin embargo el tabaquismo y la DM son los de mayor importancia. La DM incrementa el riesgo de EAP entre 2 y 4 veces, y está presente entre el 12 y el 20% de los pacientes con EAP
22. En el estudio de Framingham, la DM incrementó el riesgo de claudicación intermitente entre 3,5 y 8,6 veces en hombres y mujeres, respectivamente; siendo dicho riesgo proporcional a la severidad y duración de la DM23; además, los pacientes diabéticos con EAP tienen de 7 a 15 veces más riesgo de amputación que los no diabéticos con EAP24, de allí la importancia en detectarla tempranamente en todo paciente, sea sintomático o no.El síntoma cardinal de la EAP es la claudiccación intermitente, entendiéndose por tal una sensación de peso, debilidad, ardor, dolor o calambre en un músculo o grupo de músculos de las extremidades inferiores asociado a una carga de trabajo. Este síntoma tiende a ocurrir de manera estereotipada con similares cargas de trabajo y se alivia dentro de 5-10 minutos de reposo.
La claudicación intermitente se asocia a disminución del pulso arterial en la arteria índice que riega el grupo muscular comprometido lo que permite hacer el diagnóstico diferencial con miopatías o neuropatías que podrían emular estas manifestaciones clínicas. Los pacientes con severos déficits de perfusión pueden experimentar dolor nocturno en reposo que mejora con la colocación del miembro inferior hacia abajo o, paradójicamente, con el caminar.
El examen físico muestra disminución regional de pulsos periféricos y disminución de la temperatura cutánea; la coloración de la piel puede también alterarse: rojiza o violácea por isquemia persistente y vasodilatación, o pálida cuando la isquemia es muy severa. Puede haber trastornos tróficos de adelgazamiento cutáneo, caída del vello y engrosamiento de las uñas
25.DETECCIÓN DE LA EAP
a. Índice tobillo/brazo (ITB): Es una prueba sencilla, fácil de realizar y de bajo costo. El ITB correlaciona la presión sistólica medida en el tobillo con la medida en el brazo, a partir del cociente obtenido de dividir la mayor presión sistólica de la arteria tibial posterior o pedia, entre la mayor presión sistólica obtenida de ambas arterias humerales. Valores de ITB menores a 1, reflejan grados diversos de obstrucción arterial en miembros inferiores, mientras que los superiores a 1 indican no compresibilidad por enfermedad aterosclerótica extensa, no obstructiva, de las arterias de las extremidades inferiores. (Tabla No. 1)
Comparado con la angiografía, un ITB en reposo de 0,9 tiene una sensibilidad para detectar EAP del 95%, con una especificidad del 100% en sujetos con lesiones estenóticas de más de 50%
26. Las guías conjuntas de la Asociación Americana del Corazón y el Colegio Americano de Cardiología recomiendan la realización del ITB (clase I, nivel de evidencia C) en todo paciente con sospecha de EAP, en mayores de 70 años, o mayores de 50 años si son fumadores o diabéticos27. En estos últimos, la Asociación Americana de Diabetes recomienda la realización del ITB en todo diabético mayor de 35 años, o en aquellos pacientes que tengan más de 20 años de ser diabéticos28.b. Presiones segmentarias:
Consiste en el registro de la presión arterial a diferentes niveles de la extremidad. Se fundamenta en los mismos principios del ITB30. Permite valorar por sectores la gravedad de la enfermedad arterial. Ayuda a conocer la necesidad de realizar estudios morfológicos de diagnóstico (eco-doppler arterial, arteriografía, angiorresonancia y angiotomografía). Sus limitaciones pueden ser técnicas o provocadas por la propia enfermedad. La obesidad mórbida, la delgadez extrema, así como la anchura inadecuada del manguito utilizado pueden condicionar errores en la medición.c. Prueba de esfuerzo (PE): Es útil para establecer el diagnóstico del proceso oclusivo cuando la lesión es moderada y el ITB en reposo es normal. En condiciones normales, la respuesta fisiológica al ejercicio es taquicardia y aumento de la presión de perfusión; sin embargo, en presencia de estenosis/oclusión fija al flujo arterial se produce una caída de la presión distal como consecuencia de la disminución de la resistencia periférica con la finalidad de mantener el flujo31. Su limitación se basa en contraindicaciones que impidan completar el test (estenosis aórtica severa,
angina inestable, hipertensión arterial no controlada).d. Ultrasonido Doppler: Esta técnica permite estimar inicialmente la localización, la severidad y la progresión de la EAP; además de cuantificar los efectos de la revascularización32. La sensibilidad y la especificidad para detectar lesiones mayores al 50% es de 90 y 95% respectivamente. Su uso está catalogado como clase I nivel evidencia A27.
e. Angiotomografía computarizada: Permite el diagnóstico anatómico y de la severidad de las lesiones. Requiere del uso de contraste endovenoso. Tiene una sensibilidad y especificidad de 94% y 100%, respectivamente. Su uso en el diagnóstico de la EAP está recomendado con indicación clase I, nivel de evidencia B, y como sustituto de la resonancia magnética nuclear en aquellos pacientes con contraindicaciones27 con el mismo grado de evidencia. La tomografía tiene una ventaja respecto a la angiografía por contraste porque permite la posibilidad de ver imágenes en 3 dimensiones.
f. Angiorresonancia: Es comparable a la angiografía, con una sensibilidad y especificidad de 90% y 100%, respectivamente. No requiere del uso de contraste y no conlleva el riesgo de sometimiento a radiaciones.
g. Angiografía por contraste (arteriografía):
Permite la visualización de las arterias en dos dimensiones. Requiere el uso de contraste intravascular con las consecuencias y limitaciones inherentes a su uso (alergia, empeoramiento de función renal). Debe ser utilizada para realizar el diagnóstico y caracterizar la extensión de la EAP en aquellos pacientes en quienes se considere una alta posibilidad de intervención mecánica terapéutica (Recomendación clase I, nivel de evidencia B)27.Existen otros métodos de evaluación vascular menos utilizados como la pletismografía de volumen de pulso, el cual es útil en los pacientes con arterias rígidas, poco compresibles.
ENFERMEDAD VÁSCULO CEREBRAL (EVC)
El riesgo de EVC está marcadamente aumentado entre los individuos con diabetes, siendo el ictus un evento común de morbilidad y mortalidad. El riesgo de ictus y de ataques de isquemia transitoria (AIT) es significativamente mayor en los pacientes diabéticos33-36. Si bien, la diabetes se asocia íntimamente con la hipertensión y la dislipidemia, también es un factor de riesgo independiente para ictus, duplicando el riesgo de presentarlo en comparación con los no diabéticos. La combinación de diabetes e hipertensión arterial aumenta el riesgo de ictus seis veces más que en los pacientes no diabéticos y dos veces más que en los diabéticos normotensos37.
La EVC es la causa de morbilidad más común, a largo plazo, en pacientes con diabetes tanto tipo 1 como tipo 2. Desde las observaciones iniciales del estudio de Framingham, varios otros ensayos poblacionales, con gran número de pacientes, han confirmado la estrecha relación entre el ictus y la DM38, tal y como se resume a continuación:
La diabetes fue el factor de riesgo más importante para ictus (riesgo relativo para hombres 3,4 y para mujeres 4,9) en un estudio prospectivo de Finlandia con un seguimiento de 15 años39.
Entre los subtipos de ictus, la diabetes fue un factor de riesgo prominente para el tipo isquémico.
En el Estudio Baltimore-Washington Cooperative Young Stroke, el riesgo de ictus se incrementó más de diez veces en los pacientes diabéticos menores de 44 años, y hasta 23 veces en los hombres jóvenes de raza blanca40.
La diabetes incrementa la mortalidad relacionada con los ictus, dobla la incidencia de ictus recurrente, y triplica la frecuencia de demencia relacionada con ictus41.
La diabetes puede causar microateromas en vasos pequeños, tales como las arterias lenticuloestriadas, lo cual lleva a ictus de tipo lacunar42. Este tipo de ictus es muy particular y requiere de hallazgos clínicos e imagenológicos específicos para el diagnóstico.
Los pacientes con ictus y diabetes y los pacientes con hiperglucemia en el período agudo del ictus tienen la mayor mortalidad, los resultados neurológicos peores, y más incapacidades de tipo severo que aquellos sin estas características43.
Hay menos información disponible en relación al riesgo de ictus en la DM1. El estudio de la enfermedad vascular en diabetes de la Organización Mundial de la Salud, reportó un aumento de la mortalidad vásculo cerebral en los pacientes con DM1, aunque con variaciones considerables en diferentes países43. Los datos del estudio nacional finlandés, con más de 5000 pacientes con DM1, desde su infancia, mostraron que a los 50 años de edad el riesgo de ictus agudo era igual al de un evento coronario agudo, sin ninguna diferencia de género44. La presencia de nefropatía diabética fue el predictor más importante de ictus, aumentando el riesgo en más de diez veces44. Después de la corrección de otros factores de riesgo para ictus, que también son comunes en los diabéticos, el riesgo aún se mantiene incrementado más de dos veces, enfatizando que la diabetes, per se, es un factor de riesgo independiente para ictus45.
CLÍNICA Y VALORACIÓN DE LA EVC:
Una completa discusión sobre las características clínicas y formas de presentación de la EVC está fuera de los límites de esta revisión; sin embargo debe mencionarse que la EVC que complica a la DM se manifiesta como ataques de isquemia transitoria (AIT) o como ictus completado, siendo más frecuente la etiología isquémica por aterosclerosis de las arterias cerebrales; aunque también aparece EVC isquémica por lipohialinosis y EVC hemorrágica en los pacientes diabéticos hipertensos. Los eventos embólicos aparecen en los pacientes diabéticos complicados con enfermedad aterosclerótica carotídea, del arco aórtico, con crecimiento ventricular izquierdo o con fibrilación auricular.
Las manifestaciones clínicas suelen ser típicamente súbitas, aunque variables, dependiendo del territorio comprometido; y pueden ser transitorias, caso de los AIT que sugieren enfermedad aterosclerótica en un territorio vascular determinado, o permanentes, con grados variables de déficit en el caso de los ictus completados. En general, el examen físico cuidadoso con especial atención a la valoración clínica y electrocardiográfica cardíaca, es esencial. No olvidando, por supuesto, descartar la posibilidad de hipoglucemia, que complique a un paciente diabético tratado, ya que podría simular las manifestaciones de la EVC.
La evaluación paraclínica es fundamentalmente imagenológica, siendo la tomografía computarizada y la resonancia magnética las técnicas usuales para la localización y cuantificación de las lesiones, la determinación de su etiología, la evaluación de los vasos comprometidos y del territorio que irrigan, y la exclusión de otras lesiones como los tumores y abscesos cerebrales. La ecocardiografía, transtorácica y transesofágica, permite la detección de fuentes embolígenas en los vasos extracerebrales: carótidas y arco aórtico; y en las cavidades cardíacas: orejuela y ventrículo izquierdo.
Adicionalmente, el uso de ecografía Doppler transcraneal permite la detección de estenosis de arterias intracraneales y provee información sobre los efectos intracraneales de lesiones oclusivas extracraneales46.
PREVENCIÓN Y TRATAMIENTO DE LAS COMPLICACIONES MACROVASCULARES DE LA DM
Enfermedad arterial coronaria: El control de la EAC en un paciente con DM se fundamenta en los mismos principios que guian el tratamiento del paciente no diabético: preservar y optimizar la función miocárdica, prevenir el desarrollo de complicaciones, estabilizar las placas vulnerables, evitar la recurrencia de eventos y limitar la progresión, o inducir regresión de las lesiones ateroscleróticas. Es necesario considerar 2 escenarios terapéuticos fundamentales en la EAC: el SCA y la prevención secundaria.
Síndrome coronario agudo: Los pacientes con SCA y DM tienen un mayor riesgo de complicaciones: su mortalidad absoluta es alta, 7-18% a los 30 días y 15-34% después del año; y el riesgo relativo de mortalidad, situado entre 1,3 a 5,4, es algo mayor para las mujeres que para los hombres; además, los pacientes con DM tienen más alta morbimortalidad después de los procedimientos de revascularización, quirúrgicos o percutáneos, que los no diabéticos47.
Los estudios de registro han mostrado que los diabéticos no están tan bien tratados como sus contrapartes no diabéticos, quizás por la más alta exigencia de metas terapéuticas para los primeros, el oscurecimiento de los síntomas por la neuropatía diabética y la percepción de contraindicación que la presencia de DM implica en el uso de algunos fármacos47; sin embargo, los métodos terapéuticos farmacológicos y de intervención mecánica son, como mínimo, tan efectivos en los pacientes con y sin DM. Una descripción extensa de las diferentes aproximaciones terapéuticas en el paciente con EAC48,49 está fuera del contexto de este artículo pero algunas particularidades merecen ser mencionadas:
El uso de trombolíticos y la realización de intervenciones mecánicas son igual de eficientes en pacientes con y sin DM pero como en los primeros hay un riesgo absoluto mayor, los beneficios relativos son sustancialmente mejores.
El uso de betabloqueantes no debe ser restringido en pacientes con DM y SCA, en ausencia de contraindicaciones firmes, ya que estas drogas reducen la morbimortalidad (Recomendación Clase IIa, Nivel B).
Los inhibidores del sistema renina angiotensina (SRA) son especialmente protectores en pacientes con DM y deben ser parte integral del tratamiento, especialmente en los hipertensos o con disfunción renal.
La revascularización en pacientes con DM ha favorecido tradicionalmente a la cirugía sobre las intervenciones terapéuticas (Recomendación Clase IIa, nivel A); sin embargo, esto aún se encuentra en discusión ya que hay resultados conflictivos entre diversos estudios clínicos47. En pacientes diabéticos con IM agudo, el modo preferido de revascularizacion es la intervención percutánea intracoronaria (Recomendación Clase I, Nivel A).
Los inhibidores de glicoproteínas IIb/IIIa están indicados en la revascularización percutánea electiva en pacientes con DM (Recomendación Clase I, Nivel B).
En base a un meta-análisis que reveló un 80% de reducción de riesgo relativo de reestenosis durante el primer año de seguimiento, se prefiere la utilización de stents medicados a los de metal en los pacientes con DM (Recomendación Clase IIa, Nivel B).
Prevención secundaria de la EAC: Las recomendaciones de modificación del estilo de vida y de control farmacológico en la prevención secundaria son las mismas para los pacientes con y sin DM; sin embargo, debido al mayor riesgo absoluto de los primeros, las metas de tratamiento son más ambiciosas y el número de pacientes necesario de tratar para obtener el beneficio con una intervención dada, es menor; además, en los pacientes diabéticos la actividad física juega un papel más significativo para garantizar un mejor control de las metas y una mejor calidad de vida.
a. Cambios de estilo de vida:
Incluyen la cesación completa del tabaquismo, el alcance y mantenimiento de un índice de masa corporal menor a 25 Kg/m2, y en casos de sobrepeso reducción de, al menos, el 10% del peso corporal. Los hábitos alimentarios deben ser modificados, aparte de los ajustes propios de la DM, para proporcionar un ingreso de sal menor a 6 g/día; un ingreso de fibra mayor a 30 g/día; una ingesta de grasa igual o menor a 30-35% del porcentaje de calorías diarias requeridas, de las cuales menos del 10% deben ser saturadas, menos del 2% grasas trans, 4 a 8 gr/ día de ácidos grasos omega-3, 2 gr/día de ácido linoleico y 200 mg/día de ácidos grasos de cadena larga47.En relación a la actividad física, debe realizarse por 30-45 minutos/día; vale destacar algunos aspectos relevantes:
La actividad física regular durante el tiempo libre (no la que corresponde al trabajo diario), se asocia con la reducción de enfermedades cardiovasculares y de la mortalidad total entre los diabéticos.
Caminar tiene una asociación inversa con el riesgo cardiovascular y la mortalidad total50. En el estudio Aerobic Center Longitudinal, el grupo de entrenamiento bajo tuvo un riesgo relativo alto para mortalidad total comparado con el grupo entrenado51.
Otros tipos de actividad física, tales como la ocupacional, el caminar o ir en bicicleta, tienen también una reducción de la mortalidad cardiovascular entre los diabéticos52.
En las personas activas físicamente en su trabajo se ha descrito un 40% menos de mortalidad cardiovascular comparadas con aquellas de baja actividad física.
En resumen, los estudios de observación sugieren que la reducción del riesgo cardiovascular asociado a la actividad física puede ser comparable al obtenido con el tratamiento farmacológico en los pacientes con DM tipo 2. La Asociación Americana de Diabetes (ADA por sus siglas en inglés)53, el National Cholesterol Education Programme Expert Panel54, y la Federación Internacional de Diabetes55 (Región Europea) han recomendado la actividad física para la prevención primaria y secundaria de las complicaciones cardiovasculares entre los pacientes diabéticos54. La evaluación del nivel de actividad física no es difícil mediante cuestionarios simples o utilizando contadores de pasos u otros equipos más sofisticados. Lo más importante es que el ejercicio funciona y hay que hacerlo.
Intervenciones farmacológicas:
Se fundamenta en la aplicación simultánea de diferentes fármacos para alcanzar niveles meta de control en las diversas variables que inciden en la evolución clínica del paciente con DM y EAC:a. Disminución de los lípidos y drogas hipolipemiantes: El uso de estatinas (Recomendación Clase I, nivel A)47 constituye la terapia de primera línea en pacientes diabéticos con cualquiera de las complicaciones macrovasculares con el objetivo de alcanzar niveles meta de LDL-Colesterol por debajo de los 70-77 mg/dL (Recomendación clase I, Nivel de evidencia B). Por otro lado, la meta de HDL-colesterol debe ser mayor a 40 mg/dL en hombres y 46 mg/dL en mujeres. La meta de triglicéridos es menor a 150 mg/dL. Los fibratos están indicados solamente cuando existen niveles normales de LDL-C, HDL-C bajo e hipertrigliceridemia (Recomendación clase II a, Nivel de evidencia C)56.
b. Control de la presión arterial y uso de antihipertensivos: Todo paciente diabético e hipertenso debe recibir terapia antihipertensiva con la finalidad de lograr valores por debajo de 130/80 mmHg (Recomendación Clase I, Nivel B)47 ya que el riesgo cardiovasciular en pacientes con DM e HTA sistólica (HTAS) está significativamente aumentado pero puede ser efectivamente reducido con el tratamiento antihipertensivo; usualmente este control requiere una combinación de diferentes agentes, de los cuales un inhibidor del SRA debe ser parte fundamental (Recomendación Clase I, Nivel A)47. En el caso de los pacientes con DM y disfunción renal o proteinuria mayor a 1 g/24 horas, la meta debería ser menor a 125/75 mmHg; sin embargo, estos niveles han sido criticados recientemente en pacientes con EAC además de DM, HTAS y disfunción renal por cuanto reducciones muy marcadas de la presión arterial podrían comprometer el flujo coronario e incrementar el riesgo de eventos cardiovasculares, toda vez que la HTAS muestra un comportamiento de curva en J.
c. Control de la hiperglucemia: Indicado con la finalidad de lograr una HbA1c menor a 6,5 % y un nivel de glucemia en ayunas menor a 100 mg/dL.
d. Reducción de la agregabilidad plaquetaria: Todoslospacientes con EAC, con o sin DM, deben recibir permanentemente tratamiento antiagregante plaquetario. La aspirina es la droga de elección (Recomendación Clase IIa, Nivel B) pero el clopidogrel puede considerarse en adición a la primera (Recomendación Clase IIa, Nivel C)47.
Enfermedad arterial periférica:
En general los principios fundamentales, las metas, y las drogas a emplear para el control y prevención de la EAP, son los mismos que para la EAC; sin embargo, deben destacarse los siguientes aspectos: La cesación tabáquica completa es fundamental ya que el tabaquismo representa, junto con la DM, el más importante factor de riesgo para EAP.
El tratamiento con betabloqueantes no está contraindicado en pacientes con EAP.
La terapia antiagregante plaquetaria está indicada para reducir el riesgo de IAM, ictus y muerte vascular en individuos con EAP57. La aspirina es segura y efectiva para lograr este objetivo. El clopidogrel es una alternativa segura y efectiva para aquellos pacientes con contraindicación a la aspirina e, incluso, tiene beneficios adicionales comparado a la aspirina53. La terapia antiagregante dual está justificada en los pacientes con EAP, especialmente si han sido revascularizados por vía endovascular. La terapia con anticoagulantes orales no es recomendada en los pacientes con EAP a menos que tenga una indicación adicional como la fibrilación auricular crónica, la presencia de trombos intracavitarios o de trombosis venosa profunda.
La terapia de rehabilitación con ejercicio y/o el uso de cilostazol en dosis de 100 mg bid podrían beneficiar a los pacientes con claudicción intermitente.
Enfermedad vascular cerebral (EVC):
Al igual que con la EAP, las medidas de prevención y tratamiento en la EVC son similares a las de la EAC; sin embargo, el sistema nervioso central posee características estructurales y funcionales únicas que obligan a consideraciones especiales en tres escenarios clínicos:a) la prevención del ictus, b) el tratamiento de los AIT y c) el tratamiento del ictus.
a. Prevención del ictus:
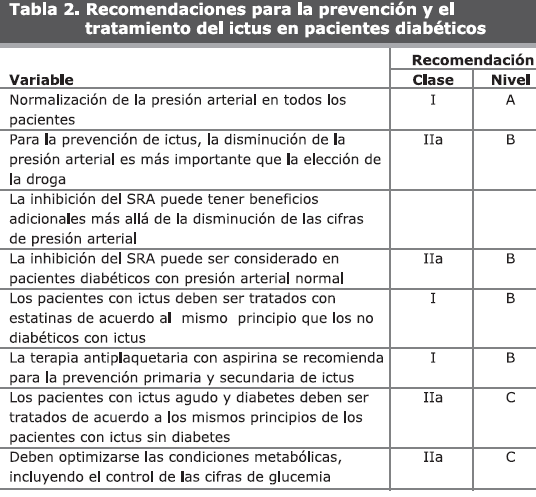
Aunque el control glucémico estricto es inequívocamente útil para la profilaxis de las complicaciones microvasculares (nefropatía, neuropatía, retinopatía)58, el beneficio para la reducción de ictus es menos cierto. La mayoría de las medidas preventivas de la EVC son similares en diabéticos y no diabéticos, aunque con ciertas características distintivas: En el caso de ictus en diabéticos deben incluir una estrategia múltiple (tabla 2) con el objetivo de tratar la HTA (preferentemente con inhibidores del SRA en combinación con cualquier otro antihipertensivo, si es necesario), la dislipidemia, la microalbuminuria, la hiperglucemia y el uso de agentes antiplaquetarios.
Los datos actuales sugieren que la disminución de presión arterial a un nivel óptimo puede ser más importante que un agente particular y no debe olvidarse que su control es un punto crucial para la reducción del riesgo futuro de ictus en estos pacientes.
Las estatinas han mostrado ser capaces de reducir la incidencia de ictus fatal y no fatal en pacientes de alto riesgo, pero las subpoblaciones de diabéticos en los ensayos han sido pequeñas y no permiten un análisis adecuado59-61.
La terapia antiplaquetaria ha demostrado una reducción de la incidencia de ictus en pacientes diabéticos y está indicada en la prevención primaria y secundaria del ictus62. La aspirina a baja dosis (75-325 mg diariamente) es la droga de elección inicial. En los pacientes con ictus recurrente, puede considerarse la asociación de aspirina y dipiridamol63. La combinación alternativa de aspirina y clopidogrel parece ser menos segura, ya que se asocia con un riesgo aumentado de sangrado sin ningún beneficio en términos de resultados cardiovasculares, según el estudio MATCH, realizado en 7599 pacientes de los cuales 68% eran diabéticos64. En los pacientes con fibrilación auricular, la terapia anticoagulante debe ser administrada para la prevención de ictus. Tradicionalmente esta ha sido cumplida con el uso de warfarina, de comprobada efectividad aún cuando las dificultades técnicas a su uso limitan su efectividad65. Nuevas moléculas (dabigatrán y rivaroxabán) han demostrado efectividad igual o mayor a la warfarina, mayor facilidad de uso y mejor perfil riesgo-beneficio66,67.
b. Ataques de isquemia transitoria (AIT).
La alta frecuencia de ictus posterior a un AIT obliga a instaurar el tratamiento en los primeros días después del evento: aproximadamente de 10% dentro de la primera semana y 18% dentro de los primeros 3 meses; por esto, la revascularización, si está indicada, ha de realizarse dentro de las primeras semanas después de un AIT. La evaluación inicial con ecocardiograma y con Doppler carotídeo está indicada.
Después de un AIT o ictus causado por enfermedad de las arterias carótidas, el tratamiento médico puede optimizarse en los pacientes de alto riesgo, evitando la necesidad de cirugía carotídea de emergencia, de manera que se permita a los pacientes llegar a una cirugía electiva más segura68.
La endarterectomía carotidea para la prevención de ictus en pacientes con alto grado de estenosis ha demostrado ser efectiva, aunque no se ha investigado específicamente en pacientes diabéticos.
Las complicaciones durante y después del procedimiento son más frecuentes en los diabéticos comparándolos con los no diabéticos. Una consideración especial merece el riesgo total de morbilidad y mortalidad peri y postoperatoria cuando se deciden las intervenciones quirúrgicas en el paciente con diabetes69; sin embargo, la presencia de diabetes, no parece incrementar el riesgo perioperatorio de ictus70,71.
Una alternativa a la endarterectomía, es la angioplastia con colocación de prótesis endovascular (stent), que ha demostrado, al menos, ser no inferior a la endarterectomía y puede ser un método preferido en los pacientes de alto riesgo72 pero los efectos de la diabetes sobre estos métodos no quirúrgicos no se han estudiado adecuadamente.
c. Tratamiento del ictus agudo: Debe seguir los mismos principios del tratamiento por ictus de la población general (tabla 2). La trombolisis es un tratamiento efectivo para el ictus isquémico, si se inicia en las tres primeras horas de los síntomas ya que reduce la mortalidad y la incapacidad por ictus, pero se asocia a un riesgo aumentado de hemorragia. Su utilización y efectos en los diabéticos requiere de más evaluación en los estudios clínicos.
El tratamiento conservador del ictus comprende la vigilancia estrecha de los signos vitales, optimización de las condiciones de circulación y metabólicas, incluyendo el control glucémico, en una unidad de ictus.
Los pacientes deberían recibir rehabilitación neurológica temprana con terapia física y ocupacional para mejorar la calidad de vida. Estudios recientes sugieren que la intervención precoz por HTA durante la fase aguda de un ictus puede ser benéfico, pero se recomienda en agudos solo la reducción de cifras muy altas de presión arterial (>220 mmHg de presión sistólica y/o 120 mmHg de diastólica), y no bajar la presión arterial hasta niveles que pudieran empeorar la isquemia. La presión arterial también debe bajarse por no más del 25% durante el primer día de tratamiento73.
CONCLUSIONES
El riesgo de las complicaciones macrovasculares en el paciente diabético es permanente; más aún si se tiene en cuenta que transcurren varios años desde el inicio de la enfermedad hasta su descubrimiento y que la frecuente falla en un control metabólico estricto y la corrección de las comorbilidades constituyen el común denominador de estos casos. Las razones subyacentes a la aparición de las complicaciones macrovasculares radican en la aceleración del proceso aterosclerótico. La aparición de las complicaciones macrovasculares conlleva a un claro aumento de la morbimortalidad en estos pacientes pero existe la clara ventaja de que una efectiva, oportuna y sostenida acción terapéutica pueda detener la progresión y/o agravamiento de las complicaciones.
REFERENCIAS BIBLIOGRÁFICAS
1. National Diabetes Information Clearinghouse (a service of the National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health). Diabetes across the United States. Available at http://www.diabetes.niddk.nih.gov/populations/index.htm. [ Links ]
2. Franco OH, Steyerberg EW, Hu FB, Mackenbach J, Nusselder W. Associations of diabetes mellitus with total life expectancy and life expectancy with and without cardiovascular disease. Arch Intern Med 2007;167:1145–1151. [ Links ]
3. Fox CS, Sullivan L, DAgostino RB Sr, Wilson PW; for the Framingham Heart Study. The significant effect of diabetes duration on coronary heart disease mortality: the Framingham Heart Study. Diabetes Care 2004;27:704–708. [ Links ]
4. Fang J, Alderman MH. Impact of the increasing burden of diabetes on acute myocardial infarction in New York City: 1990–2000. Diabetes 2006;55:768 –773. [ Links ]
5. Beckman JA, Creager MA, Libby P. Diabetes and atherosclerosis: epidemiology, pathophysiology, and management. JAMA 2002; 287: 2570-2581. [ Links ]
6. Kirpichnikov D, Sowers JR. Diabetes mellitus and diabetes-associated vascular disease. Trends Endocrinol Metab 2001;12:225-230. [ Links ]
7. Donahoe SM, Stewart GC, McCabe CH, Monahavelu S, Murphy SA, Cannon CP, Antman EM. Diabetes and mortality following acute coronary syndromes. JAMA 2007;298:765-775. [ Links ]
8. Haffner SM, Lehto S, Ronnemaa T, Pyorala K, Laakso M. Mortality from coronary heart disease in subjects with Type 2 diabetes and in non-diabetic subjects with and without prior myocardial infarction. N Engl J Med 1998;339:229–234. [ Links ]
9. Bulugahapitiya U, Siyambalapitiya S, Sithole J and Idris I. Is diabetes a coronary risk equivalent? Systematic review and meta-analysis. Diabet. Med 2009;26:142–148. [ Links ]
10. Raffel OC, Bouma BE, Tearney GJ, Jang I-K. Comparison of coronary plaque characteristics between diabetic and non-diabetic subjects: An in-vivo optical coherence tomography study. Circulation 2006;114: II-730-II¬-731. [ Links ]
11. Fujii K, Masutani M, Okumura T, Kawasaki D, Akagami T, Sakoda T, et al. Multiple complex coronary atherosclerosis in diabetic patients with acute myocardial infarction: A three-vessel optical coherence tomography study. Circulation 2007;116: II-749. [ Links ]
12. Silva JA, Escobar A, Collins TJ, et al. Unstable angina: a comparison of angioscopic findings between diabetic and non diabetic patients. Circulation 1995;92:1731- 1736. [ Links ]
13. Trichon BH, Roe MT. Diabetes mellitus and ischemic heart disease. En, Diabetes and cardiovascular disease. Steven P Marson and David M stern. Edts. Lippincott Williams and Wilkins. Philadelphia, 2004. [ Links ]
14. Greenland P, Alpert JS, Beller GA, et al. 2010 ACCF/AHA Guideline for Assessment of Cardiovascular Risk in Asymptomatic Adults: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2010; 56: e50 - e103. [ Links ]
15. Naghavi M, Falk E, Hecht HS, et al. From vulnerable plaque to vulnerable patient- -Part III: Executive summary of the Screening for Heart Attack Prevention and Education (SHAPE) Task Force report. Am J Cardiol 2006;98 (2A):2H-15H. [ Links ]
16. Kawasaki M, Sano K, Okubo M, Yokoyama H, Ito Y, Murata I, et al. Volumetric quantitative analysis of tissue characteristics of coronary plaques after statin therapy using three-dimensional integrated backscatter intravascular ultrasound. J Am Coll Cardiol 2005; 45: 1946-1953. [ Links ]
17. Prati F, Regar E, Mintz GS, Arbustini E, Di Mario C, Jang I-K, et al. Expert review document on methodology, terminology, and clinical applications of optical coherence tomography: physical principles, methodology of image acquisition, and clinical application for assessment of coronary arteries and atherosclerosis. Eur Heart J 2010;31:401-415. [ Links ]
18. Diehm C, Schuster A, Allenberg JR, Darius H, Haberl R, Lange S, et al. High prevalence of peripheral arterial disease and co-morbility in 6880 primary care patients: cross-sectional study. Atherosclerosis 2004; 172: 95-105. [ Links ]
19. Belch JJ, Topol EJ, Agnelli G, Bertrand M, Califf RM, Clement DL, et al. Critical issues in peripheral arterial disease detection and management: a call to action. Arch Intern Med. 2003; 163: 884-92. [ Links ]
20. Criqui MH, Langer RD, Fronek A, Feilgelson HS, Klauber MR, Mc Cann TJ, et al. Mortality over a period of 10 years in patients with peripheral arterial disease. N Engl J Med 1999; 326: 381-86. [ Links ]
21. Zheng ZJ, Sharrett AR, Chambless LE, et al. Associations of ankle-brachial index with clinical coronary heart disease, stroke and preclinical carotid and popliteal atherosclerosis: the Atherosclerosis Risk in Communities (ARIC) Study. Atherosclerosis 1997; 131:115-25. [ Links ]
22. Beks PJ, Mackaay AJ, de Neeling JN, et al. Peripheral arterial disease in relation to glycaemic level in an elderly Caucasian population: the Hoorn study. Diabetologia 1995;38: 86-96. [ Links ]
23. Katsilambros NL, Tsapogas PC, Arvanitis MP, et al. Risk factors for lower extremity arterial disease in non–insulin-dependent diabetic persons. Diabet Med 1996; 13: 243-6. [ Links ]
24. Most RS, Sinnock P. The epidemiology of lower extremity amputations in diabetic individuals. Diabetes Care 1983; 6: 87-91. [ Links ]
25. Wennberg PW y Rooke TW. Diagnosis and management of diseases of the peripheral arteries and veins. En, Hurst ́s The Heart. 10th Edition. Fuster V, Wayne Alexander R, O ́Rourke RA Edts. Mc Graw-Hill. New York, 2001. [ Links ]
26. Fowkes FG. The measurement of atherosclerotic peripheral arterial disease in epidemiological surveys. Int J Epidemiol 1988;17: 248-54. [ Links ]
27. Hirsch AT, Haskal ZJ, Hertzer NR, et al. ACC/AHA 2005 Guidelines for the management of patients with peripheral artery disease (lower extremity, renal, mesenteric, and abdominal aortic): Executive Summary. J Am Coll Cardiol 2006; 47:1239-1312. [ Links ]
28. Orchard TJ, Strandness DE Jr. Assessment of peripheral vascular disease in diabetes: report and recommendations of an international workshop sponsored by the American Diabetes Association and the American Heart Association. Circulation 1993; 88:819-28. [ Links ]
29. Hiatt WR. Medical treatment of peripheral arterial disease and claudication. N Engl J Med 2001;344:1608-21. [ Links ]
30. Heintz SE, Bone GE, Slaymaker EE, Hayes AC, Barnes RW. Value of arterial pressure measurements in the proximal and distal part of the thigh in arterial occlusive disease. Surg Gynecol Obstet 1978; 146: 337-43. [ Links ]
31. Strandness DE Jr, Zierler RE. Exercise ankle pressure measurements in arterial disease. In Bernstein EF, ed. Vascular diagnosis. 4 ed. St Louis: Mosby; 1993. p. 547-53. [ Links ]
32. Gale SS, Scissons RP, Salles-Cunha SX, et al. Lower extremity arterial evaluation: are segmental arterial blood pressures worth while. J Vasc Surg 1998;27:831-8. [ Links ]
33. Barrett-Connor E, Khaw KT. Diabetes mellitus: an independent risk factor for stroke? Am J Epidem 1988;128:116–123. [ Links ]
34. Rodriguez BL, DAgostino R, Abbott RD, et al. Risk of hospitalized stroke in men enrolled in the Honolulu Heart Program and the Framingham Study: A comparison of incidence and risk factor effects. Stroke 2002;33:230–236. [ Links ]
35. Tuomilehto J, Rastenyte D, Jousilahti P, et al. Diabetes mellitus as a risk factor for death from stroke. Prospective study of the middle-aged Finnish population. Stroke 1996;27:210–215. [ Links ]
36. Wolf PA, DAgostino RB, Belanger AJ, et al. Probability of stroke: a risk profile from the Framingham Study. Stroke 1991; 22:312–318. [ Links ]
37. Kuller LH, Dorman JS, Wolf PA. Cerebrovascular disease and diabetes. Bethesda. MD: NIH publications. 85-1468,1985. [ Links ]
38. Lehto S, Ronnemaa T, Pyorala K, et al. Predictors of stroke in middle-aged patients with non-insulin-dependent diabetes. Stroke 1996; 27:63–68. [ Links ]
39. Adams Jr. HP, Putman SF, Kassell NF, et al. Prevalence of diabetes mellitus among patients with subarachnoid hemorrhage. Arch Neurol 1984; 41:1033–1035. [ Links ]
40. Rohr J, Kittner S, Feeser B, et al. Traditional risk factors and ischemic stroke in young adults: the Baltimore-Washington Cooperative Young Stroke Study. Arch Neurol 1996;53:603–607. [ Links ]
41. Hankey GJ, Jamrozik K, Broadhurst RJ, et al. Long-term risk of first recurrent stroke in the Perth Community Stroke Study. Stroke 1998;29:2491–2500. [ Links ]
42. Luchsinger JA, Tang MX, Stern Y y col. Diabetes mellitus and risk of Alzheimers disease and dementia with stroke in a multiethnic cohort. Am J Epidem 2001;154: 635–641. [ Links ]
43. Fuller JH, Stevens LK, Wang SL. International variations in cardiovascular mortality associated with diabetes mellitus: the WHO Multinational Study of Vascular Disease in Diabetes. Ann Med 1996;28:319–322. [ Links ]
44. Tuomilehto J, Borch-Johnsen K, Molarius A, et al. Incidence of cardiovascular disease in Type 1 (insulin-dependent) diabetic subjects with and without diabetic nephropathy in Finland. Diabetologia 1998; 41:784–790. [ Links ]
45. Brindle P, Emberson J, Lampe F, et al. Predictive accuracy of the Framingham coronary risk score in British men: prospective cohort study. BMJ 2003; 327: 1267. [ Links ]
46. Caplan LR. Cerebrovascular disease and neurologic manifestations of heart disease. En, Hurst ́s The Heart. 10th Edition. Fuster V, Wayne Alexander R, O ́Rourke RA Edts. Mc Graw-Hill. New York, 2001. [ Links ]
47. The Task Force on Diabetes and Cardiovascular Diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD). ESC Guidelines on Diabetes, pre-diabetes and cardiovascular diseases: executive Summary. Eur Heart J 2007;28:88-136. [ Links ]
48. 2007 Focus Update of the ACC/AHA 2004 Guidelines on the Management of Patients With ST-Elevation Myocardial Infarction. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2008;117:296-329. [ Links ]
49. ACC/AHA 2007 Guidelines for the Management of Patients with Unstable angina/Non ST-Elevation Myocardial Infarction: Executive Summary. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2007;116:803-877. [ Links ]
50. Tanasescu M, Leitzmann MF, Rimm EB, Hu FB. Physical activity in relation to cardiovascular disease and total mortality among men with type 2 diabetes. Circulation 2003;107:2435-2439. [ Links ]
51. Spijkerman AM, Yuyun MF, Griffin SJ, Dekker JM, et al. The performance of a risk score as a screening test for undiagnosed hyperglycaemia in ethnic minority groups: data from the 1999 health survey for England. Diabetes Care 2004; 27:116–122. [ Links ]
52. Hu G, Eriksson J, Barengo NC, Lakka TA, Valle TT, et al. Occupational, commuting, and leisure-time physical activity in relation to total and cardiovascular mortality among Finnish subjects with type 2 diabetes. Circulation 2004; 110: 666-673. [ Links ]
53. American Diabetes Association. Physical activity/exercise and diabetes mellitus. Diabetes Care 2003; 26 (Suppl. 1):S73–S77. [ Links ]
54. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Programme (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285: 2486–2497. [ Links ]
55. Working Party of the international Diabetes Federation (European Region). Hypertension in people with Type 2 diabetes: knowledge-based diabetes-specific guidelines. Diabet Med 2003; 20: 972–987. [ Links ]
56. ACC/AHA 2005 practice guidelines for the management of patients with peripheral arterial disease (lower extremity, renal, mesenteric, and abdominal aortic): a collaborative report from the American Association for Vascular Surgery/Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease). Circulation 2006;113:e463– e654. [ Links ]
57. Antithrombotic Trialists Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2001;324: 71. [ Links ]
58. American Diabetes Association. Standards of medical care in diabetes. Diabetes Care 2004; 27 (Suppl 1): S15-S35. [ Links ]
59. James Shepherd J, Barter P, Carmena R, y col. Effect of Lowering LDL Cholesterol Substantially Below Currently Recommended Levels in Patients With Coronary Heart Disease and Diabetes: The Treating to New Targets (TNT) study. Diabetes Care, 2006;29:1220-1226. [ Links ]
60. João Costa J, Borges M, David C, Carneiro AV. Efficacy of lipid lowering drug treatment for diabetic and non-diabetic patients: metanalysis of randomised controlled trials. BMJ 2006; 332: 1115. [ Links ]
61. Cholesterol Treatment Trialists (CTT) Collaborators. Efficacy of cholesterol- lowering therapy in 18 686 people with diabetes in 14 randomised trials of statins: a meta-analysis. Lancet 2008;371:117-125. [ Links ]
62. Colwell JA. Aspirin therapy in diabetes. Diabetes Care 1997;20:1767-1771. [ Links ]
63. Diener HC, Cunha L, Forbes C, et al. European Stroke Prevention Study. 2. Dipyridamole and acetylsalicylic acid in the secondary prevention of stroke. J Neuro Sci 1996;143:1–13. [ Links ]
64. Diener HC, Bogousslavsky J, Brass LM, et al. Aspirin and clopidogrel compared with clopidogrel alone after recent ischaemic stroke or transient ischaemic attack in high-risk patients (MATCH): randomised, double-blind, placebo controlled trial. Lancet 2004;364: 331–337. [ Links ]
65. The European Atrial Fibrillation Trial Study Group. Optimal Oral Anticoagulant Therapy in Patients with Nonrheumatic Atrial Fibrillation and Recent Cerebral Ischemia. N Engl J Med 1995;333:5-10. [ Links ]
66. Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361:1139-51. [ Links ]
67. ROCKET AF Study Investigators. Rivaroxaban-once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and Embolism Trial in Atrial Fibrillation: rationale and design of the ROCKET AF study. Am Heart J 2010;159:340-347.e1. [ Links ]
68. Goldstein LB, Adams R, Becker K, et al. Primary prevention of ischemic stroke: A statement for healthcare professionals from the Stroke Council of the American Heart Association. Stroke 2001; 32:280–299. [ Links ]
69. Tu JV, Wang H, Bowyer B, et al. Risk factors for death or stroke after carotid endarterectomy: observations from the Ontario Carotid Endarterectomy Registry. Stroke 2003;34:2568–2573. [ Links ]
70. Ballotta E, Da Giau G, Renon L. Is diabetes mellitus a risk factor for carotid endarterectomy? A prospective study. Surgery 2001;129:146–152. [ Links ]
71. Pistolese GR, Appolloni A, Ronchey S, et al. Carotid endarterectomy in diabetic patients. J Vasc Surg 2001;33:148–154. [ Links ]
72. Gurm HS, Yadav JS, Fayad P, et al. Long-term results of carotid stenting versus endarterectomy in high-risk patients. N Engl J Med 2008;358:1572–1579. [ Links ]
73. Hack W, Kaste M, Bogousslavsky J, et al. European stroke initiative recommendations for Stroke Management-update 2003. Cerebrovasc Dis (Basel, Switzerland) 2003;16:311–337. [ Links ]