Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.11 no.3 Mérida oct. 2013
Manejo de pacientes con Síndrome de Cushing.
Protocolo del Servicio de Endocrinología del Instituto Autónomo Hospital Universitario de Los Andes.
Marcos M. Lima-Martínez1,2, José Zerpa3, Yorly Guerrero3, Jenny Rivera3, Marly Vielma3, Grupo de Endocrinología Mérida (ENDO-MER)
1 Departamento de Ciencias Fisiológicas. Escuela de Ciencias de la Salud. Universidad de Oriente, Núcleo Bolívar. Ciudad Bolívar.
2 Unidad de Endocrinología, Diabetes, Metabolismo y Nutrición, Anexo A Centro Médico Orinoco. Ciudad Bolívar.
3 Unidad de Endocrinología. Instituto Autónomo Hospital Universitario de los Andes. Mérida.
Dirigir correspondencia a: Marcos M. Lima Martínez; Email: marcoslimamedical@hotmail.com
RESUMEN
El exceso crónico de glucocorticoides se acompaña de una amplia variedad de signos y síntomas conocidos como síndrome de Cushing. Esta condición, ocurre con mayor frecuencia por causas iatrogénicas cuando los glucocorticoides son usados como terapia antiinflamatoria por tiempo prolongado. El mecanismo patogénico del Cushing endógeno puede dividirse en dependiente o independiente de ACTH. A pesar de los avances en el diagnóstico y tratamiento de esta patología, el síndrome de Cushing continúa siendo un reto para el clínico. En este artículo, basado en niveles de evidencia científica y en la experiencia clínica de la Unidad de Endocrinología del IAHULA, se presenta el protocolo de manejo del Síndrome de Cushing, el cual incluye criterios diagnósticos, manejo clínico y tratamiento de esta condición.
Palabras Clave: Síndrome de Cushing, cortisol, ACTH, hipófisis.
ABSTRACT
Chronic glucocorticoid excess is accompanied by a wide range of signs and symptoms known as Cushings syndrome. This condition most commonly arises from iatrogenic causes when glucocorticoids have been used as anti-inflammatory treatment for a long time. The pathogenetic mechanism of endogenous Cushings syndrome can be divided into ACTH dependent and ACTH independent. Despite major advances in diagnosis and therapy, Cushings syndrome is frequently a challenge for the clinician. In this paper, based on levels of scientific evidence and clinical experience in the Unit of Endocrinology, IAHULA, we present the protocol for the management of Cushings syndrome, which includes: diagnostic criteria, clinical management and treatment of this condition.
Key Words: Cushings syndrome, cortisol, ACTH, pituitary
Articulo recibido en: Julio 2013. Aceptado para publicación en: Agosto 2013.
INTRODUCCIÓN
El Síndrome de Cushing (SC) consiste en un conjunto de signos y síntomas producidos por concentraciones elevadas de glucocorticoides en la circulación. El exceso de los mismos puede originarse en las glándulas suprarrenales (SC endógeno, por exceso de cortisol) o por la administración de glucocorticoides a dosis suprafisiológicas por tiempo prolongado (SC exógeno). A su vez, el SC endógeno puede ser independiente o dependiente de adrenocorticotropina (ACTH). El independiente de ACTH resulta de la secreción excesiva de cortisol por parte de tumores suprarrenales benignos (14%) o malignos (5%). El dependiente de ACTH es frecuentemente ocasionado por la secreción hipofisaria de ACTH (70%) y se denomina Enfermedad de Cushing (EC), mientras que el 10% es causado por tumores extra-hipofisarios (secreción ectópica de ACTH), siendo la causa más frecuente el carcinoma microcítico de pulmón, seguido por los tumores malignos de timo, carcinoides y tumores de los islotes pancreáticos. Se ha descrito en menos del 1% de los casos el SC secundario a secreción ectópica de hormona liberadora de corticotropina (CRH)1.
Estudios poblaciones demuestran que el SC tiene una incidencia de 2,3 millones de casos al año2; sin embargo, estudios realizados en grupos poblaciones de alto riesgo han demostrado hipercortisolismo endógeno en el 0,5 – 1% de pacientes con hipertensión arterial3,4, 6 – 9% de pacientes con incidentalomas adrenales5,6, 2 – 3% de diabéticos mal controlados7,8 y en 11% de sujetos con osteoporosis y fracturas vertebrales9,10. Por tanto, debido al incremento en la prevalencia de esta patología y por ser nuestro servicio de Endocrinología un importante centro de referencia en la región occidental del país, surgió la iniciativa de analizar consensos de sociedades científicas internacionales, ensayos clínicos, metanálisis, así como revisiones sistemáticas y generales, correspondientes a SC, con el fin de unificar criterios en cuanto al diagnóstico y tratamiento de esta condición clínica, manteniéndonos cónsonos con la realidad de nuestro centro asistencial y de nuestra población.
DESARROLLO DE RECOMENDACIONES BASADAS EN LA EVIDENCIA
Las recomendaciones diagnósticas y terapéuticas se formularon de acuerdo al sistema GRADE (del inglés, Grading of Recommendations, Assessment, Development, and Evaluation) para establecer la fuerza de las recomendaciones y el grado de evidencia11. La calidad de la evidencia se clasificó en muy baja calidad (MBC), baja calidad (BC), mediana calidad (MC) y alta calidad (AC) de acuerdo a los parámetros descritos en la tabla 1. Por su parte, en términos de fuerza de recomendación se distinguen recomendaciones fuertes, expresadas en el texto como se recomienda si derivan de evidencia de mediana o alta calidad, y recomendaciones débiles expresadas en el texto como se sugiere, si están basadas en evidencia de muy baja o baja calidad.
MANIFESTACIONES CLÍNICAS DEL SÍNDROME DE CUSHING
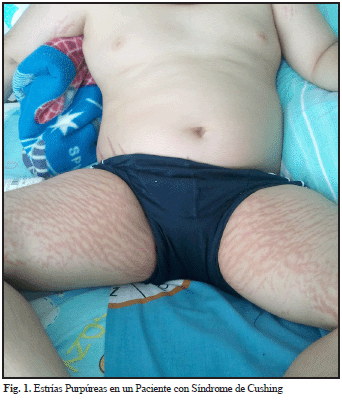
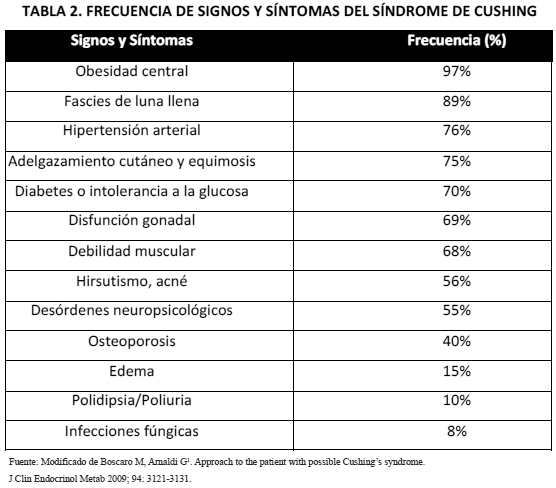
Las manifestaciones clínicas del SC son variables y difieren en severidad dependiendo del grado y la duración del hipercortisolismo. La obesidad central constituye la manifestación más común y a menudo es el signo inicial en los pacientes. Además, es frecuente encontrar fascies de luna llena, acúmulo de grasa en la región cervicodorsal y supraclavicular, estrías purpúreas (figura 1), adelgazamiento de la piel, debilidad en la musculatura proximal, fatiga, hipertensión arterial, acné, hirsutismo, intolerancia a la glucosa, disminución del deseo sexual e irregularidades menstruales. Otros hallazgos relativamente frecuentes incluyen: atrofia muscular, equimosis, osteoporosis e inclusive trastornos neuropsicológicos como depresión, irritabilidad y disfunción cognitiva12,13. La frecuencia con que se presentan estas alteraciones se resume en la tabla 2.
DIAGNÓSTICO DEL SÍNDROME DE CUSHING
Se recomienda realizar una historia clínica detallada a fin de conocer si existen antecedentes de consumo de glucocorticoides a dosis altas que pudieran causar SC exógeno12. Se sugiere realizar pruebas de despistaje para SC sólo a los siguientes grupos12:
Pacientes con características clínicas altamente predictivas de SC (tabla 2) (BC).
Pacientes con hallazgos inusuales para la edad (ejemplo, niños con osteoporosis e hipertensión arterial) (BC).
Niños con talla baja y aumento de peso (MBC). Pacientes con incidentaloma adrenal (MBC).
Pruebas de Despistaje
Para la evaluación inicial del SC se sugiere realizar una de las siguientes pruebas12:
Prueba de supresión con 1 mg de dexametasona a medianoche.
Cortisol libre en orina de 24 horas.
Prueba larga a dosis bajas de dexametasona (2 mg/día por 48 horas).
Cortisol en saliva a medianoche (no disponible actualmente en nuestro medio).
El propósito de estas pruebas es demostrar la presencia de hipercortisolismo y el desajuste en la retroalimentación fisiológica del eje hipotálamo - hipofisis - suprarrenal. En nuestro medio, la prueba inicial que se realiza con mayor frecuencia es la de supresion con 1 mg de dexametasona a medianoche, debido a que resulta economica y facil de realizar. Se considera que la prueba es positiva para hipercortisolismo cuando el valor de cortisol entre las 8 - 9 am del dia siguiente es superior a 5 µg/dL (BC)12. Con este punto de corte se obtiene una elevada sensibilidad principalmente en pacientes que cursan con hipercortisolismo leve; sin embargo, tiene una baja especificidad. Por tal motivo, algunos endocrinologos prefieren la prueba larga con dosis bajas de dexametasona, la cual consiste en administrar 0,5 mg de dexametasona a las 9 am del dia 1, y luego repetir esta dosis a intervalos de 6 horas (2 mg/dia) por 48 horas, con la posterior determinacion de cortisol a las 8 am del dia 3, es decir, 6 horas despues de la administracion de la ultima dosis de dexametasona, conservando el mismo punto de corte de 5 µg/dL (MBC)12. Para pacientes pediatricos (menores de 40 Kg) la dosis de dexametasona se calcula a 30 µg/kg/dia en dosis divididas cada 6 horas12. Los falsos positivos pueden ocurrir por disminucion en la absorcion de dexametasona, insuficiencia hepatica y renal, asi como por sustancias o drogas que aumentan el metabolismo de la dexametasona por induccion del CYP3A4 tales como alcohol, barbituricos, fenitoina, carbamazepina, rifampicina, entre otras (tabla 3)14,15. Se destaca que no existe ningun punto de corte que permita identificar a todos los pacientes con hipercortisolismo, ya que el 8% de los pacientes con SC muestran una supresion menor de 2 µg/dL a pesar de la presencia de la enfermedad16.
Por su parte, la determinación de cortisol en orina de 24 horas, tiene como fundamento la medición de la fracción libre (no unida a proteínas) de dicha hormona; sin embargo, este valor puede ser extremadamente variable y solo un valor cuatro veces mayor al normal para el ensayo es diagnóstico de SC (MBC)1. Además, los pacientes no deben tomar mayor cantidad de agua de la habitual antes de realizar la prueba debido a que algunos estudios han demostrado que esto puede incrementar los valores de cortisol urinario (BC)17-19. Finalmente, antes de realizar esta prueba debe valorarse el funcionalismo renal a través de la determinación sérica de urea y creatinina para evitar falsos negativos. Los falsos positivos asociados a esta prueba se deben a condiciones como la obesidad, depresión, ansiedad y alcoholismo, todos los cuales son causas reconocidas de pseudo- Cushing20. En nuestro medio, los métodos inmunoenzimáticos disponibles para la determinación de cortisol urinario pueden dar falsos positivos debido a que no discriminan entre el cortisol y sus metabolitos. Para tal fin, sería necesario el uso de métodos más avanzados como cromatografía líquida de alta eficacia (HPLC, siglas en inglés de High performance liquid chromatography) o espectrofotometría de masas, con los cuales no contamos y por tanto limitan el uso de esta prueba 21-23.
La prueba de despistaje que cuenta con la mayor sensibilidad y especificidad (sensibilidad 92- 100%, especificidad 93-100%) es la determinación de cortisol salival a medianoche (MC)24-26. Esta prueba se basa en que en individuos sanos con un ciclo convencional estable de sueño-vigilia, existe una caída en las concentraciones de cortisol a medianoche con un posterior ascenso a las 3 – 4 am, y un pico entre las 7 – 9 am. Por tanto, la pérdida del ritmo circadiano con ausencia del nadir de cortisol a medianoche es una anormalidad bioquímica que permite diagnosticar SC27,28. Para la realización de esta prueba el paciente debe recolectar entre las 11 pm y las 12 am (en dos noches) una muestra de saliva en un tubo plástico, con la ventaja de que la misma permanece estable a temperatura ambiente incluso por varias semanas, y posteriormente debe ser llevada al laboratorio.
En Estados Unidos, los métodos mejor validados para la determinación de cortisol en saliva son ELISA y espectrofotometría de masas29. Con estas técnicas, los sujetos normales usualmente presentan valores de cortisol menores de 145 ng/ dL, observándose una buena correlación entre los valores de cortisol salival y sérico en sujetos sanos 29,30. Desafortunadamente, esta prueba no se encuentra disponible actualmente en nuestro país.
En la tabla 3 se muestran las principales drogas que pueden interferir con las pruebas de despistaje para el diagnóstico de SC.
Diagnóstico de la Causa de SC
Una vez demostrada la presencia de hipercortisolismo y por ende de SC, el siguiente paso es determinar si el mismo es ACTH dependiente o independiente. Esta distincion se realiza mediante la determinacion de los niveles plasmaticos de ACTH a las 8 am, de tal modo que en el SC ACTH independiente, esta hormona se encuentra suprimida (ACTH<10 pg/mL), mientras que en el SC ACTH dependiente esta normal o aumentada (ACTH ≥10 pg/mL) (MBC)1. Cabe destacar que algunos pacientes con EC pueden tener concentraciones de ACTH en el limite inferior normal, y de igual forma algunos pacientes con tumores suprarrenales pueden presentar una concentracion no suprimida de ACTH. Por tal motivo, con el fin de aumentar la sensibilidad de la prueba, se sugiere en aquellos pacientes con valores de ACTH en plasma entre 5 - 10 pg/mL, realizar la determinacion de ACTH a los 30, 60 y 90 minutos posterior a la administracion de hormona liberadora de corticotropina (CRH) a dosis de 100 µg VIV; una respuesta plana de ACTH es indicativa de un SC de origen adrenal, mientras que un incremento del 30 - 50% de la ACTH con respecto a la basal sugiere un SC ACTH dependiente (BC) 13,31,32.
En caso de un SC ACTH independiente, se deben realizar estudios imagenológicos como Tomografía Axial Computarizada (TAC) o Resonancia Magnética Nuclear (RMN) a fin de identificar el tipo y la localización de la lesión suprarrenal. Los adenomas suprarrenales usualmente son pequeños, con bordes bien definidos, homogéneos, de menor densidad que el agua en TAC (<10 unidades Hounsfield) e isointenso al hígado con alto contenido lipídico en un T2 de RMN. Por el contrario, el carcinoma suprarrenal es con frecuencia mayor de 6 cm de diámetro, de bordes irregulares, con una densidad mayor de 10 unidades Hounsfield (TAC) y poco homogéneo debido a la presencia de necrosis y hemorragia, con intensidad aumentada intermedia en T2 (RMN)33.
Por su parte, el diagnóstico del SC ACTH dependiente representa un auténtico reto diagnóstico, ya que es necesario definir si la causa es un tumor hipofisario o extrahipofisario hipersecretante de ACTH. Para tal fin, se han propuesto diferentes pruebas, una de ellas es la prueba con CRH. En la EC la respuesta de ACTH está aumentada aunque la concentración basal de ACTH esté normal como se explicó previamente; mientras que en el caso de que exista secreción extrahipofisaria de ACTH, la concentración basal de la hormona está aumentada pero no hay respuesta a la CRH (MBC)13,32.
Otra prueba que ha sido usada durante mucho tiempo en el diagnóstico diferencial del SC ACTH dependiente es la prueba con dosis altas de dexametasona, que consiste en administrar 8 mg de dexametasona a las 11 pm y al dia siguiente determinar el cortisol a las 8 am; en sujetos normales se consiguen concentraciones menores de 2 µg/dL (MBC). Los pacientes con SC por adenoma hipofisario presentan una supresion de cortisol plasmatico mayor de 50% en comparacion con los valores de referencia; aquellos con tumores extrahipofisarios secretores de ACTH, no muestran tal supresion. Se destaca que esta prueba es poco especifica independientemente del protocolo y el punto de corte usado, por lo cual tiene poca utilidad por si sola en el diagnostico diferencial del SC34-36.
En todo paciente con sospecha de SC ACTH dependiente se recomienda realizar una RMN contrastada con gadolinio con énfasis en área sellar, a pesar de que esta técnica es incapaz de identificar la presencia de tumores de hipófisis en el 50% de los pacientes1. La presencia de un adenoma hipofisario en un paciente con manifestaciones clínicas y datos paraclínicos concordantes ofrece un diagnóstico definitivo de EC sin necesidad de pruebas invasivas (MC)1,32.
En la actualidad, se considera el cateterismo del seno petroso inferior el gold standard para establecer el diagnóstico diferencial del SC ACTH dependiente (MC)13,32,34, y se sugiere en todos aquellos sujetos en los cuales los estudios clínicos, bioquímicos o imagenológicos son discordantes (MBC)1. El seno petroso inferior recibe el drenaje sanguíneo de la hipófisis. Debido a que la mitad de la hipófisis drena al seno petroso inferior del mismo lado, se debe tomar muestra simultánea de los dos senos petrosos. En condiciones normales la concentración de ACTH es similar en ambos senos y se corresponde con la concentración en sangre periférica. En caso de tener un adenoma hipofisario productor de ACTH, se obtendrá una relación entre la concentración de ACTH en el seno petroso correspondiente (derecho o izquierdo) y la sangre periférica mayor de 2; mientras que esta relación será menor de 2 en caso de estar presente un tumor extrahipofisario productor de ACTH (MC)1,32,34. Cuando a esta prueba se agrega la estimulación con CRH, los resultados son más fiables37. Una relación de ACTH entre seno petroso y sangre periférica mayor de 3 a los 5 minutos después de la administración de CRH es un dato característico que permite diagnosticar con certeza un adenoma hipofisario productor de ACTH (MC)1,32,34. Esta técnica se lleva a cabo solo en algunos centros especializados.
TRATAMIENTO EN SÍNDROME DE CUSHING
El primer paso para iniciar una terapéutica adecuada consiste en identificar la causa subyacente de la patología, siendo la cirugía el tratamiento de elección en la mayoría de los casos.
Cirugía: la vía transesfenoidal constituye la opción terapéutica de elección en la EC, con una tasa de remisión del 70-90% y una baja mortalidad cuando es realizada por cirujanos expertos38. Por su parte, la cirugía laparoscópica (adrenalectomía uni o bilateral) es de elección en el tratamiento del SC secundario a tumor adrenal, con una tasa de curación del 100% en el caso de adenomas unilaterales, aunque con menor éxito cuando se trata de carcinomas adrenales, en cuyo caso el pronóstico tiende a ser fatal al cabo de 2 – 3 años39. Cuando el SC es secundario a secreción ectópica de ACTH, el tratamiento depende de la patología de base, usualmente consiste en la excéresis quirúrgica del tumor (por ejemplo carcinoma bronquial, timomas, etc).
Se destaca que es necesario dar terapia de reemplazo tanto en la cirugía transesfenoidal (dexametasona) como en la adrenalectomía ante el riesgo de insuficiencia adrenal (hidrocortisona más fludrocortisona).
Radioterapia: Se emplea en la actualidad sólo en pacientes que no responden al tratamiento quirúrgico o en pacientes con intolerancia al tratamiento médico 40.
Tratamiento médico: también denominado adrenalectomía farmacológica. Los fármacos que se utilizan en el tratamiento tanto del SC como de la EC incluyen: inhibidores de la esteroidogénesis adrenal (que bloquean en uno o varios pasos la síntesis de cortisol), agentes de acción central (que inhiben la secreción de ACTH por tumores de la hipófisis) y antagonistas de receptores de glucocorticoides. Cabe destacar que ninguno de éstos ha sido aprobado por la FDA (Federal Drug Administration) para su uso en pacientes con SC o EC, siendo empleados en aquellos pacientes con contraindicación quirúrgica.
Inhibidores de la esteroidogénesis: utilizados para el control del hipercortisolismo. Entre estos medicamentos están:
Ketoconazol: se emplea para disminuir los valores de cortisol a traves de la inhibicion de varias enzimas esteroidogenicas, tales como 17-hidroxilasa, 11ß-hidroxilasa y 18-hidroxilasa41. Se puede emplear como monoterapia a dosis de 300-400 mg via oral BID por un periodo de tiempo de 0,5-8 meses. Sus efectos adversos incluyen aumento de transaminasas, ginecomastia y alteraciones gastrointestinales38. Puede indicarse tambien como tratamiento transitorio desde el momento del diagnostico hasta que se logra la resolucion quirurgica.
Metirapona: inhibe selectivamente la 11ß hidroxilasa, reduciendo entre un 75-80% la concentracion serica de cortisol. Puede utilizarse como monoterapia a dosis de 250 mg BID hasta alcanzar 1,5 gr cada 6 horas. Es la droga de eleccion en las embarazadas por la seguridad demostrada en este grupo de pacientes38,39.
Mitotano: inhibe multiples enzimas esteroidogenicas y a dosis altas posee tambien una accion adrenalitica causando atrofia y necrosis de la glandula suprarrenal. Debido a su toxicidad se utiliza en casos de carcinoma adrenal, y no se recomienda su uso en pacientes que desean embarazo ya que se acumula en el tejido adiposo hasta por 2 anos posterior a la suspension del mismo.
Aminoglutetimida: es un agente anticomicial con efecto supresor sobre la esteroidogenesis a traves de la inhibicion de las enzimas 11ß-hidroxilasa y 18-hidroxilasa41. Es eficaz solo en un 45-50% como monoterapia, por lo que se recomienda su uso en combinacion con otros agentes como la metirapona.
Etomidato: es un agente anestesico, derivado imidazolico, que suprime la esteroideogenesis a traves de la inhibicion de la 17-hidroxilasa, 11ß-hidroxilasa y 17,20-liasa41. Sus dosis oscilan entre 0,03-0,3 mg/Kg/hora via intravenosa, siendo la somnolencia su principal efecto adverso.
Agentes de acción central: aunque son menos empleados, aquí se pueden distinguir los agonistas de dopamina y los análogos de la somatostatina.
Cabergolina: es un agente dopaminérgico aprobado por la FDA para el manejo de la hiperprolactinemia. Es una opción terapéutica en la EC debido a que se ha demostrado que existen receptores dopaminérgicos en los tumores hipofisiarios productores de ACTH. De hecho, en un estudio publicado en el año 2009 se observó respuesta favorable al uso de cabergolina en 15 de 20 pacientes, pero sólo el 40% de ellos mantuvieron una respuesta sostenida a lo largo de 2 años de seguimiento42. De igual forma, Godbout y cols43 demostraron una respuesta favorable al medicamento en 11 de 30 pacientes pero sólo 9 mantuvieron la respuesta con un seguimiento de 3 años. Las dosis utilizadas en estos estudios fueron relativamente altas (1-7 mg por semana en el primero y 0,5-4,0 mg por semana en el segundo).
Análogos de la Somatostatina: el octreotide y el lanreotide han demostrado poca efectividad en el manejo de la EC38, sin embargo, hay resultados promisorios con un análogo de la somatostatina relativamente nuevo que es el pasireotide38,44. De hecho, datos recientes sugieren el uso combinado de ketaconazol, cabergolina y pasireotide como una terapéutica promisoria para el manejo del SC, pero aún se encuentra en etapa de investigación45.
Antagonista del receptor de glucocorticoide: en este grupo se describe el Mifepristone que es un antagonista del receptor de esteroides tipo 2 y antagonista de receptor de progesterona, diseñado para el manejo del hipercortisolismo de diferente etiología, incluído el SC.
Otros medicamentos de utilidad: si el paciente lo amerita como consecuencia de las complicaciones de la enfermedad, debe indicarse el uso de antihipertensivos, considerándose a los diuréticos tiazídicos, inhibidores de la enzima convertidora de angiotensina y calcio antagonistas las primeras opciones terapéuticas. En caso de presentarse diabetes mellitus secundaria al hipercortisolismo, es necesario el uso hipoglucemiantes orales e incluso insulinoterapia46. De igual forma, debe considerarse el uso de bifosfonatos, a fin de prevenir la aparición de osteoporosis.
Se destaca que posterior a la resolucion quirurgica, los pacientes afectos con SC presentan una supresion del eje hipofisis-hipotalamo-adrenal, por lo cual es necesario colocar dosis sustitutivas de esteroides, como hidrocortisona de 12-15 mg/m2, o su equivalente de dexametasona, prednisona o prednisolona, al menos durante 1 mes, aunque en algunos casos su uso puede extenderse por un periodo de 6 a 12 meses; sin embargo, el momento optimo para detener la terapia de reemplazo es cuando los valores sericos de cortisol post estimulacion con CRH sean > 18 µg/dL (500 mmol/L)47. No se ha llegado a un acuerdo entre las diferentes instituciones en lo relativo a los criterios de resolucion de la EC; algunas recomiendan usar como criterio valores muy bajos de cortisol am (menores de 2 µg/dL, o valores entre 2-5 µg/dL), otras usan valores bajos de cortisol libre en orina de 24 horas (por debajo de 20 µg/24h), y otras, valores normales de cortisol post supresion con dosis bajas de dexametasona (1 mg o 2 mg)38. No obstante, se coincide en que para considerar curacion, debe haber remision de las caracteristicas clinicas, normalizacion de los valores sericos de cortisol y ausencia de recurrencia a largo plazo.
Grupo de Trabajo Unidad de Endocrinología, Mérida-Venezuela (ENDO-MER).
Mariela Paoli, Yajaira Zerpa, Yajaira Briceño, Lilia Uzcátegui, Elsy Velázquez, Mayela Guillén, Roald Gómez-Pérez, Miguel Sánchez, Isabel Benítez, Yorgi Rincón, Jueida Azkoul, Magda Luna, Víctor Gil, Miguel Aguirre, Julio Pacheco, Yanire Mejía, Yubriangel Reyes, Marisol Meza.
REFERENCIAS BIBLIOGRÁFICAS
1. Boscaro M, Arnaldi G. Approach to the patient with possible Cushings syndrome. J Clin Endocrinol Metab 2009; 94: 3121-3131. [ Links ]
2. Lindholm J, Juul S, Jorgensen JO, Astrup J, Bjerre P, Feldt-Rasmussen U, Hagen C, Jorgensen J, Kosteljanetz M, Kristensen L, Laurberg P, Schmidt K, Weeke J. Incidence and late prognosis of Cushings syndrome: a population-based study. J Clin Endocrinol Metab 2001; 86: 117-123. [ Links ]
3. Anderson Jr GH, Blakeman N, Streeten DH. The effect of age on prevalence of secondary forms of hypertension in 4429 consecutively referred patients. J Hypertens 1994; 12: 609-615. [ Links ]
4. Omura M, Saito J, Yamaguchi K, Kakuta Y, Nishikawa T. Prospective study on the prevalence of secondary hypertension among hypertensive patients visiting a general outpatient clinic in Japan. Hypertens Res 2004; 27: 193-202. [ Links ]
5. Reincke M, Nieke J, Krestin GP, Saeger W, Allolio B, Winkelmann W. Preclinical Cushings syndrome in adrenal incidentalomas: comparison with adrenal Cushings syndrome. J Clin Endocrinol Metab 1992; 75: 826-832. [ Links ]
6. Terzolo M, Pia A, Ali A, Osella G, Reimondo G, Bovio S, Daffara F, Procopio M, Paccotti P, Borretta G, Angeli A. Adrenal incidentaloma: a new cause of the metabolic syndrome?. J Clin Endocrinol Metab 2002; 87: 998-1003. [ Links ]
7. Catargi B, Rigalleau V, Poussin A, Ronci-Chaix N, Bex V, Vergnot V, Gin H, Roger P, Tabarin A. Occult Cushings syndrome in type-2 diabetes. J Clin Endocrinol Metab 2003; 88: 5808-5813. [ Links ]
8. Leibowitz G, Tsur A, Chayen SD, Salameh M, Raz I, Cerasi E, Gross DJ. Pre-clinical Cushings syndrome: an unexpected frequent cause of poor glycaemic control in obese diabetic patients. Clin Endocrinol (Oxf) 1996; 44: 717-722. [ Links ]
9. Chiodini I, Mascia ML, Muscarella S, Battista C, Minisola S, Arosio M, Santini SA, Guglielmi G, Carnevale V, Scillitani A. Subclinical hypercortisolism among outpatients referred for osteoporosis. Ann Intern Med 2007; 147: 541-548. [ Links ]
10. Steffensen C, Bak AM, Rubeck KZ, Jorgensen JO. Epidemiology of Cushings syndrome. Neuroendocrinology 2010; 92(suppl1): 1-5. [ Links ]
11. Guyatt GH, Oxman AD, Vist GE, Kunz R, Falck-Ytter Y, Alonso-Coello P, Schünemann HJ. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336: 924-926. [ Links ]
12. Nieman LK, Biller BM, Findling JW, Newell-Price J, Savage MO, Stewart PM, Montori VM. The diagnosis of Cushings syndrome: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2008; 93: 1526-1540. [ Links ]
13. Newell-Price J, Bertagna X, Grossman AB, Nieman LK. Cushings syndrome. Lancet 2006; 367: 1605- 1617. [ Links ]
14. Huizenga NA, Koper JW, de Lange P, Pols HA, Stolk RP, Grobbee DE, de Jong FH, Lamberts SW. Interperson variability but intraperson stability of baseline plasma cortisol concentrations, and its relation to feedback sensitivity of the hypothalamo-pituitaryadrenal axis to a low dose of dexamethasone in elderly individuals. J Clin Endocrinol Metab 1998; 83: 47-54. [ Links ]
15. Klose M, Lange M, Rasmussen AK, Skakkebaek NE, Hilsted L, Haug E, Andersen M, Feldt-Rasmussen U. Factors influencing the adenocorticotropin test: role of contemporary cortisol assays, body composition, and oral contraceptive agents. J Clin Endocrinol Metab 2007; 92: 1326-1333. [ Links ]
16. Findling JW, Raff H, Aron DC. The low-dose dexamethasone suppression test: a reevaluation in patients with Cushings syndrome. J Clin Endocrinol Metab 2004; 89: 1222-1226. [ Links ]
17. Mericq MV, Cutler Jr GB. High fluid intake increases urine free cortisol excretion in normal subjects. J Clin Endocrinol Metab 1998; 83: 682-684. [ Links ]
18. Fenske M. How much urinary free cortisol is really cortisol during water diuresis in healthy individuals?. Clin Chem 2004; 50: 1102-1104. [ Links ]
19. Putignano P, Dubini A, Cavagnini F. Urinary free cortisol is unrelated to physiological changes in urine volume in healhy women. Clin Chem 2000; 46: 879. [ Links ]
20. Newell-Price J, Trainer P, Besser M, Grossman A. The diagnosis and differential diagnosis of Cushings syndrome and pseudo-Cushings states. Endocr Rev 1998; 19: 647-672. [ Links ]
21. Murphy BE. How much UFC is really cortisol?. Clin Chem 2000; 46(6 Pt 1): 793-794. [ Links ]
22. Turpeinen U, Markkanen H, Valimaki M, Stenman UH. Determination of urinary free cortisol by HPLC. Clin Chem 1997; 43 (8 Pt 1): 1386-1391. [ Links ]
23. Lin CL, Wu TJ, Machacek DA, Jiang NS, Kao PC. Urinary free cortisol and cortisone determined by high performance liquid chromatography in the diagnosis of Cushings syndrome. J Clin Endocrinol Metab 1997; 82: 151-155. [ Links ]
24. Papanicolaou DA, Mullen N, Kyrou I, Nieman LK. Nightime salivary cortisol: a useful test for the diagnosis of Cushings syndrome. J Clin Endocrinol Metab 2002; 87: 4515-4521. [ Links ]
25. Raff H, Raff JL, Findling JW. Late-night salivary cortisol as a screening test for Cushings syndrome. J Clin Endocrinol Metab 1998; 83: 2681-2686. [ Links ]
26. Trilck M, Flitsch J, Ludecke DK, Jung R, Petersenn S. Salivary cortisol measurement – a reliable method for the diagnosis of Cushings syndrome. Exp Clin Endocrinol Diabetes 2005; 113: 225-230. [ Links ]
27. Krieger DT, Allen W, Rizzo F, Krieger HP. Characterization of the normal temporal pattern of plasma corticosteroid levels. J Clin Endocrinol Metab 1971; 32: 266-284. [ Links ]
28. Glass AR, Zavadil AP, Halberg F, Cornelissen G, Schaaf M. Circadian rhythm of serum cortisol in Cushings disease. J Clin Endocrinol Metab 1984; 59: 161-165. [ Links ]
29. Baid SK, Sinaii N, Wade M, Rubino D, Nieman LK. Radioimmunoassay and tandem mass spectrometry measurement of bedtime salivary cortisol levels: a comparison of assays to establish hypercortisolism. J Clin Endocrinol Metab 2007; 92: 3102-3107. [ Links ]
30. Dorn LD, Lucke JF, Loucks TL, Berga SL. Salivary cortisol reflects serum cortisol: analysis of circadian profiles. Ann Clin Biochem 2007; 44: 281-284. [ Links ]
31. Pecori Giraldi F, Moro M, Cavagnini F, Study Group on the Hypothalamo-Pituitary-Adrenal Axis of the Italian Society of Endocrinology. Gender-related differences in the presentation and course of Cushings disease. J Clin Endocrinol Metab 2003; 88: 1554-1558. [ Links ]
32. Arnaldi G, Angeli A, Atkinson AB, Bertagna X, Cavagnini F, Chrousos GP, Fava GA, Findling JW, Gaillard RC, Grossman AB, Kola B, Lacroix A, Mancini T, Mantero F, Newell-Price J, Nieman LK, Sonino N, Vance ML, Giustina A, Boscaro M. Diagnosis and complications of Cushings syndrome: a consensus statement. J Clin Endocrinol Metab 2003; 88: 5593-5602. [ Links ]
33. Mantero F, Terzolo M, Arnaldi G, Osella G, Masini AM, Alí A, Giovagnetti M, Opocher G, Angeli A; Study Group on Adrenal Tumors of the Italian Society of Endocrinology. A survey on adrenal incidentaloma in Italy. J Clin Endocrinol Metab 2000; 85: 637-644. [ Links ]
34. Lindsay JR, Nieman LK. Differential diagnosis and imaging in Cushings syndrome. Endocrinol Metab Clin North Am 2005; 34: 403-421. [ Links ]
35. Aron DC, Raff H, Findling JW. Effectiveness versus efficacy: the limited value in clinical practice of high dose dexamethasone suppression testing in the differential diagnosis of adrenocorticotropin-dependent Cushings syndrome. J Clin Endocrinol Metab 1997; 82: 1780-1785. [ Links ]
36. Findling JW, Raff H. Cushing syndrome: important issues in diagnosis and management. J Clin Endocrinol Metab 2006; 91: 3746-3753. [ Links ]
37. Swearingen B, Katznelson L, Miller K, Grinspoon S, Waltman A, Dorer DJ, Klibanski A, Biller BM. Diagnostic errors after inferior petrosal sinus sampling. J Clin Endocrinol Metab 2004; 89: 3752-3763. [ Links ]
38. Tritos NA, Biller BM, Swearingen B. Management of Cushing disease. Nat Rev Endocrinol 2011; 7: 279– 289. [ Links ]
39. Stewart PM. La corteza suprarenal. En: Kronenberg HM, Melmed S, Polonsky KS, Larsen PR, eds. Williams Tratado de Endocrinología. Barcelona: Elsevier; 2009: 453-512. [ Links ]
40. Guaraldi F, Salvatori R. Cushing Syndrome: maybe not so uncommon of an endocrine disease. J Am Board Fam Med 2012; 25: 199 –208. [ Links ]
41. Feelders RA, Hofland LJ, de Herder WW. Medical treatment of Cushings syndrome: Adrenal blocking drugs and ketaconazol. Neuroendocrinology 2010; 92(suppl 1): 111–115. [ Links ]
42. Pivonello R, De Martino MC, Cappabianca P, de Leo M, Faggiano A, Lombardi G, Hofland LJ, Lamberts SW, Colao A. The medical treatment of Cushings disease: effectiveness of chronic treatment with the dopamine agonist cabergoline in patients unsuccessfully treated by surgery. J Clin Endocrinol Metab 2009; 94: 223– 230. [ Links ]
43. Godbout A, Manavela M, Danilowicz K, Beauregard H, Bruno OD, Lacroix A. Cabergoline monotherapy in the long-term treatment of Cushings disease. Eur J Endocrinol 2010; 163: 709–716. [ Links ]
44. Colao A, Petersenn S, Newell-Price J, Findling JW, Gu F, Maldonado M, Schoenherr U, Mills D, Salgado LR, Biller BM. A 12-month phase 3 study of pasireotide in Cushings disease. N Engl J Med 2012; 366: 914-924. [ Links ]
45. Tritos NA, Biller BM. Advances in medical therapies for Cusihngs syndrome. Discov Med 2012; 13: 171- 179. [ Links ]
46. Mancini T, Porcelli T, Giustina A. Treatment of Cushing disease: overview and recent findings. Ther Clin Risk Manag 2010; 6: 505-16. [ Links ]
47. Biller BM, Grossman AB, Stewart PM, Melmed S, Bertagna X, Bertherat J, Buchfelder M, Colao A, Hermus AR, Hofland LJ, Klibanski A, Lacroix A, Lindsay JR, Newell-Price J, Nieman LK, Petersenn S, Sonino N, Stalla GK, Swearingen B, Vance ML, Wass JA, Boscaro M. Treatment of adrenocorticotropindependent Cushing syndrome: a consensus statement. J Clin Endocrinol Metab 2008; 93: 2454–2462. [ Links ]