Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.12 no.3 Mérida oct. 2014
Valores de insulina basal y post carga de glucosa oral, homa-ir y quicki, en niños y adolescentes de la ciudad de Mérida, Venezuela. Influencia del sexo y estadio puberal (estudio credefar)
Magda Luna1, Yajaira Zerpa1, Yajaira Briceño1, Roald Gómez1, Nolis Camacho2, Lenin Valeri1, Mariela Paoli1, Grupo de Trabajo CREDEFAR.
1 Unidad de Endocrinología. Instituto Autónomo Hospital Universitario de Los Andes – Universidad de Los Andes, Mérida, Venezuela.
2 Unidad de Nutrición, Crecimiento y Desarrollo Infantil. Instituto Autónomo Hospital Universitario de Los Andes – Universidad de Los Andes, Mérida, Venezuela.
Dirigir correspondencia a: Yajaira Zerpa de Miliani, Email: zerpay@hotmail.com
RESUMEN:
Objetivo: Obtener valores de insulina basal, post carga de glucosa oral, HOMA-IR y QUICKI, y establecer su relación con el sexo y el estadio puberal en niños y adolescentes sanos del Municipio Libertador de la ciudad de Mérida, Venezuela. Materiales y métodos: Participaron 922 sujetos de 9 a 18 años de instituciones públicas y privadas. Se recogieron datos antropométricos. Se determinaron glucemia e insulina (Quimioluminiscencia) en ayunas y 2 horas post carga de glucosa oral. Se calcularon los índices HOMA-IR y QUICKI. Se realizó la distribución percentilar de las variables por sexo y estadio puberal. Resultados: El 51,6% eran de sexo femenino y el 48,4% masculino; el 52,7% de instituciones públicas y el 47,3% de privadas. El 20,4% era prepúber, el 18,3% se encontró en el estadio II de Tanner, el 11,8% en el III, el 16% en el IV y el 33,4% en estadio puberal V. Los valores de insulina y HOMA-IR fueron mayores en el sexo femenino. Los valores más altos se observaron en los estadios II, III y IV. La insulina 2 horas postcarga mostró sus máximos valores en los estadios IV y V. En nuestra población, se proponen valores altos (>pc95) de insulina en ayunas aquellos mayores de 9 mU/mL en el prepúber y de 12 mU/mL en el púber; de insulina 2 horas postcarga mayores de 35 mU/mL en el prepúber y de 65 mU/mL en el púber; de HOMA-IR mayores de 2 en el prepúber y de 2,5 en el púber. Se consideran disminuidos aquellos valores de QUICKI menores de 0,31 (<pc5). Conclusiones: Se evidencia un aumento significativo en los valores de glucemia, insulina e índice HOMA-IR, y disminución del QUICKI, con el progreso del estadio puberal, que debe ser tomado en consideración al definir resistencia a la insulina y riesgo cardiovascular en la población pediátrica. Nuestros valores son inferiores a los encontrados en la literatura.
Palabras clave: Insulino resistencia, insulino sensibilidad, niños sanos, adolescentes sanos, HOMA-IR y QUICKI.
ABSTRACT:
Objective: To obtain values of fasting insulin levels and 2 hours post glucose oral test, values of HOMA-IR and QUICKI and its association with sex and pubertal stages in healthy children and adolescents from the Libertador Municipality of Mérida, Venezuela. Material and methods: We evaluated 922 students between 9 to 17,9 years from publics and privates educational institutions. Anthropometric variables were taken. Fasting glucose and insulin and 2 hours post glucose oral test were measured, and the HOMA and QUICKI indexes were calculated. The percentile distribution of the studied variables according to sex and pubertal stages was performed. Results: The 51.6% were female and 48.4% male; 52.7% were from public and 47.3% from private institution. According to Tanner Stages: 20.4% were Tanner I, 18.3% Tanner II, 11.8% Tanner III, 16% Tanner IV and 33.4% were Tanner V. Values of insulin levels and HOMA were higher in female sex. The higher levels were observed in stages II, III and IV. Insulin 2 hours post oral glucose test levels showed the highest values in Tanner stages IV and V. To our population, we propose more than 9 mU/mL as a high value (>pc95) of fasting insulin in the pre-pubertal stage and 12 mU/mL in pubertal stage; insulin 2 hours post glucose oral test higher than 35 mU/mL in the pre-pubertal and 65 mU/mL for the pubertal stage; HOMA-IR higher than 2 in the pre-pubertal and 2.5 in the pubertal stage. QUICKI levels under 0.31 (<pc5) are considered decreased. Conclusions: We observed a significant increase in the glucose, insulin and HOMA-IR levels, and decrease in QUICKI levels, with the progress of pubertal stage, which should be taken into consideration when defining insulin resistance and cardiovascular risk in the pediatric population. Our values are lower than those found in the literature.
Keywords: Insulin resistance, insulin sensibility, healthy children and adolescents, HOMA-IR and QUICKI.
Articulo recibido en: Abril 2014. Aceptado para publicación en: Agosto 2014.
INTRODUCCIÓN
La insulina, es la hormona anabólica secretada por las células de los islotes pancreáticos de Langerhans, principal reguladora de los mecanismos de homeostasis en el metabolismo de los glúcidos y de los lípidos1-3. La sensibilidad a la insulina es muy variable entre los sujetos sanos, y esta variabilidad se expresa con la edad, la raza, grupos étnicos, el peso y la distribución de la grasa corporal; también en los estados fisiológicos como pubertad, gestación, puerperio y senectud 2.
Un incremento transitorio de la resistencia a la insulina (RI) es un componente normal del desarrollo puberal. Estudios del grupo de Moran y col, usando el clamp euglicémico en 357 niños, demostraron que el aumento de la RI comienza temprano en la pubertad y se resuelve al final de la misma. Los factores involucrados en estos cambios puberales aún no han sido claramente definidos; los niveles de testosterona o estradiol no han mostrado asociación directa con los niveles de RI en esta etapa. Debido a que los niveles de hormona de crecimiento (GH) y del factor de crecimiento símil de insulina tipo 1 (IGF-1) son mucho más elevados durante la pubertad que en la infancia o en la adultez, es posible que la RI de la pubertad normal se relacione a este eje. El IGF-1 estuvo significativamente relacionado a los valores de insulina durante el clamp euglicémico4.
Trevers y cols. en 1995 reportaron en adolescentes, que la sensibilidad a la insulina disminuye a medida que aumenta el índice de masa corporal (IMC); la mayor adiposidad en los varones coincide con un estadio de gónadas de Tanner II (G2) y en las hembras con telarquia III5. En los estadios de maduración sexual de los genitales (G) en los varones y de las glándulas mamarias (GM) en las niñas, se ha reportado un aumento fisiológico de la RI al inicio de la pubertad (G2/GM2), más evidente en el sexo femenino, alcanzando un máximo en G3/GM3, mientras que en el estadio adulto (G5/GM5) es similar a los prepúberes6,7.
Goran y Gower en el 20018 y luego Vinner en el 20059 establecieron algunos puntos de corte para insulinemia después de estudios en el estadio puberal. Determinaron para el estadio prepuberal valores de insulinemia basal ≤ a 15 uU/mL, para la pubertad media (estadio de Tanner II a IV) valores ≤ a 30 uU/mL, y en el estadio postpuberal valores ≤ a 20 uU/mL. Estos estudios establecen puntos de corte para insulina basal e índice HOMA-IR, pero no hay datos en relación a insulina postcarga de glucosa en niños y adolescentes. Otros investigadores han determinado niveles de corte para sus respectivos grupos poblacionales, a través de tablas con percentiles según sexo, edad y estadio puberal10,11.
El término RI es invariablemente utilizado para describir una reducción estadística de la sensibilidad de la insulina de magnitudes variables cuando se compara con un grupo control12,13, es un distintivo de la obesidad, y es la causa, o un factor asociado, al síndrome metabólico (SM), el cual predispone a enfermedad cardiovascular y diabetes14-17; dicho síndrome tiene una prevalencia que oscila entre 3,0 y 8,4% en los niños y adolescentes18,19. La RI está asociada con otras condiciones clínicas, las cuales pueden o no estar asociadas con adiposidad incrementada; éstas incluyen síndrome ovárico poliquístico, esteatohepatitis no-alcohólica y la condición mucho más rara de lipodistrofia20-22.
En el SM ninguna de las clasificaciones conocidas hasta la actualidad (ADA, IDF, ATP III) incluye la medición de los valores de insulina (en adultos o niños) a pesar de ser una de las protagonistas principales en esta alteración metabólica, probablemente debido a los problemas con la estandarización de los diferentes métodos de determinación de insulina y la consecuente amplia variación intra e interensayo. Sin embargo, en la práctica clínica es común la medición de insulina basal, e incluso postprandial, para la definición de RI y SM, sin haber claridad en cuales deben ser los valores considerados normales en la población pediátrica, y sin hacer distinción entre la etapa prepuberal y puberal; es por esto, que nos planteamos determinar valores de referencia propios con distribución por percentiles según estadio puberal y puntos de corte de niveles de insulina basal, post-carga oral de glucosa y el índice de RI HOMA-IR (Homeostasis Model Assessment-Insulin Resistance), en niños y adolescentes de la ciudad de Mérida.
MATERIALES Y MÉTODOS
SUJETOS:
Se realizó un estudio observacional, analítico, de corte transversal. La muestra de este estudio formó parte del proyecto denominado Evaluación del Crecimiento, Desarrollo y Factores de Riesgo Cardiometabólico en Escolares y Adolescentes de la ciudad de Mérida, Venezuela (CREDEFAR), que se llevó a cabo en el Instituto Autónomo Hospital Universitario de Los Andes (IAHULA) desde Marzo 2010 hasta Junio 2011, con la participación de los servicios de Endocrinología, de Nutrición, Crecimiento y Desarrollo Infantil y de Nutrición Clínica. La población y muestreo fueron explicadas en publicación anterior del estudio CREDEFAR23. Se obtuvo una muestra representativa de 927 niños y adolescentes de 9 a 18 años, provenientes de 8 instituciones públicas y 5 privadas del Municipio Libertador de la ciudad de Mérida, donde la escolarización es del 86%. Se incluyeron aquellos cuyos padres, luego de haber leído el folleto informativo, aceptaron su participación en el estudio y firmaron el consentimiento informado. Se excluyeron 5 individuos, una embarazada, uno con diabetes tipo 1, dos con talla baja en tratamiento con hormona de crecimiento, y uno por tener los datos incompletos. La muestra definitiva fue de 922 sujetos, la cual es superior a la estimada para esta investigación, que fue de 50 sujetos por año de edad, esto es 450 individuos; para el cálculo se usaron los valores de referencia para insulina basal en población afroamericana prepuberal (13,9 ± 8,3 μU/mL) propuestos por Goran y col, 20018 y un error alfa de 0,05.
PROCEDIMIENTO
Una vez obtenida la autorización del Instituto Educativo correspondiente, los participantes se citaron con su representante al Laboratorio de Hormonas de la Unidad de Endocrinología del IAHULA para llevar a cabo el siguiente procedimiento: luego de un ayuno de 10 horas, se les tomó una muestra de sangre de la vena antecubital para la determinación inmediata de glucemia basal y una parte de la muestra se centrifugó y se almacenó a – 20°C hasta el posterior procesamiento de la insulina; luego se les suministró una carga de glucosa oral (Glycolab®) a razón de 1,75 mg/kg de peso en 5 minutos, hasta una dosis máxima de 75 g de glucosa. Los participantes se mantuvieron en reposo; transcurridas dos horas se procedió nuevamente a tomar muestra de sangre de la vena antecubital para la determinación inmediata de glucemia y posterior de insulina. La insulina postcarga fue determinada en un subgrupo de 457 participantes que guardaron similar distribución por sexo, estadio puberal y estado nutricional al grupo completo. En el lapso de espera de dos horas comprendido entre una toma de muestra y la otra, se aplicó un cuestionario diseñado especialmente para la investigación, donde se tomaron datos demográficos y antecedentes familiares y personales de enfermedad cardiovascular. Se realizó examen físico que incluyó la determinación de peso, talla y se calculó el índice de masa corporal según la fórmula: IMC= peso(kg)/ talla(m)2. Se consideró obesidad si el IMC era > pc 97, sobrepeso si era > pc 90 y ≤ pc 97, normopeso si el IMC se encontraba entre pc 10 y 90, y bajopeso si el IMC se encontró < pc 10 para la edad y sexo, según los estándares establecidos para nuestra población por Fundacredesa24. Se realizó evaluación de caracteres sexuales femeninos (mamas y vello púbico) y masculinos (volumen testicular, longitud de pene y vello púbico) según el caso, para la determinación del estadio puberal según los estándares de referencia internacional de Tanner.
MÉTODOS
Los participantes se pesaron utilizando una balanza estándar bien calibrada, en posición firme, con los brazos a ambos lados del cuerpo y la vista al frente. La talla se determinó con el promedio de tres medidas realizadas con el estadiómetro de Harpender. En el Laboratorio de Hormonas del IAHULA se realizó la determinación de la glucemia por método enzimático colorimétrico de glucosa hexoquinasa con reactivos de la casa comercial SIEMENS, en el equipo HITACHI 901. La insulina se procesó por inmunoensayo con marcador quimioluminiscente en INMULITE con reactivos de SIEMENS Medical Solutions Diagnostics, con coeficientes de variación interensayo e intraensayo de 6,5 y 5,4% respectivamente. Fueron realizados por el mismo Licenciado en Bioanálisis y con estricto control de calidad. Con estos datos se calculó el índice de resistencia insulínica, Homeostasis Model Assessment-Insulin Resistance (HOMA-IR) según la fórmula: Insulinemia (uU/mL) x Glucemia (mmol/L)/ 22,5 y de QUICKI según la fórmula: 1/ [log insulina plasmática en ayunas (mU/L) + log glucosa plasmática en ayunas (mg/dL)]25. Se cumplieron las normas éticas contempladas en la Declaración de Helsinki.
ANÁLISIS ESTADÍSTICO:
La data obtenida fue explorada, excluyendo los valores atípicos de las variables en estudio (± 3 DE Z-score). Los datos se presentan en tablas y gráficos. Las variables continuas en promedio ± desviación estándar. Las variables categóricas en número y porcentaje. Para el análisis de los datos los participantes se clasificaron por sexo y estadio puberal de Tanner (I a V). Se realizó la distribución por percentiles (pc 5, 10, 25, 50, 75, 90 y 95) de las variables estudiadas de acuerdo al sexo y desarrollo puberal. Se estableció la diferencia estadística entre los grupos aplicando la prueba t de student o el ANOVA para las variables continuas, según sea el caso, y el Chi cuadrado, para las variables categóricas. Se consideró significativo una p< 0,05.
RESULTADOS
Se estudiaron 922 niños y adolescentes pertenecientes a las diferentes instituciones educativas de la ciudad de Mérida. El 51,6% eran de sexo femenino (n=476) y el 48,4% de masculino (n=446); el 52,7% (n=486) pertenecían a institución pública y el 47,3% (n=436) a privada. El rango de edad, fue de 9 a 18,9 años. En cuanto al estadio de Tanner, el 20,4% (n=188) se ubicó en el estadio I, el 18,3% (n=169) en el estadio II, el 11,8% (n=109) en el estadio III, el 16% (n=148) en el estadio IV y el 33,4% (n=308) en el estadio puberal V. El estado nutricional, según el índice de masa corporal, mostró que el 72,8% (n=671) estaban en normopeso, el 9,8% (n=90) en bajopeso, el 9,5% (n=88) en sobrepeso y el 7,9% (n=73) en obesidad (Tabla I). La media y DE de la talla, el peso y el IMC de los participantes (CREDEFAR), así como su correspondiente pc según las curvas venezolanas por edad y sexo, se presentaron en publicación anterior23.
En las tablas II a la VII se presentan la media±DE y la distribución por percentiles (5, 10, 25, 50, 75, 90 y 95), de glucemia en ayunas y 2 horas post-carga de glucosa oral, insulina en ayunas y 2 horas, HOMA-IR y QUICKI de los niños y adolescentes según el estadio puberal y sexo. En la Tabla II se observa que en todos los estadios puberales la glucemia en ayunas fue mayor en el sexo masculino. Los valores promedio presentaron cambios significativos a través de los estadios puberales. El estadio II presentó el mayor valor de la media en ambos sexos.
Valores de glucemia en ayunas mayores del pc 95 se consideran altos; en esta muestra, los valores de glucemia en ayunas del pc 95 en todo el grupo oscilaron entre 97 mg/dL en los estadios puberales IV y V y 101 mg/dL en el estadio II.
En la Tabla III se presenta la media y la distribución en percentiles de glucemia 2 horas postcarga por estadio puberal y sexo. En general, la glucemia 2 horas postcarga fue mayor en el sexo femenino. Los valores promedio presentaron cambios a través de los estadios puberales que fueron significativos en el total de los sujetos. El estadio II presentó el mayor valor de la media en ambos sexos. Valores de glucemia 2 horas postcarga mayores del pc 95 se consideran altos; en esta muestra, estos valores en todo el grupo oscilaron entre 117 mg/dL en el estadio puberal V y 128,30 mg/dL en el estadio II.
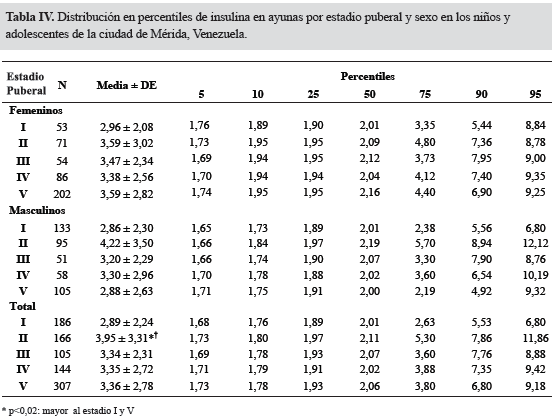
En la Tabla IV se presentan los valores de insulina en ayunas por estadio puberal y sexo en los niños y adolescentes de Mérida. En general la insulina en ayunas fue mayor en el sexo femenino. Los valores promedio presentaron cambios significativos a través de los estadios puberales. El estadio II presentó el mayor valor promedio en el grupo total. Valores de insulina en ayunas mayores del pc 95 se consideran altos; en esta muestra, los valores de insulina en ayunas del pc 95 en todo el grupo oscilaron entre 6,80 μUl/mL en el estadio puberal I y 11,86 μUl/mL en el estadio II; los valores de insulina en ayunas del pc 95 en el sexo femenino oscilaron entre 8,78 μUl/ ml en el estadio II y 9,35 μUl/Ll en el estadio IV, y en el sexo masculino entre 6,80 μUl/mL en el estadio I y 12,12 μUl/mL en el estadio II.
En la Tabla V se muestra la media y la distribución en percentiles de insulina 2 horas post-carga por estadio puberal y sexo en los niños y adolescentes de Mérida, la cual fue determinada en una submuestra de 457 individuos. Los valores, en general, fueron mayores en el sexo femenino. Los valores promedio presentaron cambios significativos a través de los estadios puberales. En el grupo total, los valores promedio de los estadios III, IV y V fueron significativamente mayores al I y II (p=0,001). Valores de insulina 2 horas postcarga mayores del pc 95 se consideran altos; en esta muestra, sus valores en todo el grupo oscilaron entre 34,34 μUl/mL en el estadio puberal I y 63,66 μUl/mL en el estadio IV, en el sexo femenino oscilaron entre 28,44 μUl/mL en el estadio I y 64,93 μUl/mL en el estadio V, y en el sexo masculino entre 35,30 μUl/mL en el estadio I y 73,72 μUl/mL en el estadio IV.
En la Tabla VI se muestran los valores del HOMA-IR por estadio puberal y sexo. En los estadios puberales III y V el valor de HOMAIR fue mayor en el sexo femenino. El estadio II presentó el mayor valor de la media en el sexo masculino. Los valores promedio presentaron cambios significativos a través de los estadios puberales. En el grupo total, el valor de HOMAIR en el estadio II fue significativamente mayor al de los estadios I, IV y V (p<0,01). Valores de HOMA-IR mayores del pc 95 se consideran altos; en esta muestra, los valores de HOMA-IR del pc 95 en todo el grupo oscilaron entre 1,47 en el estadio puberal I y 2,59 en el estadio II, en el sexo femenino oscilaron entre 1,93 en el estadio IV y 2,48 en el estadio II, y en el sexo masculino entre 1,47 en el estadio I y 2,67 en el estadio II.
En la Tabla VII se muestra la media ±DE y la distribución en percentiles del QUICKI por estadio puberal y sexo en los niños y adolescentes de Mérida. El estadio puberal II presentó el menor valor de la media en ambos sexos. Los valores promedio presentaron cambios a través de los estadios puberales que fueron significativos estadísticamente en el total de los sujetos. Valores de QUICKI menores del pc 5 se asocian con disminución de la sensibilidad insulínica; en esta muestra, los valores de QUICKI del pc 5 en todo el grupo oscilaron entre 0,360 en el estadio puberal I y 0,329 en el estadio II; en el sexo femenino oscilaron entre 0,345 en el estadio I y 0,314 en el estadio II, y en el sexo masculino oscilaron entre 0,360 en el estadio I y 0,330 en el estadio II.
DISCUSIÓN
El papel de la RI y sus secuelas ha ganado importancia a medida que la obesidad y la diabetes mellitus alcanzan proporciones epidémicas en el mundo desarrollado, y se le considera como un importante factor de riesgo cardiovascular26,27. Varias técnicas con grados variables de complejidad han sido utilizadas para estimar la sensibilidad de la insulina en los tejidos periféricos; el clamp euglicémico hiperinsulinémico es considerado el patrón de oro, sin embargo, dada su complejidad, duración y costo ha quedado limitado para la investigación clínica28,29. Otras técnicas más sencillas y prácticas en la clínica diaria son las más utilizadas en estudios epidemiológicos para muestras poblacionales amplias, como la insulinemia en ayunas, los índices HOMA-IR y QUICKI30-32. La medición de la concentración de insulina en ayunas y/o 2 horas después de una carga oral de glucosa se considera la forma más elemental de medir RI y puede ser utilizada en estudios epidemiológicos33.
El estudio de algunos de estos parámetros en la población infantil se ha desarrollado en pacientes obesos con o sin RI sin conocer cuáles son los valores en la población sana34. En este estudio se presentan referencias y puntos de corte para insulina basal y post carga de glucosa oral, índices HOMA-IR y QUICKI y su relación con el sexo y el estadio puberal en los niños y adolescentes sanos de la ciudad de Mérida, Venezuela. No hay consensos sobre puntos de corte internacionales, que defina alteración de estas variables en los niños y adolescentes. Son escasos los estudios que a este respecto se encuentran reportados en la literatura internacional o nacional por lo que resulta difícil comparar nuestros resultados con los de otros autores.
En relación a la glucemia en ayunas, se observa que los valores son significativamente mayores en el sexo masculino en todos los estadios puberales, lo que concuerda con lo reportado en la literatura por Garcés y cols35, quienes en su estudio con niños prepuberales entre 6 y 8 años encontraron diferencias estadísticamente significativas en relación al sexo; igualmente, Allard y cols36 refieren en niños y adolescentes, que el promedio de glucosa basal fue mayor en el sexo masculino. En cambio otros autores han reportado valores similares entre sexos en las diferentes edades estudiadas37. En nuestro trabajo, el valor más alto de glucemia en ayunas del pc 95 en todo el grupo fue de 101,00 mg/dL, en el estadio puberal II, lo cual se corresponde al punto máximo de 100 mg/dL considerado normal para la glucemia en ayunas según la ADA (American Diabetes Association)38, y a partir del cual se diagnostica hiperglucemia de ayuno.
En relación a los valores de glucemia dos horas post-carga, no se encontró diferencia significativa entre sexos, pero se evidencia que los valores promedio presentan cambios a través de los estadios puberales con una disminución significativa en los grupos de mayor edad. El valor más alto de glucemia 2 horas post-carga en el pc 95 fue de 136,35 mg/dL, en el estadio II del sexo femenino y en todo el grupo fue de 128,30 mg/dL, también en el estadio puberal II, los cuales se encuentran por debajo de los valores considerados normales (140 mg/dL) para glucemia de dos horas según la ADA38, a partir de los cuales se diagnostica intolerancia a la glucosa; esta discrepancia podría resultar en un sub-diagnóstico de esta alteración en nuestra población.
En la mayoría de la literatura revisada se muestran concentraciones de insulina mayores en las niñas que en los niños, los resultados de estos estudios indican que los niveles de insulina aumentan con la edad en ambos sexos, incrementándose primero en las hembras que en los varones5,6,39,40. Garcés y cols35 encontraron que los niveles de insulina plasmática fueron significativamente mayores en las niñas que en los niños de su misma edad, igualmente Allard y cols36 reportaron un marcado incremento en las concentraciones de insulina observadas en las edades de 13 y 16 años comparando con los 9 años de edad, siendo mayores las concentraciones en el sexo femenino.
García Cuartero y cols34 describieron un ascenso progresivo en los niveles de insulina basal con el estadio puberal, correspondiendo el percentil 90 a 15,05 μU/mL, con diferencia entre sexos y también entre sujetos prepuberales y puberales, alcanzando los valores más elevados en las niñas Tanner IV–V. Aradillas-García y cols39 encontraron niveles promedio de insulina basal de 7,1±3,2 μU/mL, con valores significativamente más altos en los grupos de 6-12 años y 18 años de edad en el sexo femenino sin diferencias en los otros grupos de edad; en ambos sexos, los niveles de insulina mostraron un incremento gradual alcanzando un pico máximo a los 13 años de edad. El grupo de Viso y cols6 mostró que el grupo de 7 a 9 años presentó valores más altos de insulina que el grupo de 2 a 6 años, pero menores a los de 10 a 15 años. Pudiera decirse que la insulina fue incrementando sus valores a medida que avanzaba la edad, mientras que es a partir de los 7 años cuando aparece la diferencia por género en las concentraciones de la hormona, aun cuando las diferencias no fueron significativas. Nuestros datos están acordes con las diferencias previamente reportadas en las concentraciones de insulina entre sexos. Se evidencian valores superiores en el sexo femenino para todos los estadios de Tanner, a excepción del estadio II, donde se aprecia una elevación mayor en el sexo masculino en todos los percentiles. El incremento puberal de insulina podría ser explicado por la hiperinsulinemia compensadora en respuesta a la disminución de la sensibilidad a la insulina asociada al inicio de la pubertad6.
Distintos autores han establecido puntos de corte para definir elevación; en el estadio prepuberal, valores de insulinemia basal ≤ a 15 μU/mL, para la pubertad media (estadio de Tanner II a IV) valores ≤ a 30 μU/mL, y en el estadio post-puberal valores ≤ a 20 μU/mL8,9. En nuestra población, el pc 95 muestra valores muy inferiores a estos, siendo los más altos de acuerdo a los diferentes estadios de Tanner, incluyendo ambos sexos los siguientes: estadio I: 8,84; estadio II: 12,12; estadio III: 9; estadio IV: 10,19; y estadio V: 9,32 mU/mL. En consecuencia, para nuestra población se podría sugerir como valor máximo de insulina en ayunas un nivel de 9 mU/mL en el prepúber y de 12 mU/mL en el púber, los cuales, como ya se mencionó, son inferiores a los reportados por otros autores. En Caracas, Venezuela, Villalobos y cols41 encontraron en un pequeño grupo de niños y adolescentes sin obesidad, un valor de insulina basal de 5,3±2,2 mU/mL en el prepúber y de 8,7±3,5 en el púber; si se calcula el promedio ± 2DE, lo que correspondería aproximadamente a un pc 95-97, se obtendría un valor de 9,7 en el prepúber y de 15,7 en el púber, valores similares a los nuestros. En Venezuela también, Morales y cols37 en Maracaibo, reportan valores similares a los del prepúber de nuestro estudio en el pc 95 de niños de 7 y 9 años (entre 10,58 y 16 μU/mL), pero en edades mayores, los valores son superiores a los nuestros, entre 15,59 y 27,20 μU/mL, lo que muestra las grandes diferencias que se pueden encontrar entre las poblaciones, aun en el mismo país, probablemente asociadas a diferencias en los métodos de medición o diferencias culturales y de estilo de vida, e ilustra la necesidad de contar con valores propios de referencia.
En nuestro estudio se evaluaron los resultados de insulina dos horas posterior a la carga oral de glucosa, sin embargo no se encontraron en la literatura artículos en suficiente población pediátrica para establecer comparaciones. Nuestros resultados demuestran que en la mayoría de los estadios puberales, la insulina 2 horas postcarga fue mayor en el sexo femenino, alcanzando su pico máximo en los estadios IV y V de ambos sexos. Los resultados más altos obtenidos para el percentil 95, de acuerdo a los diferentes estadios de Tanner fueron: estadio I: 35,30 μU/ mL; estadio II: 58,95 μU/ml; estadio III: 52,93 μU/ml; estadio IV: 73,72 μU/ml; y estadio V: 64,93 μU/ml. En consecuencia, para nuestra población se podría sugerir como valor máximo de insulina 2 horas post-carga de glucosa un nivel de 35 mU/mL en el prepúber y de 65 mU/mL en el púber. Villalobos y cols41, en Caracas, Venezuela, reportan valores promedio de insulina dos horas post carga de glucosa oral de 16,3±11,4 mU/mL en el prepúber y de 37,1±22,4 en el púber; el valor del promedio + 2 DE, sería de 39 en el prepúber, similar a nuestro resultado del pc 95, y de 81,9 mU/mL en el púber, valor mayor al nuestro.
Algunos estudios prospectivos en la población adulta demuestran que los sujetos con índice HOMA-IR e insulinemia por encima del percentil 90 para su población, presentan mayor frecuencia de alteraciones cardiovasculares28. En la población infantil la mayoría de los estudios están realizados en niños obesos con o sin RI, por lo que resulta difícil la comparación, existiendo pocos estudios en población infantil no obesa y que considere todos los estadios puberales. En el estudio italiano de D'Annunzio y cols42 con 142 niños sanos, el índice HOMA-IR reportó valores significativamente elevados en sujetos Tanner IV y V en comparación a los sujetos Tanner I, con valores para el percentil 95 de 2,20 para el estadio I; 3,61 para los estadios II y III y 3,64 para los estadios IV y V en ambos sexos. Según el estudio de García Cuartero y cols34, se reporta en forma global como valor máximo un índice HOMA-IR de 3,43, existiendo diferencia entre sexos y entre sujetos prepuberales y puberales, observándose los valores más altos en las niñas IV-V.
Igualmente, Morales y cols37 encontraron un incremento de las concentraciones de insulina, HOMA-IR y HOMA βcell en las niñas de 11 a 13 años comparadas con las de 7 a 9 años, lo cual puede estar relacionado con una disminución de la sensibilidad de la insulina en el inicio de la pubertad, sin la presencia de alteraciones en la función de las células beta. En los varones no se observaron diferencias entre los diferentes grupos etarios. Según esto, pareciera que las niñas son más insulino resistentes que los varones. Aradillas y cols39 obtuvieron un valor global para su grupo de estudio de 2,89±0,7 con un incremento gradual con la edad y logrando una meseta a la edad de 13 años en ambos sexos. Barja y cols43 en adolescentes de 10 a 15 años de Chile, proponen el pc 90 como punto de corte para HOMA-IR, que en varones Tanner I y II fue de 3,2, en niñas 4,1 y para Tanner III-IV un valor de 4,2 para varones y de 5 para hembras.
En nuestro estudio se encontraron valores de HOMA-IR superiores en niñas con relación a los niños en todos los estadios puberales a excepción del Tanner II. En los estadios III, IV y V se evidencia mayor RI en las niñas, patrón acorde a lo reportado en otros estudios5,6,43; los resultados más altos obtenidos para el percentil 95, independientemente del sexo, de acuerdo a los diferentes estadios de Tanner fueron: estadio I: 2,01; estadio II: 2,67; estadio III: 2,17; estadio IV: 2,26; y estadio V: 1,98. En consecuencia, para nuestra población se podría sugerir como valor máximo de HOMA-IR un nivel de 2 en el prepúber y de 2,5 en el púber, los cuales son mucho más bajos a los reportados en la literatura34,39,43, inclusive en el estudio realizado en Maracaibo, Venezuela37, donde encuentran valores de HOMA-IR en pc 95, mayores de 3 en todas las edades y hasta mayores de 5 en varias edades. Al igual que los valores de insulina en ayunas, los del índice HOMA-IR aumentan con la edad y el estadio puberal.
En años recientes, Katz y cols44 han desarrollado una fórmula alternativa, basada en los valores plasmáticos de glucosa e insulina en ayunas para evaluar la sensibilidad a la insulina, la cual denominaron índice QUICKI, que parece mostrar una correlación lineal excelente con el estándar de oro, con una variabilidad y capacidad discriminativa similar a éste. Al igual que ocurre con el HOMA-IR, no se han establecido valores definitivos por debajo de los cuales pueda hablarse de sensibilidad disminuida a la insulina12. En el estudio de DAnnunzio y cols42 demostraron una disminución de los valores del índice QUICKI a medida que los niños avanzan en edad, así los sujetos Tanner IV y V tenían valores significativamente disminuidos al compararlos con los sujetos en estadio I. Por otra parte, La corte y cols45 en su estudio con 269 niños del estado Trujillo, en Venezuela, obtuvieron un índice QUICKI que se mantuvo en un valor que fluctuó discretamente y que está alrededor de 0,40 entre escolares y adolescentes, independientemente de su estado nutricional. En nuestro estudio, al contrario que las variables anteriores, este índice disminuye de forma progresiva con la edad y estadio puberal. Al evaluar el grupo en conjunto se evidencian valores más bajos en las niñas. Valores de QUICKI menores del pc 5 se asocian con sensibilidad insulínica disminuida y en nuestra población correspondería a 0,32.
En este trabajo se muestran los valores de referencia para insulina basal y dos horas posterior a una carga oral de glucosa, medidos por quimioluminescencia, índice HOMA-IR y QUICKI en nuestra población de niños sanos. Se observó en general que los valores promedio de insulina en ayunas y HOMA-IR fueron mayores en el sexo femenino y en el estadio puberal II, y los del índice QUICKI fueron menores en este estadio. De acuerdo al pc 95, se consideran valores altos de insulina en ayunas aquellos mayores de 9 mU/mL en el prepúber y de 12 mU/mL en el púber; de insulina 2 horas postcarga mayores de 35 mU/mL en el prepúber y de 65 mU/mL en el púber; de HOMA-IR aquellos mayores de 2 en el prepúber y de 2,5 en el púber. Se consideran disminuidos aquellos valores de QUICKI menores de 0,32 (< pc 5). Es importante mencionar que nuestros valores de insulina basal y HOMA-IR, son inferiores a los publicados por otros autores, lo cual podría demorar un diagnóstico oportuno de riesgo cardiovascular.
CONFLICTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
AGRADECIMIENTO
Se agradece el financiamiento recibido por el Consejo de Desarrollo Científico, Humanístico, Tecnológico y del Arte de la Universidad de Los Andes (CDCHTA-ULA) bajo el proyecto M-1022-12-07-B y ADG M-10, así como del Fondo Nacional de Ciencia, Tecnología e Innovación (Fonacit) del Ministerio del Poder Popular para Ciencia, Tecnología e Innovación con el proyecto N° 2012000970.
REFERENCIAS BIBLIOGRÁFICAS
1. Blomgarden ZT. Measures of insulin sensitivity. Clin Lab Med 2006; 26:611-33. [ Links ]
2. Blomgarden ZT. Third Annual World Congress on the insulin resistance syndrome. mediators, antecedents, and measurement. Diabetes Care 2006; 29:1700-06. [ Links ]
3. Reaven GM, Mc. The metabolic syndrome: is this diagnosis necessary? Am J Clin Nutr 2006; 83: 1237-1247.
4. Moran A, Jacobs DR Jr, Steinberger J, Hong CP, Prineas R, Luepker R, Sinaiko AR. Insulin resistance during puberty: results from clamp studies in 357 children. Diabetes 1999; 48:2039-2044. [ Links ]
5. Travers SH, Jeffers BW, Bloch CA. Gender. Tanner stage differences in body composition and insulin sensitivity in early pubertal children. J Clin Endocrinol Metab 1995; 80:172-178. [ Links ]
6. Viso M, Solano L, Portillo Z, Lovera D. Insulina sérica en niños y adolescentes obesos y eutróficos. An Venez Nutr 2004; 17:57-63. [ Links ]
7. Macías T. Síndrome metabólico en niños y adolescentes. Arch Ven Pueric Pediatr 2009; 72:30-37. [ Links ]
8. Goran MI, Gover BA. Logitudinal Study on puberal insulin resistence. Diabetes 2001; 50: 2444-2450. [ Links ]
9. Viner R, Segal T, Lichtarowicz-Krynska E, Hindmarsh P. Prevalence of the insulin resistance syndrome in obesity. Arch Dis Child 2005; 90: 10-14. [ Links ]
10. Lamber M, Paradis G, O´Loughlin J, Delvin EE, Hanley JA, Levy E. Insulin resistance syndrome in a representative sample of children and adolescents from Quebec, Canada. Int J Obes Relat Metab Disord 2004; 28: 833-41. [ Links ]
11. Csabi G, Torok K, Jeges S, Molnar D. Presence of metabolic cardiovascular syndrome in obese children. Eur J Pediatr 2000; 159: 91-4. [ Links ]
12. Cutfield WS, Hofman PL. Simple fasting methods to assess insulin sensitivity in childhood. Horm Res 2005; 64 (suppl 3): 25-31. [ Links ]
13. Reaven GM, Mc. The metabolic syndrome: is this diagnosis necessary? Am J Clin Nutr 2006; 83: 1237-1247.
14. Farlane SI, Banerji M, Sowers JR. Insulin resistance and cardiovascular disease. J Clin Endocrinol Metab 2001; 86: 713-718. [ Links ]
15. Karam JH. Pancreatic Hormones and Diabetes Mellitus. In: Greenspan FS, Strewler GJ, editors. Basic and Clinical Endocrinology. Appleton & Lange, Stamford CT USA; 1997 p. 601–2.
16. Wheatcroft SB, Williams IL, Shah AM, Kearney MT. Pathophysiological implications of insulin resistance on vascular endothelial function. Diabet Med 2003; 20:255–68. [ Links ]
17. Paoli M, Pereira A. Síndrome metabólico en el niño y adolescente. Rev Venez Endocrinol Metab 2006; 4:3- 14. [ Links ]
18. ATP III. Executive Summary of the Third Report of the National Cholesterol Evaluation Program (NCEP) Expert Panel of Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA 2001; 285:2486-2497.
19. Calderin R, Prieto M, Cabrera R. Síndrome de insulinorresistencia en niños y adolescentes. Hospital Clinicoquirúrgico Hermanos Almeijeiras. Rev Cuban Endocrinol 2007; 18:7-16. [ Links ]
20. Ehrmann DA, Barnes RB, Rosenfield RL, Cavaghan MK, Imperial J. Prevalence of impaired glucose tolerance and diabetes in women with polycystic ovary syndrome. Diabetes Care 1999; 22:141-6. [ Links ]
21. Garg A, Misra A. Hepatic steatosis, insulin resistance, and adipose tissue disorders. J. Clin. Endocrinol Metab 2002; 87: 3019-22. [ Links ]
22. Villalobos J, Hernández W, Maulino N, Gáffaro L, García M, Merino G, Pérez M, Bracho G, Bolívar M. Diabetes tipo 2 en niños y adolescentes. Experiencia de la unidad de diabetes del Hospital de Niños J.M. de los Ríos. Rev Venez Endocrinol Metab 2004;2:18-23. [ Links ]
23. Mederico M, Paoli M, Zerpa Y, Briceño Y, Gómez- Pérez R, Martínez JL, Camacho N, Cichetti R, Molina Z, Mora Y, Valeri L, Grupo de Trabajo CREDEFAR. Valores de referencia de la circunferencia de la cintura e índice de la cintura/cadera en escolares y adolescentes de Mérida, Venezuela: comparación con referencias internacionales (Estudio CREDEFAR). Endocrinol Nutr 2013;60:235-242.
24. López M, Landaeta M. Manual de crecimiento y desarrollo. Caracas: Fundacredesa; 1991.
25. Ten S, Maclaren N. Insulin resistance syndrome in children. J Clin Endocrinol Metab 2004;89:2526-2539. [ Links ]
26. Wilcox G. Insulin and Insulin Resistance. Clin Biochem Rev 2005 May;26:19-39. [ Links ]
27. Méndez-Castillo JE, Flores-Sánchez J, Noyola DE, de la Cruz-Mendoza E, Calderón Hernández J, Aradillas- García C. Asociación del índice de resistencia a la insulina con niveles de cortisol y medidas antropométricas por genero de niños mexicanos en edad escolar. Bioquímica 2007; 32:126-133. [ Links ]
28. Avignon A, Boegner C, Mariano-Goulart D, Goulart C, Monnier L. Assessment of insulin sensitivity from plasma insulin and glucose in the fasting or post oral glucose-load state. International J Obes 1999;23:512- 517. [ Links ]
29. De Fronzo R, Tobin J, Andrés R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol 1979; 237:E214-E223. [ Links ]
30. Conwell L, Trost S, Brown W, Batch J. Indexes of insulin resistance and secretion in obese children and adolescents: A validation study. Diabetes Care 2004;27:31-9 [ Links ]
31. Steinberger J. Diagnosis of the metabolic syndrome in children. Curr Opin Lipidol 2003; 14:555-59. [ Links ]
32. Decsi T, Molnar D. Insulin resistance syndrome in children. Pediatr Drugs 2003; 5:291-299. [ Links ]
33. Hanson RL. Evaluation of simple indices of insulin sensitivity and insulin secretion for use in epidemiologic studies. Am J Epidemiol 2000; 151: 190-198. [ Links ]
34. García Cuartero B, García C, Jiménez C, González A, Calbo C, Alcázar MJ, Días E. Índice HOMA y QUICKI, insulina y péptido C en niños sanos. Puntos de corte de riesgo cardiovascular. An Pediatr (Barc) 2007;66:481-480. [ Links ]
35. Garcés C, Cano B, Granizo JJ, Benevente M, Viturro E, Gutiérrez-Guisado J, De Olla I, Lasución MA, De Olla M. Insulin and HOMA in Spanish prepubertal children: relationship with lipid profile. Clinical Biochemistry 2005;38:920-924. [ Links ]
36. Allard P, Delvin EE, Paradis G, Hanley JA, OLoughlin J, Lavalle C, Levy E, Lambert M. Distribution of fasting plasma insulin, free fatty acids, and glucose concentrations and of Homeostasis Model Assessment of insulin resistance in a representative sample of Quebec children and adolescents. Pediatric Clinical Chemistry 2003;94:4:644-649. [ Links ]
37. Morales LU, Raleigh X, Fernández V, Molero-Conejo E. Distribución de las concentraciones de glucosa e insulina basal, HOMO-IR y HOMA βcell en niños y adolescentes de la ciudad de Maracaibo, Venezuela. Rev Med Chile 2007;135:205-211. [ Links ]
38. American Diabetes Association. Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 2010; 33:S62-S69.
39. Aradillas-Garcia C, Rodríguez-Moran M, Garay-Sevilla MA, Malacara JM, Rascón–Pacheco RA, Guerrero- Romero F. Distribution of the Homeostasis Model Assessment of insulin resistance in Mexical children and adolescents. Eur J Endocrinol 2012;166:301-306. [ Links ]
40. Ascaso JF, Pardo S, Real J, Lorente R, Priego A, Carmena R. Diagnosing insulin resistance by simple quantitative methods in subjects with normal glucose metabolism. Diabetes Care 2003;26:3320-5. [ Links ]
41. Villalobos J, Gáffaro L, García M, Maulino N, Merino G, Pérez M, Bolívar M. Respuesta de insulina a la carga oral de glucosa en niños y adolescentes con sobrepeso y obesidad. Rev Venez Endocrinol Metab 2011;9:12-19. [ Links ]
42. DAnnunzio G, Vanelli M, Pistorio A, Minuto N, Bergamino L, Iafusco D, Lorini R and the Diabetes Study Group of the Italian Society for Pediatric Endocrinology and Diabetes (ISPED). Insulin resistance and secretion indexes in healthy Italian children and adolescents: a multicentre study. Acta Biomed 2009;80:21-28. [ Links ]
43. Barja S, Arnaiz P, Domínguez A, Villarroel L, Cassis B, Castillo O, Salomó G, Farías M, Goycoolea M, Quiroga T, Mardones F. Insulinemia e índice HOMA en niños y adolescentes chilenos. Rev Med Chile 2011;139:1435-1443. [ Links ]
44. Katz A, Nambi SS, Mather K, Baron AD, Follman DA, Sullivan G, Quon MJ. Quantitative insulin sensitivy check index: a simple accurate methord for assessing insulin sensitivy in humans. J Clin Endocrinol Metab 2000;85:2402-2410. [ Links ]
45. La Corte A, Angel A, Villegas E, Bendezu H, Ortegano M, Vázquez-Ricciardi L. Índices de sensibilidad insulínica (HOMA y QUICKI) en escolares adolescentes sanos en Valera, Estado Trujillo. Venezuela. Arch Venez Pueric Pediatr 2008; 71:74-78. [ Links ]