Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.14 no.1 Mérida feb. 2016
Procalcitonina Plasmática en mujeres obesas y no obesas con Síndrome de Ovarios Poliquísticos.
Jorly Mejia-Montilla1, Melchor Álvarez-Mon2, Eduardo Reyna-Villasmil1, Duly Torres-Cepeda1, Joel Santos-Bolívar1, Nadia Reyna-Villasmil1, Ismael Suarez-Torres1 y Alfonso Bravo-Henríquez3.
1 Servicio de Ginecología, Hospital Central Dr. Urquinaona, Maracaibo, Estado Zulia, Venezuela. 2 Departamento de Medicina, Universidad de Alcalá, Madrid, España. 3 Laboratorio de Investigación y Desarrollo en Nutrición, Universidad del Zulia, Maracaibo, Estado Zulia, Venezuela.
Dirigir correspondencia a: Dr. Eduardo Reyna-Villasmil Email: sippenbauch@gmail.com
RESUMEN
Objetivo: Determinar las concentraciones plasmáticas de procalcitonina, marcador de inflamación de bajo grado, en mujeres obesas y no obesas con diagnóstico de síndrome de ovarios poliquísticos (SOPQ).
Métodos: Se seleccionaron mujeres con diagnóstico de SOPQ y controles sanas, de edades similares, con menstruaciones regulares y ovarios normales por ecografía, que fueron divididas en cuatro grupos (grupo A: SOPQ obesas; grupo B: SOPQ no obesas; grupo C: controles obesas y grupo D controles no obesas) de acuerdo al índice de masa corporal (obesas > 30 Kg/m2 y no obesas < 25 kg/m2). Se analizaron las concentraciones de hormona luteinizante (LH), hormona foliculoestimulante (FSH), androstendiona, testosterona, globulina fijadora de hormonas sexuales, glucosa sérica, insulina y procalcitonina.
Resultados: Las mujeres con SOPQ obesas y no obesas presentaron concentraciones más elevadas de LH, FSH, testosterona, androstendiona e insulina comparado con las mujeres del grupo control de obesas y no obesas respectivamente (p< 0,0001). Se observó que las mujeres con SOPQ presentaron concentraciones significativamente más altas de procalcitonina (grupo A: 0,026±0,003 ng/mL y grupo B: 0,024±0,002 ng/mL) comparado con los controles (grupo C: 0,015±0,001 ng/mL y grupo D: 0,012±0,001 ng/dL; p< 0,0001). Se observó que las concentraciones de procalcitonina presentaban una correlación positiva y significativa con los valores de insulina en ayunas en las mujeres con SOPQ (p< 0,0001).
Conclusión: Las concentraciones plasmáticas de procalcitonina son significativamente mayores en las mujeres con SOPQ obesas y no obesas comparado con las mujeres controles. La procalcitonina podría ser útil como marcador de inflamación de bajo grado en el SOPQ.
Palabras Clave: Síndrome de Ovarios poliquísticos; Procalcitonina; Obesidad.
Plasma Procalcitonin in obese and non obese women with Polycystic Ovary Syndrome
ABSTRACT
Objective: To determine plasma concentrations of procalcitonina, marker of low-grade inflammation, in obese and non-obese women with diagnosis of polycystic ovary syndrome (PCOS).
Methods: Women with diagnosis of PCOS and age-matched healthy controls, with regular menstruations and normal ultrasound ovaries were selected and divided in four groups (group A: PCOS and obese; group B: PCOS and non-obese; group C: obese controls and group D: non-obese controls) according to body mass index (obese > 30 Kg/m2 and non-obese < 25 kg/m2). Concentrations of luteinizing hormone, follicle-stimulating hormone, androstenodione, testosterone, sex hormone-binding globulin, serum glucose, insulin and procalcitonin were measured.
Results: Obese and non-obese women with PCOS had higher luteinizing hormone, follicle stimulating hormone, androstenodione, testosterone, and insulin levels as compared to women in the obese and non-obese control group, respectively (p< 0.0001). Women with PCOS had significantly higher procalcitonin levels (group A 0.026±0.003 ng/mL and group B: 0.024±0.002 ng/mL) as compared with controls (group C: 0.015±0.001 ng/mL and group D: 0.012±0.001 ng/dL; p< 0.0001). We observed that procalcitonin concentrations presented a positive and significant correlation with fasting insulin in PCOS women (p< 0.0001).
Conclusion: Plasma procalcitonin concentrations were significantly higher in obese and non-obese women with PCOS compared with normal controls. Procalcitonin could be useful as a marker of low-grade inflammation in PCOS.
Keywords: Polycystic ovary syndrome; Procalcitonin; Obesity.
Articulo recibido en: Mayo 2015 Aceptado para publicación en: Septiembre 2015
INTRODUCCIÓN
El síndrome de ovarios poliquísticos (SOPQ) es un desorden endocrino común que afecta del 4-8% de las mujeres en edad reproductiva y esta asociado a alteraciones del ciclo menstrual, infertilidad, hiperandrogenismo y un aumento de la prevalencia de la obesidad general y abdominal1,2. La resistencia a la insulina periférica está presente en 50-80% de las mujeres con SOPQ y es agravada por la presencia de la obesidad3. La resistencia a la insulina esta implicada en la etiología del SOPQ a través de la estimulación de la producción de andrógenos ováricos y disminución de la síntesis hepática de globulina fijadora de hormonas sexuales4. Las complicaciones metabólicas asociadas a la resistencia a la insulina también están presentes en el SOPQ independientemente de la presencia o no de obesidad, incluyendo un perfil de riesgo cardiovascular adverso (alteración de la fibrinólisis, disfunción endotelial, dislipidemia y aterosclerosis subclínica) e incremento en la prevalencia de síndrome metabólico, alteración de la tolerancia glucosada y diabetes mellitus no insulinodependiente5,6.
La procalcitonina, un polipéptido de 116 aminoácidos, es el precursor de la hormona calcitonina producida por las células C neuroendocrinas de la tiroides y las células K del pulmón, codificadas por el gen de la calcitonina I en el cromosoma 117. Es mejor conocida como un marcador biológico de infección y, en menos extensión, de procesos inflamatorios8. Tanto la obesidad como el exceso de grasa central están fuertemente asociados a la inflamación crónica, y diferentes estudios han demostrado que el tejido adiposo es capaz de expresar y secretar procalcitonina9.
Un hallazgo importante es que la variación de las concentraciones plasmáticas de procalcitonina, dentro del rango normal, se asocia con resistencia a la insulina y síndrome metabólico en hombres y mujeres aparentemente sanos6. La asociación entre las concentraciones de procalcitonina plasmática es independiente de la edad, grado de obesidad, antecedentes de enfermedades cardiovasculares y patrones de conducta de salud6,7. Esto convierte a la procalcitonina en un potencial marcador de inflamación crónica de bajo grado.
Existe escasa información sobre las concentraciones plasmáticas de procalcitonina en la población general y en mujeres con SOPQ. Más aún las concentraciones de procalcitonina solo han sido estudiadas en pequeños grupos de pacientes con diferentes patologías endocrinas y asociada a las modificaciones debidas al sexo10. Por lo tanto, el objetivo de la investigación fue determinar las concentraciones plasmáticas de procalcitonina, marcador de inflamación de bajo grado, en mujeres obesas y no obesas con diagnóstico de síndrome de ovarios poliquísticos (SOPQ).
MÉTODOS
Entre septiembre de 2009 y julio de 2012 se incluyeron en el estudio mujeres que asistieron a las consultas de Medicina Interna, Endocrinología y Ginecología del Hospital Central Dr. Urquinaona con diagnóstico de SOPQ. El Comité de Ética del hospital aprobó el estudio, y se obtuvo el consentimiento por escrito de todas las mujeres.
El diagnóstico de SOPQ se confirmó por los siguientes criterios: evidencia de oligoanovulación (menos de 6 periodos menstruales en el año previo), signos clínicos o bioquímicos de hiperandrogenismo (concentraciones de testosterona plasmática por encima del límite superior normal y relación hormona luteinizante [LH] / hormona folículoestimulante [FSH] anormal > 2), y ovarios normales o aumentados de tamaño (> 10 ml) con la presencia de microquistes subcapsulares (en número de 12 o más) de 2-9 milímetros de diámetro en la evaluación ecográfica abdominal11.
Se seleccionaron mujeres con SOPQ y obesidad (índice de masa corporal [IMC] > 30 kg/m2; grupo A, n = 34) y SOPQ no obesas IMC < 25 kg/m2; grupo B, n = 13). Las pruebas hormonales y la ecografía abdominal se realizaron durante la fase folicular temprana, entre el tercer y quinto día del ciclo menstrual espontáneo. El grupo control (n = 47) consistió en mujeres de edades similares, con menstruaciones regulares (entre 21 y 35 días), que asistieron a la consulta para sus controles ginecológicos rutinarios sin evidencias de hiperandrogenismo (testosterona total < 60 ng/mL, testosterona libre < 2 ng/mL, sulfato de dehidroepiandrosterona < 27 μg/mL) y ovarios normales por ecografía; fueron divididas de acuerdo al IMC en obesas (IMC > 30 kg/m2; grupo C, n = 33) y no obesas (IMC < 25 kg/m2; grupo D, n = 13). Todas las mujeres controles se estudiaron del día 3 al 5 de su ciclo menstrual.
Se excluyeron las mujeres con enfermedad tiroidea (TSH menor de 0,39 o mayor de 4,0 μUI/mL), disfunción hipotalámica-hipofisaria e insuficiencia ovárica (FSH menor de 1,4 o mayor de 20 mUI/mL y estradiol menor de 20 pg/mL), tumores adrenales u ováricos secretores de andrógenos (testosterona total > 200 ng/mL y sulfato de dehidroepiandrosterona > 800 μg/dL), hiperplasia adrenal congénita no clásica (17 hidroxiprogesterona > 3 ng/mL), presencia de hiperprolactinemia (prolactina > 26 ng/mL), hipertensión secundaria, síndrome de Cushing (determinado por la prueba de supresión con 1 mg de dexametasona), déficit de vitamina B12 o folato, antecedentes de enfermedad hepática, insuficiencia renal con aclaramiento de creatinina < 30 ml/min por 1,73 m2 de superficie corporal, excreción de proteína urinaria > 1 g/día, ángor pectoris, infarto del miocardio o enfermedad cerebrovascular reciente, infecciones activas recientes y aquellas mujeres que no aceptaron participar en el estudio. Las formas secundarias de hipertensión arterial fueron excluidas sobre la base de estudios clínicos y de laboratorio. Las mujeres que tomaban fármacos antihipertensivos fueron excluidas del estudio, y a las que tomaban fármacos hipolipidemiantes se les solicitó que los suspendieran por 4 semanas antes del estudio. Ninguna paciente tomaba fármacos que afectaran las concentraciones de los marcadores de inflamación (por ejemplo, anticonceptivos orales o fármacos sensibilizantes a la insulina).
La evaluación ecográfica se realizó con un ecógrafo Logiq Pro 3 Marca General Electric® usando un transductor abdominal convexo de 3,5 MHz, y un transductor vaginal de 5 MHz. El índice de masa corporal (IMC) se calculó por el peso dividido por la talla al cuadrado (kg/m2), mientras que la relación cintura/cadera (RCC) se calculó por la división de la circunferencia de la cintura entre la circunferencia de la cadera. Se midió la circunferencia de la cintura (punto medio entre el borde inferior costal y la cresta ilíaca) y la cadera (parte más ancha de la región glútea); la medida se obtuvo con una cinta métrica graduada en centímetros, estando el sujeto en bipedestación y los brazos en posición anatómica.
Todas las muestras de sangre venosa se tomaron en ayunas, en la primera semana posterior a la menstruación espontánea o inducida. Todas se manejaron de forma similar y se almacenaron a −8ºC por 1-3 días. Las concentraciones de FSH, LH, estradiol, androstendiona y testosterona se midieron por quimioluminiscencia usando kits comerciales (Immulite® 2000, Diagnostic Product Corp., EE.UU.). Los coeficientes de variación intra- e inter-ensayo fueron de 4 y 7% para FSH, 6 y 7% para LH, 7 y 9% para estradiol, 6 y 10% para androstendiona y 4 y 7% para testosterona, respectivamente. La globulina fijadora de hormonas sexuales se cuantificó por inmunoanálisis (AutoDELFIA® Immunoassay analyzer, PerkinElmer); el coeficiente de variación inter-ensayo fue del 3%, y el intra-ensayo, del 4%.
La glucosa sérica se cuantificó por el método de la glucosa-oxidasa (Pointe Scientific Inc., EE. UU.). Los coeficientes de variación intra- e interensayo fueron de 1,4 y 1,9%, respectivamente. La insulina se determinó por nefalometría (Roche-Diagnostics, Rotkreuz, Suiza). Los coeficientes de variación intra- e inter-ensayo fueron 1,6 y 5,5%, respectivamente. Las concentraciones de procalcitonina se midieron con una prueba inmunoluminométrica (ProCa-S; BRAHMS, Germany). El coeficiente de variación inter- e intra-ensayo fue de 20% y 15%, respectivamente. El límite menor de detección fue de 0,006 ng/mL.
Los datos se presentan como media ± desviación estándar. Para comparar las características clínicas y de laboratorio en las mujeres con SOPQ y las mujeres del grupo control se utilizó la prueba T de Student para muestras no relacionadas. También se utilizó esta prueba para comparar estas características en las mujeres del grupo A y del grupo B con las mujeres del grupo C y D, respectivamente. Los coeficientes de correlación entre las concentraciones de procalcitonina en las mujeres con SOPQ con los parámetros de laboratorio se evaluaron usando la prueba de Pearson. Se realizó un análisis de regresión lineal entre los diferentes parámetros de laboratorio y las concentraciones del marcador en estudio. Se consideró un valor p < 0,05 como estadísticamente significativo.
RESULTADOS
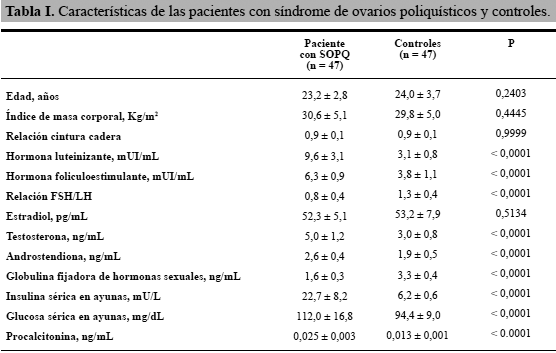
Las características clínicas y endocrinas de las mujeres con SOPQ y los controles se muestran en la tabla I. Los grupos eran similares en edad e IMC. Los hallazgos confirmaron las diferencias entre las mujeres con SOPQ y los sujetos controles; las concentraciones de LH, FSH y la relación FSH/LH estaban significativamente más elevadas en las mujeres con SOPQ comparado con las mujeres del grupo control (p< 0,0001). No se encontraron diferencias estadísticamente significativas en las concentraciones de estradiol. Los valores de testosterona y androstendiona fueron significativamente más altos en las mujeres con diagnóstico de SOPQ (p< 0,0001). Los valores de globulina fijadora de hormonas sexuales fueron significativamente menores en las mujeres con SOPQ comparado con los controles. También se encontraron concentraciones más altas de insulina y glucemia en ayunas en las pacientes con SOPQ comparado con los controles (p< 0,0001).
Los valores de procalcitonina se muestran en la Tabla I. Se observó que las mujeres con SOPQ mostraron concentraciones significativamente más altas (0,025 ± 0,003 ng/mL) comparado con los valores promedios en las mujeres del grupo control (0,013 ± 0,001 ng/mL; p< 0,0001).
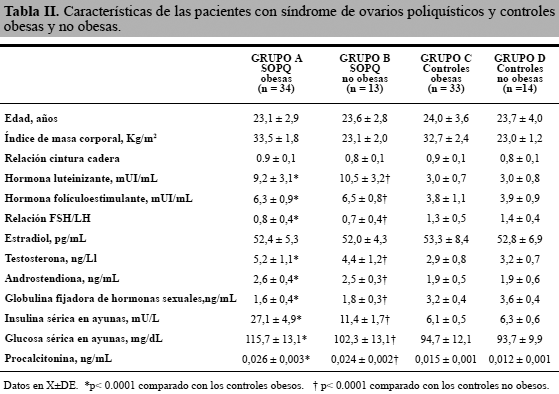
En la tabla II se observan las características de las mujeres con SOPQ obesas (grupo A; n = 34), mujeres con SOPQ no obesas (grupo B; n = 13), controles obesas (grupo C; n = 33) y controles no obesas (grupo D; n = 14). Las mujeres de los cuatro grupos no mostraron diferencias estadísticamente significativas con relación a la edad. Las mujeres de ambos grupos de SOPQ presentaron valores más elevados de LH, FSH, relación FSH/LH, testosterona y androstendiona comparado con las mujeres de los grupos C y D. Por otro lado, no se encontraron diferencias significativas en las concentraciones de estradiol entre las mujeres del grupo A y B comparado con las mujeres del grupo C y D (p=0,5360 y p=0,5016, respectivamente). Las concentraciones de globulina fijadora de hormonas sexuales fueron más bajas en ambos grupos de mujeres con diagnóstico de SOPQ comparado con los controles (p< 0,0001). Con respecto a las concentraciones de insulina, las mujeres de los grupos A y B presentaron concentraciones significativamente más altas que las mujeres del grupo C y D. Las mujeres con SOPQ obesas y no obesas presentaron concentraciones de glucosa sérica significativamente más altas que los controles obesos y no obesos, respectivamente (p< 0,0001).
Se encontró que las mujeres con SOPQ y obesas (grupo A) tenían concentraciones de procalcitonina significativamente más altas que los controles obesos (grupo C) (0,026±0,003 ng/mL comparado con 0,015±0,001 ng/mL; p< 0,001). De igual forma, las pacientes con SOPQ no obesas (grupo B) mostraron concentraciones significativamente más altas de procalcitonina al compararlas con las mujeres controles no obesas (grupo D) (0,024±0,002 ng/mL comparado con 0,012±0,001 ng/mL; p< 0,001).
Al analizar el grupo de mujeres con SOPQ obesas y no obesas, se observó que las concentraciones del procalcitonina presentaban una correlación significativa con los valores de insulina en ayunas (r = 0,161; p < 0,0001). El análisis de regresión lineal mostró que el factor que afectaba la concentración plasmática de procalcitonina fue solo la concentración de insulina en ayunas (beta = 0,00017; p < 0,05).
DISCUSIÓN
Los resultados de la investigación demuestran que las mujeres obesas y no obesas con SOPQ presentan concentraciones más elevadas de procalcitonina comparado con las mujeres controles. Los resultados de la presente investigación son similares a los de Rashad y col.12 quienes reportaron que las concentraciones de procalcitonina estaban aumentadas en las pacientes con SOPQ y también observaron que las pacientes con sobrepeso y obesas presentaron concentraciones más elevadas al compararlas con los controles no obesos.
Las mujeres con SOPQ tienen un aumento en la frecuencia de ciertos factores de riesgo cardiovascular como obesidad, anomalías del perfil lipídico, alteración de la tolerancia glucosada e hipertensión13. Algunos investigadores han demostrado no solo un incremento en la prevalencia de enfermedades cardiovasculares, sino también una mas alta morbilidad cardiovascular aun en mujeres jóvenes y no obesas con SOPQ 14. Existe una creciente evidencia que sugiere un papel de la inflamación observada en el SOPQ con la patogénesis de las enfermedades cardiovasculares15.
Tanto la obesidad como el exceso de grasa central estan asociados con la inflamación crónica de bajo grado12,16. Muchos marcadores proinflamatorios son secretados por el tejido adiposo17. Los marcadores de inflamación, como la procalcitonina, pueden suministrar ayuda para la determinación global de riesgo en estas mujeres. Varios datos clínicos y experimentales sugieren que la procalcitonina se produce en respuesta a las infecciones y en menor grado por estímulos inflamatorios9,18. Se ha descrito que las concentraciones de procalcitonina se correlacionan tanto con la grasa corporal como la distribución de esta6. Además, la procalcitonina representa un nuevo marcador de actividad inflamatoria crónica del tejido adiposo.
La procalcitonina es una pro-hormona que tiene incluida una secuencia idéntica a la calcitonina. Es dividida intracelularmente originando tres moléculas: calcitonina, catalcina y aminoprocalcitonina19. La totalidad de la procalcitonina es convertida en calcitonina, cuya concentración plasmática normal es menor de 0,05 ng/L20. En condiciones metabólicas normales, la procalcitonina hormonalmente activa es producida y secretada en las células C de la glándula tiroides. En caso de infecciones y respuesta inflamatoria, otras células parenquimatosas activadas por los macrófagos y monocitos de varios órganos sintetizan y liberan procalcitonina19,20. La calcitonina y sus péptidos precursores, catalcina, aminoprocalcitonina y amilina, se sintetizan por leucocitos y células neuroendocrinas del pulmón e intestino y por otros tipos de células19-21.
Durante la inflamación, la producción de procalcitonina es inducida por endotoxinas, exotoxinas e interleucinas (factor de necrosis tumoral alfa e interleucina 1, 2 y 6) que inducen procesos de fosforilación, inhibiendo la proteólisis de la procalcitonina por lo que se elevan sus concentraciones. La procalcitonina tiene una vida media de 20 a 24 horas y una alta estabilidad en suero o plasma20. La procalcitonina se ha utilizado para el diagnóstico y diferenciación de infecciones bacterianas, virales y micóticas16,17.
Los primeros en estudiar las concentraciones de procalcitonina como marcador de inflamación en mujeres con SOPQ fueron Puder y col.22 quienes demostraron que las concentraciones de procalcitonina eran mas altas en mujeres obesas comparado con las mujeres no obesas y entre las mujeres con y sin SOPQ. También encontraron que la grasa corporal total se correlacionaba con las concentraciones séricas de procalcitonina. Al estudiar el efecto del SOPQ también se demostró una correlación significativa entre la grasa corporal y las concentraciones de procalcitonina. En esta investigación se observó que las mujeres con SOPQ, tanto obesas como no obesas, presentaban concentraciones significativamente más altas de procalcitonina que los controles obesos y no obesos, respectivamente.
Los resultados de esta investigación, junto a datos experimentales y observacionales, sugieren que las concentraciones de procalcitonina plasmática pueden ser un marcador inflamatorio aún en ausencia de signos de infección sistémica o sepsis 9,17,23. El tejido adiposo humano ha sido identificado como una fuente no neuroendocrina que expresa el ARN mensajero de la calcitonina24, y los macrófagos activados estimulan la secreción de procalcitonina in vitro9. Debido a que la obesidad esta asociada con el aumento de la infiltración de macrófagos en el tejido adiposo, un escenario similar puede ocurrir in vivo.
Un estudio previo suministró evidencia de una asociación entre las concentraciones plasmáticas de procalcitonina con la obesidad, resistencia a la insulina y síndrome metabólico25. Otra investigación ha aportado mayor evidencia sobre los efectos negativos de la procalcitonina en estados de inflamación sistémica y sepsis7. La secreción de procalcitonina por el tejido adiposo en sujetos obesos puede acelerar aún más la actividad proinflamatoria local del tejido adiposo. Más aún, los péptidos relacionados al gen de la calcitonina tienen un efecto directo sobre la resistencia a la insulina26 y altera la secreción de insulina inducida por la glucosa27. Por lo tanto, tanto el péptido como la procalcitonina pueden mediar la resistencia a la insulina inducida por la obesidad y las disfunciones metabólicas asociadas.
Las asociaciones observadas en esta investigación entre las concentraciones plasmáticas de procalcitonina con los valores de insulina en ayunas podrían ser parcialmente dependientes del índice de masa corporal. Este hallazgo apoya la teoría que la procalcitonina es parcialmente dependiente de la cantidad de tejido adiposo. Una posible explicación es que las concentraciones de procalcitonina pueden estar mas relacionadas con la función del adipocito que con la cantidad de tejido graso u otros factores que relacionan la inflamación con el SOPQ 28.
En conclusión, estas observaciones aportan evidencia de que las concentraciones plasmáticas de procalcitonina son significativamente mayores en las mujeres con SOPQ obesas y no obesas comparado con las mujeres controles. La procalcitonina podría ser útil como marcador de inflamación de bajo grado en el SOPQ.
REFERENCIAS
1. Elghblawi E. Polycystic ovary syndrome and female reproduction. Br J Nurs 2007;16:1118-1121. [ Links ]
2. Stankiewicz M, Norman R. Diagnosis and management of polycystic ovary syndrome: a practical guide. Drugs 2006;66:903-912. [ Links ]
3. Li L, Chen X, He Z, Zhao X, Huang L, Yang D. Clinical and metabolic features of polycystic ovary syndrome among Chinese adolescents. J Pediatr Adolesc Gynecol 2012;25:390-395. [ Links ]
4. Pelusi B, Gambineri A, Pasquali R. Type 2 diabetes and the polycystic ovary syndrome. Minerva Ginecol 2004;56:41-51. [ Links ]
5. Srikanthan P, Korenman S, Davis S. Polycystic ovarian syndrome: the next cardiovascular dilemma in women? Endocrinol Metab Clin North Am 2006;35:611-631. [ Links ]
6. Vrbikova J, Hainer V. Obesity and polycystic ovary syndrome. Obes Facts 2009;2:26-35. [ Links ]
7. Uzzan B, Cohen R, Nicolas P, Cucherat M, Perret G. Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma: a systematic review and meta-analysis. Crit Care Med 2006;34:1996- 2003. [ Links ]
8. Schuetz P, Albrich W, Christ-Crain M, Chastre J, Mueller B. Procalcitonin for guidance of antibiotic therapy. Expert Rev Anti Infect Ther 2010;8:575-587. [ Links ]
9. Linscheid P, Seboek D, Schaer D, Zulewski H, Keller U, Müller B. Expression and secretion of procalcitonin and calcitonin gene-related peptide by adherent monocytes and by macrophage-activated adipocytes. Crit Care Med 2004;32:1715-1721. [ Links ]
10. Lin SG, Hou TY, Huang DH, He SY, Lin YD, Zhang LY, Hsieh PS. Role of procalcitonin in the diagnosis of severe infection in pediatric patients with fever and Neutropenia--a systemic review and meta-analysis. Pediatr Infect Dis J 2012;31:e182-188. [ Links ]
11. Broekmans F, Fauser B. Diagnostic criteria for polycystic ovarian syndrome. Endocrine 2006;30:3-11. [ Links ]
12. Rashad NM, El-Shal A, Abdelaziz A. Association between inflammatory biomarker serum procalcitonin and obesity in women with polycystic ovary syndrome. J Reprod Immunol 2013;97:232-239. [ Links ]
13. Thorand B, Baumert J, Kolb H, Meisinger C, Chambless L, Koenig W, Herder C. Sex differences in the prediction of type 2 diabetes by inflammatory markers: results from the MONICA/KORA Augsburg case-cohort study, 1984-2002. Diabetes Care 2007;30:854-860. [ Links ]
14. Bhathena R. Insulin resistance and the long-term consequences of polycystic ovary syndrome. J Obstet Gynaecol 2011;31:105-110. [ Links ]
15. Faloia E, Canibus P, Gatti C, Frezza F, Santangelo M, Garrapa GG, Boscaro M. Body composition, fat distribution and metabolic characteristics in lean and obese women with polycystic ovary syndrome. J Endocrinol Invest 2004;27:424-429. [ Links ]
16. Poulos S, Hausman D, Hausman G. The development and endocrine functions of adipose tissue. Mol Cell Endocrinol 2010;323:20-34. [ Links ]
17. Linscheid P, Seboek D, Zulewski H, Keller U, Müller B. Autocrine/paracrine role of inflammation-mediated calcitonin gene-related peptide and adrenomedullin expression in human adipose tissue. Endocrinology 2005;146:2699-2708. [ Links ]
18. Morgenthaler NG, Struck J, Chancerelle Y, Weglöhner W, Agay D, Bohuon C, Suarez-Domenech V, Bergmann A, Müller B. Production of procalcitonin (PCT) in non-thyroidal tissue after LPS injection. Horm Metab Res 2003;35:290-295. [ Links ]
19. Steinbach G, Bölke E, Grünert A, Störck M, Orth K. Procalcitonin in patients with acute and chronic renal insufficiency. Wien Klin Wochenschr 2004;116: 849-853. [ Links ]
20. Dahaba A, Metzler H. Procalcitonins role in the sepsis cascade. Is procalcitonin a sepsis marker or mediator? Minerva Anestesiol 2009;75:447-452. [ Links ]
21. Schneider H, Lam Q. Procalcitonin for the clinical laboratory: a review. Pathology 2007;39:383-390. [ Links ]
22. Puder J, Varga S, Kraenzlin M, De Geyter C, Keller U, Müller B. Central fat excess in polycystic ovary syndrome: relation to low-grade inflammation and insulin resistance. J Clin Endocrinol Metab 2005;90:6014-6021. [ Links ]
23. van Ree RM, de Vries AP, Oterdoom LH, Seelen MA, Gansevoort RT, Schouten JP, Struck J, Navis G, Gans RO, van der Heide JJ, van Son WJ, Bakker SJ. Plasma procalcitonin is an independent predictor of graft failure late after renal transplantation. Transplantation 2009;88:279-287. [ Links ]
24. Becker KL, Snider R, Nylen ES. Procalcitonin in sepsis and systemic inflammation: a harmful biomarker and a therapeutic target. Br J Pharmacol 2010;159: 253-264. [ Links ]
25. Abbasi A, Corpeleijn E, Postmus D, Gansevoort RT, de Jong PE, Gans RO, Struck J, Hillege HL, Stolk RP, Navis G, Bakker SJ. Plasma procalcitonin is associated with obesity, insulin resistance, and the metabolic syndrome. J Clin Endocrinol Metab 2010;95:E26-E31. [ Links ]
26. Uezono Y, Nakamura E, Ueda Y, Shibuya I, Ueta Y, Yokoo H, Yanagita T, Toyohira Y, Kobayashi H, Yanagihara N, Wada A. Production of cAMP by adrenomedullin in human oligodendroglial cell line KG1C: comparison with calcitonin gene-related peptide and amylin. Brain Res Mol Brain Res 2001;97:59-69. [ Links ]
27. Salles JE, Kasamatsu TS, Dib SA, Moisés RS. Beta-cell function in individuals carrying the mitochondrial tRNA leu (UUR) mutation. Pancreas 2007;34:133-137. [ Links ]
28. Holewijn S, den Heijer M, Swinkels D, Stalenhoef A, de Graaf J. The metabolic syndrome and its traits as risk factors for subclinical atherosclerosis. J Clin Endocrinol Metab 2009;94:2893-2899. [ Links ]