Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.14 no.1 Mérida feb. 2016
Manual Venezolano de Diabetes Gestacional.
Elaborado por: Sociedad Venezolana de Endocrinología y Metabolismo, Sociedad de Obstetricia y Ginecología de Venezuela y Sociedad Venezolana de Medicina Interna.
Editores:
Dra. Imperia Brajkovich, Dr. Freddy Febres Balestrini, Dr. Manuel Camejo, Dr. Anselmo Palacios
AUTORES por orden alfabético:
Lic. María Aguilar. Nutrición Clínica. Directora de Post Grado de Nutrición Clínica, Hospital Universitario Caracas, Universidad Central de Venezuela (UCV). Caracas.
Dra. Sonia Araujo de Urdaneta. Endocrinología, Instituto Autónomo Hospital Universitario de Los Andes (IAHULA). Mérida.
Lic. Rodulfo Alvarado. Biología del Deporte, Universidad Simón Bolívar (USB). Director de BIENFIT C.A. Caracas.
Dra. Imperia E. Brajkovich M. Endocrinología. Profesor Titular de la Facultad Medicina, Escuela Luis Razetti, Catedra Medicina Interna B (J), Hospital Universitario de Caracas, Universidad Central de Venezuela (UCV). Presidente de la Sociedad Venezolana de Endocrinología y Metabolismo (SVEM). Caracas.
Dr. Manuel Camejo. Endocrinología. Profesor Agregado (J) de la Facultad Medicina, Escuela Luis Razetti, Catedra Medicina A, Hospital Universitario de Caracas, Universidad Central de Venezuela (UCV). Caracas.
Dr. José Luis Colina. Medicina Interna .Centro Médico de Occidente. Maracaibo, Zulia.
Dr. Freddy Febres Balestrini. Endocrinología. Adjunto (J) Servicio Endocrinología y Metabolismo Maternidad Concepción Palacios. Unidad Cardiometabólica. Caracas.
Dr. Jairo Fuenmayor. Ginecología y Obstetricia. Profesor de Clínica Obstétrica. Facultad de Medicina, Universidad Central de Venezuela (UCV). Subtesorero de la Sociedad de Obstetricia y Ginecología de Venezuela (SOGV). Caracas.
Dra. Liliana Fung. Endocrinología. Jefe del Servicio de Endocrinología y Metabolismo del Hospital Universitario de Caracas, Universidad Central de Venezuela (UCV). Caracas.
Dra. Ylse Gutiérrez. Medicina Interna. Adjunto del Servicio de Medicina Interna de la Maternidad Concepción Palacios. Caracas.
Dr. Freddy González. Ginecología-Obstetricia. Secretario de la Sociedad de Obstetricia y Ginecología de Venezuela (SOGV). Caracas.
Dra. Tanit Huerfano. Endocrinología. Adjunto Servicio de Endocrinología y Metabolismo. Hospital Militar Dr. Carlos Arvelo. Tesorera de la Sociedad Venezolana de Endocrinología y Metabolismo (SVEM). Caracas.
Dr. Ricardo Javornik. Medicina Deportiva. Director de VAAC. Caracas.
Dra. Cristina López. Medicina Interna. Coordinadora de la Unidad de Patología Médica del Embarazo, Hospital Militar Dr. Carlos Arvelo, Tesorera de la Sociedad Venezolana de Medicina Interna (SVMI). Caracas.
Dr. Tulio López. Endocrinología. Adjunto Servicio de Endocrinología y Metabolismo del Hospital Universitario de Caracas, Universidad Central de Venezuela (UCV). Caracas.
Dr. Anselmo Palacios. Endocrinología. Profesor de Postgrado Endocrinología (J), Hospital Dr. Carlos Arvelo, Universidad Central de Venezuela (UCV) y Clínica El Ávila. Caracas.
Dra. Omidres Pérez. Endocrinología. Unidad Endocrino-Metabólica de Oriente (UNEMOR), Cumaná, Sucre.
Dr. Tony Saba. Endocrinología. Caracas.
Dra. Virginia Salazar. Medicina Interna. Adjunto (J) del Postgrado Universitario de Medicina Interna del Hospital Militar Dr. Carlos Arvelo. Vicepresidenta de Sociedad Venezolana de Medicina Interna (SVMI). Caracas.
Dr. William Sánchez. Ginecología y Obstetricia. Profesor de Clínica Obstétrica. Facultad de Medicina, Universidad Central de Venezuela (UCV). Presidente de la Sociedad Venezolana de Ginecología y Obstetricia (SVGO). Caracas.
Dra. Carmen Santaella. Nutrición Clínica. Docente Post Grado de Nutrición Clínica, Hospital Universitario de Caracas, Universidad Central de Venezuela (UCV). Caracas.
Dra. Judith Toro. Ginecología y Obstetricia. Profesora de Clínica Obstétrica. Facultad de Medicina Universidad Central de Venezuela (UCV). Coordinadora de Salud Sexual y Reproductiva, Sociedad Venezolana de Ginecología y Obstetricia (SVGO). Caracas.
Dra. Ingrid Yépez. Endocrinología. Adjunto Servicio Endocrinología y Metabolismo. Hospital Militar Dr. Carlos Arvelo. Secretaria de la Sociedad Venezolana de Endocrinología y Metabolismo (SVEM). Caracas.
Dirigir correspondencia a: Dra. Imperia Brajkovich Email: imperiabrajkovich@gmail.com
RESUMEN
La diabetes mellitus gestacional (DMG) es uno de los trastornos metabólicos más frecuentes que pueden afectar el embarazo. Su prevalencia aumenta en la misma proporción que la epidemia de obesidad y sobrepeso. Reconocer y tratar cualquier grado de alteración de la glucemia que afecte la gestación conduce a la disminución de complicaciones maternas y fetales, inmediatas y a largo plazo. A pesar de un cúmulo de investigación básica y clínica, aun no existe un enfoque único para diagnosticar y tratar la diabetes durante el embarazo. Lo deseable para nuestro país es buscar la uniformidad de criterios en la pesquisa y el diagnóstico de la DMG, y de esa manera, poder tener nuestra propia casuística. Es por ello que la Sociedad Venezolana de Endocrinología y Metabolismo ha concebido la idea de elaborar este Manual de Diabetes Gestacional, con la colaboración de la Sociedad de Obstetricia y Ginecología de Venezuela, la Sociedad Venezolana de Medicina Interna y Especialistas que integran el equipo multidisciplinario de atención a la embarazada de alto riesgo conformado por endocrinólogos, internistas, obstetras, nutricionistas, deportólogos y/o biólogos del ejercicio y neonatólogos, para que pueda ser utilizado tanto a nivel primario como en áreas de especialización. Este manual se enfocará en la prevención, la pesquisa, el diagnóstico, el tratamiento y seguimiento de la Diabetes Mellitus Gestacional, pudiendo servir de base para la integración del equipo de salud que se constituya para atender a nuestra paciente.
ABSTRACT
Gestational diabetes mellitus (GDM) is one of the most common metabolic disorders that can affect pregnancy. Its prevalence increases in the same proportion as the epidemic of obesity and overweight. Recognize and treat any degree of impaired glucose affecting pregnancy leads to decreased maternal and fetal, immediate and long-term complications. Despite a wealth of basic and clinical research, there is no single approach to diagnose and treat diabetes during pregnancy. Desirable for our country is to seek uniformity of criteria in the screening and diagnosis of GDM and thus able to have our own casuistry. That is why the Venezuelan Society of Endocrinology and Metabolism has conceived the idea of a Manual of Gestational Diabetes, in collaboration with the Society of Obstetrics and Gynecology of Venezuela, the Venezuelan Society of Internal Medicine and specialists who make up the multidisciplinary care team high-risk pregnant formed with endocrinologists, internists, obstetricians, nutritionists, exercise physiologists and/or biologists exercise and neonatologist so that it can be used both at the primary level and areas of expertise. This manual will focus on prevention, screening, diagnosis, treatment and monitoring of Gestational Diabetes Mellitus and can serve as a basis for integrating health team to serve our patient.
Articulo recibido en: Diciembre 2015 Aceptado para publicación en: Enero 2016
ÍNDICE
1) Introducción
2) Objetivos
3) Definición
4) Historia
5) Cambios en el embarazo
6) Importancia de las enfermedades metabólicas en la programación fetal
7) Consulta preconcepcional y seguimiento
8) Los factores de riesgo más importantes para la diabetes gestacional
9) Pesquisa de diabetes gestacional
10) Criterios diagnósticos y metas de control metabólico
11) Estrategia recomendada de un paso: tabla 2
12) Metas de control metabólico para diabetes gestacional: tabla 3 y grafico 1
13) Manejo de la paciente durante la programación del embarazo
14) Control durante el embarazo
15) Frecuencia de evaluación por ultrasonido: control de crecimiento fetal, control de bienestar fetal y control de madurez fetal
16) Exámenes complementarios
17) Tratamiento integral de la diabetes gestacional
18) Tratamiento nutricional de la diabetes gestacional: grafico 2, tablas 4, 5 y 6
19) Recomendaciones nutricionales en diabetes gestacional
20) Recomendaciones del ejercicio en diabetes gestacional y tipos de ejercicio: tabla 7
21) Tratamiento farmacológico de la diabetes gestacional: hipoglucemiantes orales
22) Tratamiento con insulina durante el embarazo, parto y postparto: tablas 8 a 11
23) Manejo postparto y recomendaciones generales: tabla 12 y 13
24) Bibliografía
25) Anexo 1: Cuestionario para la prevención de enfermedades metabólicas del embarazo
26) Anexo 2: Esquema de consultas multidisciplinarias
INTRODUCCIÓN
La diabetes mellitus gestacional (DMG) es uno de los trastornos metabólicos más frecuentes que pueden afectar el embarazo. Su prevalencia aumenta en la misma proporción como la epidemia de obesidad y sobrepeso que afecta al mundo. Reconocer y tratar cualquier grado de alteración de la glucemia que afecte la gestación conduce a la disminución de complicaciones maternas y fetales, inmediatas y a largo plazo. Estas pacientes enfrentan un riesgo aumentado de pre eclampsia, parto prematuro, malformaciones fetales y cesáreas. En el futuro pueden presentar DM tipo 2 y enfermedad cardiovascular. Por su parte los niños nacidos de estas madres sufren con mayor frecuencia macrosomía y trauma obstétrico, y durante el nacimiento estos infantes enfrentan un riesgo mayor a padecer hipoglucemia, hipocalcemia, hiperbilirrubinemia, insuficiencia respiratoria, policitemia y más tarde en la vida adulta obesidad, DM tipo 2 cardiopatías y algunos cánceres 1,2 .
A pesar de un cúmulo de investigación básica y clínica, aun no existe un enfoque único para diagnosticar y tratar la diabetes durante el embarazo. Quién, cómo y cuándo pesquisar y tratar la diabetes durante el embarazo ha sido debatido en la literatura médica por décadas, y este debate pareciera no tener fin. Ensayos clínicos multinacionales que han reclutado miles de pacientes tales como el HAPO (Hiperglycemia Adverse Pregnancy Outcome) han evidenciado cuan dañino pueden ser alteraciones leves de la glucemia en el embarazo, pero aun así la adopción de los nuevos criterios que han surgido de este y otros estudios similares han encontrado resistencia. Los que se oponen a la adopción de estos criterios argumentan que aumentarán la incidencia de diabetes en el embarazo, que conllevarían a un seguimiento durante más largo tiempo, y que el costo sanitario sería mayor 2. Lo deseable para nuestro país, parece ser que busquemos la uniformidad y la generalización en la pesquisa y diagnóstico de la DMG con criterios basados en la evidencia y no en consenso de expertos.
Es por ello que la Sociedad Venezolana de Endocrinología y Metabolismo ha concebido la idea de elaborar un Manual de Diabetes Gestacional con la colaboración de la Sociedad de Obstetricia y Ginecología Venezolana, la Sociedad Venezolana de Medicina Interna y Especialistas que integran el equipo multidisciplinario de atención a la embarazada de alto riesgo (Endocrinólogos, Internistas, Obstetras, Nutricionistas, Deportólogos o Biólogos y/o técnicos en ejercicio y Neonatólogos), para que pueda ser utilizado tanto a nivel primario como en áreas de especialización. Este manual se enfocará en la prevención, la pesquisa, el diagnóstico y el tratamiento de la DMG, así como también en el seguimiento en el postparto inmediato y tardío, pudiendo servir de base para la integración del equipo de salud que se constituya para atender a nuestra paciente
OBJETIVOS DEL MANUAL
1) Promover la consulta pre-concepcional para evaluar y tratar los factores de riesgo de la paciente y disminuir de esa manera la morbilidad del futuro embarazo de esa unión feto-materna.
2) Elaborar una encuesta de factores de riesgo para así tener nuestra propia casuística.
3) Apoyar al médico de cuidados primarios a evaluar a su paciente promoviendo la necesidad del trabajo en conjunto por medio de la referencia oportuna de la paciente al equipo de especialistas multidisciplinario.
4) Formar equipos multidisciplinarios en los ambulatorios y hospitales para garantizar la mejor atención a nuestras pacientes conformadas por el internista, el endocrinólogo, el nutricionista y el obstetra, y el neonatólogo.
5) Promover conciencia social de la necesidad de cambios de estilo de vida para la prevención y adecuado tratamiento de la diabetes gestacional y de las enfermedades asociadas en nuestro país.
DEFINICIÓN DE DIABETES GESTACIONAL
Es una alteración de la tolerancia a la glucosa de severidad variable que comienza o es reconocida por primera vez durante el embarazo en curso.
HISTORIA
Se hace un recuento cronológico de la historia de las investigaciones más importantes en la Diabetes Gestacional que nos permite comprender el desarrollo de los conceptos actuales:
· En 1824, Bennewitz HG en Berlín, describió el caso de una mujer con sed intensa y glucosuria recurrente en tres embarazos sucesivos. Uno de sus niños pesó aproximadamente 5 kilogramos y medio al nacer 3.
· Se emplea por primera vez el término Diabetes Mellitus Gestacional por Carrington, Shuman y Reardon 4.
· En 1923, Reveno WS en USA y Graham G en Inglaterra utilizaron por primera vez la insulina en pacientes diabéticas embarazadas 5,6.
· En 1964 se establecen criterios para la interpretación de la Curva de Tolerancia Glucosada Oral (CTGO) en el embarazo por OSullivan JB y Mahan C. Las cifras establecidas por OSullivan y Mahan fueron: Ayunas 90 mg/dl, 1 hora 165 mg/dl, 2 horas 145 mg/dl y 3 horas 125 mg/dl. Dos o más valores iguales o mayores que estas cifras es exigencia para diagnosticar DMG 7.
· En 1973 el American College of Obsterician and GynecologIst (ACOG) recomienda usar los criterios de OSullivan y Mahan o los de Mestman 8.
· En 1979, Coetzee EJ y Jackson WPU en Sur África usaron por primera vez metformina en DMG 9.
· En 1979 el National Diabetes Data Group (NDDG) define la Diabetes Gestacional enmarcada dentro de una clasificación de la DM en general Esta clase la restringe a embarazadas en quienes el inicio o el reconocimiento de la diabetes o la intolerancia a la glucosa ocurre durante el embarazo 10.
· En 1985, en el segundo Taller International sobre DMG, se recomienda la pesquisa de DMG con 50 grs de glucosa 11.
· En 1987, la American Diabetes Association (ADA), recomienda la pesquisa de DMG en las embarazadas con 30 o más años de edad y en las menores de 30 años con factores de riesgo 11.
· En el 2000, Langer y col, trataron por primera vez pacientes con DMG administrándole glibenclamida 12.
· Aparecieron dos investigaciones recientes en búsqueda de respuesta a interrogantes sobre DMG: El Estudio HAPO (Hyperglycemia and Adverse Pregnancy Outcome) 1 y Australian Carbohydrate Intolerance in Pregnant Women (ACHOIP) 13 y Materno- Fetal Medicine Unit (MFMU) 14.El estudio HAPO se diseñó para evaluar la relación entre la curva de tolerancia glucosada y los eventos adversos del embarazo. Se estudiaron más de 23.000 embarazadas entre el segundo y tercer trimestre del embarazo en 9 países en diferentes partes del mundo. Tanto la macrosomía como la hiperinsulinemia fetal, la hipoglucemia neonatal y la tasa de operación cesárea, se relacionaron con las tres medidas de glucemia plasmática (ayunas, 1hora y 2 horas), usando 75 grs de glucosa oral en ayunas. Los desenlaces secundarios tales como preeclampsia, grasa corporal neonatal, admisión a la unidad de terapia intensiva neonatal y nacimientos pretérmino, también se relacionaron con los niveles de glucemia 1.
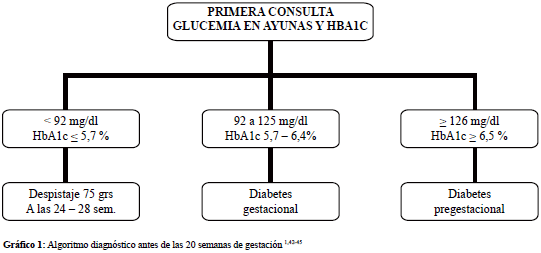
· El IADPSG (International Association Diabetes Study Group), integrado por un amplio grupo de expertos a nivel mundial, consideraron el uso de los puntos de corte para los odds ratios de 1,5 – 1,75 o 2 (comparados con el valor promedio) para el riesgo de macrosomía fetal, adiposidad neonatal e hiperinsulinemia fetal. Se determinó que los tres valores de la prueba de tolerancia, contribuían independientemente a la predicción de los desenlaces adversos. El IADPSG adoptó el uso de la CTGO de 75 g y 2 horas, a un odd ratio de 1.75 lo cual estableció los valores siguientes: ayunas 92 mg/dl, 1hora 180 mg/dl, 2 horas 153 mg/dl. El diagnóstico de DMG se hace con un solo valor igual o mayor de estas cifras. Se hicieron además recomendaciones para identificar diabetes mellitus preexistente al embarazo durante las primeras semanas de la gestación: una glucemia en ayunas ≥ 126 mg/dl, o una glucemia al azar ≥ 200 mg/dl, o una HBA1c ≥ 6.5%, serían la base para este diagnóstico. IADPSG también establece el diagnóstico de DMG cuando en la primera visita prenatal (alrededor de 13 semanas) la glucemia plasmática en ayunas es ≥ 92 mg/dl y menor de 126 mg/dl 15.
Estudios de prevalencia en Venezuela:
· Febres Balestrini y col hicieron la evaluación prospectiva de 3.070 mujeres embarazadas, donde consiguen una prevalencia de DMG de 2,71%. El principal factor de riesgo fue la edad materna mayor de 35 años 16.
· Quintana y col realizaron un estudio de 1.206 embarazadas con factores de riesgo para DMG. La PTGO con carga de 100 gramos de glucosa y determinación de glucemia en ayunas y cada hora por 3 horas mostró una prevalencia de 3%. Los factores de riesgo encontrados fueron la edad, el número de gestaciones, los antecedentes familiares de DM, la obesidad e hipertensión arterial 17.
CAMBIOS EN EL EMBARAZO
El embarazo normal se acompaña de cambios significativos en la homeostasis energética de la madre. Al inicio de la gestación se presenta tendencia al aumento de la sensibilidad de la insulina, con disminución de los niveles de glucosa plasmática en ayunas y ligera disminución de la producción hepática de glucosa. Al finalizar el primer trimestre empieza a disminuir la sensibilidad a la insulina y ya para el tercer trimestre se acompaña de elevación del 30% de la secreción hepática de glucosa basal y disminución entre 40 a 50% de la disposición de glucosa mediada por insulina, lo cual se traduce en: menor sensibilidad a la insulina, predisposición a cetosis acelerada en ayunas y aumento en ayunas de la glucemia y los ácidos grasos libres maternos. Por su parte, las células beta del páncreas aumentan su secreción insulínica hasta en 200%, con el fin de mantener a la madre en euglucemia 18. Estos cambios fisiológicos son potenciados por la elevación de varias hormonas pro diabetogénicas y lipolíticas como las hormonas: Lactógeno placentario, Gonadotropina coriónica, Estradiol, Progesterona, Cortisol, Leptina y Glucagón, en conjunto con citoquinas inflamatorias como el factor de necrosis tumoral alfa, que cambian en el embarazo 18,19.
La resistencia a la insulina es más acentuada después de la ingesta de alimentos, a fin de garantizar el aporte energético al feto, lo que favorece en la madre la predisposición a hipoglucemia y cetosis en ayunas, hiperglucemia postprandial, hiperinsulinemia e insulino resistencia materna 19.Todos estos cambios fisiológicos pueden no ser compensados de forma adecuada en algunos grupos específicos de mujeres, lo cual se traduce en aumento del riesgo de desarrollar diabetes gestacional 19,20. Se conoce hoy día que las mujeres que desarrollan DMG, presentan células beta pancreática con respuesta defectuosa en la producción insulínica ante la hiperglucemia, además de presentar mayor insulino resistencia periférica que aquellas que no desarrollan DMG 20.
Cualquier impedimento de la sensibilidad a la insulina antes del embarazo, agregada a la adaptación fisiológica al embarazo, ejerce una carga importante sobre las células β del páncreas, lo que puede promover un grave deterioro de la situación metabólica y por lo tanto causar alteraciones en las etapas tempranas de la gestación en el metabolismo de la glucosa. Esto implica que la gravedad y la semana gestacional de inicio de la DMG pueden estar relacionadas con un fondo preexistente de resistencia crónica a la insulina 20,21.
IMPORTANCIA DE LAS ENFERMEDADES METABÓLICAS DEL EMBARAZO EN LA PROGRAMACIÓN FETAL
Se sabe actualmente que la expresión de la herencia no depende solo de la estructura genética que se hereda en la fecundación, sino que se debe tener en cuenta si la expresión de esos genes están silenciados (apagados) o activados (prendidos), para expresarse en el genoma funcional del individuo. Se ha comprobado que existen momentos de susceptibilidad donde el medio ambiente apaga o prende genes que protegen o predisponen a diversas enfermedades metabólicas o mentales al futuro ser 21-23.
La vida intrauterina es un momento de gran plasticidad y sensibilidad para activar o desactivar los genes del feto, que producirán cambios epigenéticos que pueden influir negativamente en la futura salud del individuo Las disfunciones metabólicas de la mujer ocasionadas durante el embarazo como: diabetes, obesidad, desnutrición y/malnutrición, hipertensión, hipotiroidismo, alcoholismo, cigarrillo, abuso de drogas y otras enfermedades metabólicas, inflamatorias y autoinmunes, así como situaciones de estrés extremo, producen modificaciones epigenéticas en la vida fetal que se expresaran tardíamente, en la niñez o con mucha mayor frecuencia en la vida adulta o en la vejez 24,25.
Esta predisposición genética heredada, asociada a los excesos adquiridos del medio ambiente, se ha relacionado a obesidad, diabetes, enfermedades cardiovasculares, algunos cánceres de predisposición metabólica como: mama, próstata, riñón, páncreas, estómago y colon entre otros, y producen alteraciones del sistema nervioso como: alteración del aprendizaje, autismo, esquizofrenia y enfermedad de Alzhéimer temprana, entre otros 26.
Bajo este nuevo contexto, para el obstetra y para el equipo de profesionales involucrados en la salud prenatal y perinatal es un deber pensar en la prevención a largo plazo, logrando en lo posible el mejor equilibrio metabólico para la madre y el feto durante el embarazo; de esto, no solo depende la salud de la madre y del producto al nacer, sino también la susceptibilidad genética del futuro adulto a múltiples enfermedades moduladas por el medio ambiente. El médico obstetra y el pediatra deben orientar a las madres, especialmente las de estos productos que han sufrido riesgos metabólicos en el embarazo, para evitar las agresiones del medio ambiente. Es de gran importancia enseñar a comer a estos niños en forma saludable, para evitar el sobrepeso y la obesidad, y promover el deporte y la actividad física, para evitar la interacción desfavorable: Medio Ambiente/Herencia/Epigenética 26-28.
Otro factor a considerar en recientes investigaciones es la existencia de una disbiosis o disbacteriosis, que son irregularidades en la microbiota intestinal, con la consiguiente inflamación de bajo grado como un elemento de la obesidad y sus comorbilidades. Los microbios intestinales juegan un papel importante en la regulación inmune y metabólica, que podrían ser utilizadas en el manejo nutricional de las mujeres embarazadas por las bacterias probióticas, modulando funciones específicas 29. La intervención dietética con los probióticos puede ejercer efectos clínicos más allá de los efectos nutricionales de los alimentos, y durante el embarazo, pueden proporcionan una oportunidad para promover la salud no sólo de la madre sino también del niño 30.
CONSULTA PRECONCEPCIONAL Y SEGUIMIENTO
Los conocimientos actuales justifican la realización de una consulta preconcepcional con la finalidad de identificar y prevenir los factores de riesgo relacionados a las complicaciones metabólicas del embarazo y su producto. Se estima tres meses antes de la búsqueda del embarazo con evaluación integral de la pareja.
En esta consulta se debe hacer una historia clínica completa que incluya la valoración de riesgos: demográficos, historia gestacional previa, historia familiar, antecedentes de enfermedades crónicas e infecciones y medicamentos (Anexo 1). Se debe conversar muy detenidamente con la paciente sobre la importancia de la prevención y tratamiento adecuado para evitar complicaciones maternas fetales y el futuro del nuevo bebe.
FACTORES DE RIESGO MÁS IMPORTANTES PARA DIABETES GESTACIONAL
Los factores de riesgo más importantes para diabetes gestacional son (Tabla I):
1-Edad: Se ha demostrado en población venezolana, la edad mayor de 35 años es un factor importante de riesgo independiente para DMG 31.
2-Indice de masa corporal mayor de 25 Kg/m2. El sobrepeso y la obesidad son el mayor factor de riesgo modificable para desarrollar DMG 31,32, ya que otorgan mayor resistencia a la insulina. Cuando una mujer con obesidad se embaraza aumenta su riesgo de presentar DMG entre 3 a 8 veces según el grupo analizado 31,32, esto es, un riesgo de 3,42 en mujeres con sobrepeso, 7,54 veces en obesas y 10,83 en obesas mórbidas 33,34. También la ganancia de peso antes del embarazo impacta sobre los resultados metabólicos, ya que las mujeres que ganan 2,5 Kg/año o más durante los 5 años previos al embarazo, aumentan hasta 2,5 veces su riesgo de presentar DMG 31
3-Antecedentes familiares de diabetes tipo 2: Los antecedentes de diabetes tipo 2 en familiares de primer grado han sido vinculados como factor de riesgo independiente para desarrollo de DMG 35,36.
4-Antecedentes personales de macrosomía fetal o DMG: Se ha encontrado 12,09 veces mayor probabilidad de presentar DMG en mujeres que han tenido fetos macrosómicos (peso del recién nacido ≥ 4.000 g), llegando en algunos reportes hasta el 20,59% 37.
5-Antecedente personal de Síndrome de Ovarios Poliquísticos (SOP): Las pacientes con SOP cursan con aumento de la resistencia a la insulina, la cual al enfrentarse a la resistencia fisiológica del embarazo trae mayor riesgo de presentar DMG 38, incluso 3 veces más que en la población general 39; esta es la comorbilidad más frecuente en el embarazo de estas mujeres. El riesgo de DMG en este grupo llega a ser de 22 a 44% 40.
6-Grupos étnicos: Tradicionalmente se habla de grupos étnicos de riesgo donde destacan afroamericano, latinos, asiático-americano y de las islas del Pacífico 41.
PESQUISA DE DIABETES GESTACIONAL
A todas las embarazadas, en la primera consulta se les debe realizar glucosa plasmática en ayunas (ideal antes de las 20 semanas de gestación) 42.
CRITERIOS DIAGNÓSTICOS Y METAS DE CONTROL METABÓLICO
En la primera valoración prenatal se debe determinar glucemia basal, hemoglobina A1c o una glucemia casual, para detectar tempranamente las diabéticas no reconocidas previamente, usando los criterios estándar ADA 2015 e iniciar tratamiento y seguimiento en igual forma como se hace con la diabetes previa al embarazo 1. Si no se confirma una diabetes manifiesta, una glucemia basal igual o mayor de 92 mg/dl pero menor de 125 mg/dl, hace el diagnóstico de diabetes gestacional. Si la glucemia basal es menor de 92 mg/dl, se debe realizar una prueba de tolerancia oral a la glucosa con 75 g de glucosa, entre las semanas 24 y 28 de gestación (Ver algoritmo diagnóstico Gráfico 1). Los valores diagnósticos se muestran en la Tabla II. Nuestra recomendación es la de usar un solo paso, como la ADA (American Diabetes Association) 42, NICE Guidelines 43, la AES (American Endocrine Society) 44 no siendo necesario el uso de los 50 g propuestos para el despistaje.
ESTRATEGIA RECOMENDADA DE UN PASO
El despistaje de DMG consiste en realizar una prueba de tolerancia oral a la glucosa, con 75 gr de glucosa diluido en agua y/o ya preparado por un laboratorio y medición de glucemia en ayunas, a la hora y a las 2 horas, de su administración, esta prueba se realizará en la mañana después de un ayuno de al menos 8 horas (Se puede tomar agua) 1,43.
METAS DE CONTROL METABÓLICO PARA DIABETES GESTACIONAL:
Están basadas en las recomendaciones de la V Conferencia Internacional de Trabajo en Diabetes Gestacional 44, consenso de la American Diabetes Association 42 ,NICE Guidelines 43, Sociedad Americana de Endocrinología 1 y Asociación Latinoamericana de Diabetes (ALAD) 45 y se presentan en la Tabla III.
El seguimiento debe de hacerse por medio de monitoreo con glucemias capilares pre y postprandiales 1 o 2 horas para ajustar el tratamiento. En relación a la Hemoglobina glucosilada (A1c) no existen guías claras sobre su uso para control de la diabetes durante el embarazo. La vida media del eritrocito en la gestación es aproximadamente de 90 días 46 por lo que se ha sugerido su uso para control mensual. Se recomienda como meta de control 6% y debería ser usado como medida secundaria. En Venezuela actualmente no se recomienda su uso por la falta de estandarización de los métodos actuales.
MANEJO DE LA PACIENTE DURANTE LA PROGRAMACIÓN DEL EMBARAZO 1,42-45
· Modificación de sus hábitos para hacerlos más saludables
· Terapia nutricional y plan de ejercicio buscando el peso adecuado, especificando los cambios específicos de acuerdo a la paciente.
· Complemento de ácido fólico (5 ó 1 mg/día según la paciente tenga o no antecedentes de alteraciones en el cierre del tubo neural en gestaciones anteriores), Ideal comenzar a tomarlo desde los tres meses previos a la planificación de la gestación.
· Suspender el uso de medicamentos previos como los inhibidores de la enzima convertidora de la angiotensina (IECA) o antagonistas de receptores de la angiotensina II (ARA II) el cual se debe sustituir por alfa metil dopa, las estatinas y el fibrato, sustituirlos por Omega 3 y control estricto de la dieta.
CONTROL DURANTE EL EMBARAZO
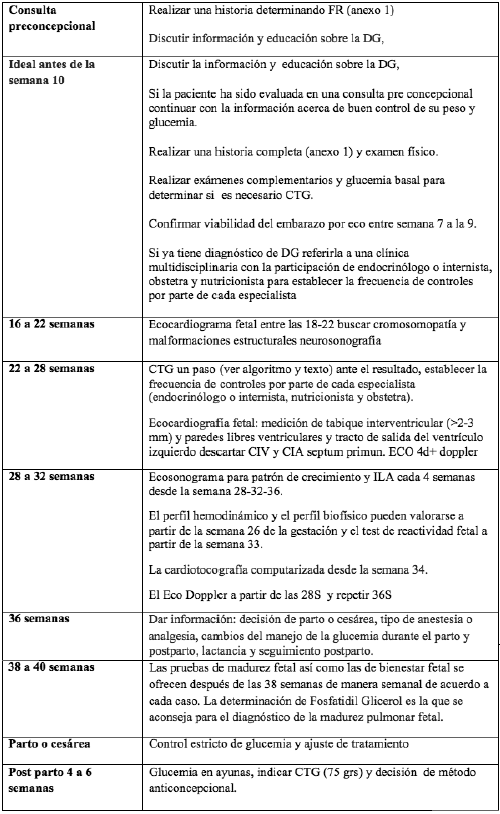
Si la paciente es diagnosticada con diabetes gestacional o diabetes pre-gestacional, el control del embarazo debe realizarse en un Nivel II de atención, que cuenta con la disponibilidad de un equipo multidisciplinario integrado por obstetra, endocrinólogo (o internista) y nutricionista. Las consultas deben realizarse cada 15 días, hasta la semana 32 y luego semanal hasta el término de la gestación 1,42-45.
1) Periodicidad de las consultas: Se debe referir a la paciente al control obstétrico y endocrinológico cada 2 semanas hasta la semana 32 y luego semanal a partir de la semana 36, hasta el término. Esquema de consultas y seguimiento (ver Anexo 2)
2) Énfasis en el seguimiento durante el embarazo:
Peso: Debe ser registrado en cada consulta prenatal y en términos generales debe esperarse un aumento no mayor de 500 g c/15 días, en promedio en cada consulta. Se considera una ganancia de peso lineal de 304 g entre las 8 y 20 semanas y de 488 g semanal hasta el término, y se menciona que el incremento de peso no es predictivo del peso fetal 47. Sin embargo, cuando se tenga el recurso es importante la evaluación por nutricionista y monitorizar la ganancia de peso de acuerdo con el índice de masa corporal por semana de gestación, de acuerdo con las curvas de Rosso y Mardones (Ver sección de tratamiento Nutricional).
Presión arterial: La toma de la presión arterial debe realizarla el médico en todas las consultas. Se debe descartar pre eclampsia-eclampsia, la cual puede aparecer después de la 20 semana de gestación, por ser esta una comorbilidad frecuente en la diabetes gestacional. Los trastornos hipertensivos del embarazo (THE) complican el 5-10 % de todos los embarazos y son una causa importante de morbimortalidad materna y fetal. En mujeres con DM, la HTA agrava el riesgo adverso en el embarazo. La clasificación propuesta por el grupo de trabajo sobre Hipertensión en el Embarazo de los Estados Unidos en el año 2000 (NHBPEP por sus siglas en inglés), validada por el Colegio Americano de Obstetras y Ginecólogos (ACOG), es la más utilizada en nuestro país.
En esta clasificación, los trastornos hipertensivos del embarazo (THE) se dividen en 4 entidades 48,49.
a.- Pre eclampsia - Eclampsia: desorden multisistémico que se manifiesta a partir de la semana 20 de gestación, con cifras de presión arterial (PA) igual o mayor de 140/90 mmHg, asociado a la presencia de proteinuria, igual o mayor de 0,3 g en orina de 24 horas. En el 20 % de los casos no hay proteinuria. La eclampsia se define como la presencia de convulsiones tónicoclónicas generalizadas, de nueva aparición, en una paciente con pre eclampsia.
b.- Hipertensión crónica o pre-existente: PA igual o superior a 140/90 mmHg, que está presente previo al embarazo o que se diagnostica antes de las 20 semanas de gestación y que persiste más allá de las 12 semanas posparto 50.
c.- Hipertensión arterial crónica con pre eclampsia sobre agregada: Se diagnostica cuando aparece proteinuria después de la semana 20 de gestación o brusco aumento de los valores basales previos de proteinuria o agravamiento de cifras de PA y/o aparición de criterios de severidad, en una paciente diagnosticada previamente como hipertensa crónica51.
d.- Hipertensión gestacional: Detección de dos valores de PA iguales o mayores de 140/90 mm Hg separados por 6 horas, después de la semana 20 de gestación, sin proteinuria. Se manifiesta generalmente al final de la gestación, sin criterios de severidad y se normaliza después de las 12 semanas posparto. Es interesante resaltar que las mujeres no diabéticas con HTA durante el embarazo tienen 3 veces más riesgo de desarrollar DM tipo 2 en el futuro, y las no diabéticas con pre eclampsia han demostrado tener una resistencia a la insulina residual después del parto que puede persistir por años 50. Estas observaciones sugieren que la resistencia a la insulina puede jugar un rol causal en el desarrollo del THE, particularmente pre eclampsia. Medidas para mejorar la sensibilidad a la insulina pueden ayudar a prevenir los THE así como atenuar el incremento asociado en el riesgo de ECV 52.
3) Frecuencia de evaluación por ultrasonidos:
No hay un consenso claro en el diagnóstico y monitoreo del crecimiento fetal. El ultrasonido debe ser realizado por un especialista; en la paciente con diabetes es muy importante no solamente para el descarte de malformaciones fetales que son frecuentes en esta patología, sino también para hacer énfasis en el crecimiento fetal, considerando la circunferencia abdominal mayor al percentil (pc) 75 como un marcador incipiente de macrosomía y riesgo de distocia de hombro, y sugiere mejorar el control metabólico; si es menor al pc 75, se debe hacer seguimiento para evitar crecimiento fetal restringido. Se recomienda un eco de segundo nivel con especialista en medicina materno fetal 53.
Si la paciente es una diabética gestacional no diagnosticada previamente debe ser sometida a un ecocardiograma fetal entre las 18-22 semanas. Las pacientes embarazadas con diabetes gestacional deben ser sometidas a estudios de ecosonografía para evaluar crecimiento y la realización de un perfil biofísico. Éste tiene como objetivo conocer el estado de salud del feto; de las variables que se estudian, el índice de líquido amniótico (ILA) es de gran importancia y se obtiene mediante la sumatoria del diámetro vertical mayor en centímetros de cada uno de los cuatro cuadrantes uterinos, se hace cada 4 semanas, a la semana 28,32 y 36. Un ILA mayor al pc 90 de Phellan puede suponer un mal control metabólico de la paciente, lo cual clínicamente se traduce en una altura uterina elevada por encima de lo normal debido un aumento del líquido amniótico (hidramnios) 54.
El perfil hemodinámico puede valorarse a partir de la semana 26 de la gestación y el test de reactividad fetal a partir de la semana 33 55. Las pruebas de madurez fetal así como las de bienestar fetal se ofrecen después de las 38 semanas de manera semanal de acuerdo a cada caso 54,55.
FRECUENCIA DE EVALUACIÓN POR ULTRASONIDO: CONTROL DE CRECIMIENTO FETAL, CONTROL DE BIENESTAR FETAL Y CONTROL DE MADUREZ FETAL
A. Control del crecimiento fetal y anomalías congénitas 53.54:
Se realizará para detectar macrosomía y crecimiento intrauterino restringido. Se evalúa por medio de:
1. Curva de crecimiento fetal por altura uterina en cada visita
2. Ecografía obstétrica: En el 1er trimestre se utiliza para diagnóstico de embarazo que será útil para determinar fecha probable de parto. Se aconseja la medida coronilla-rabadilla cráneo -caudal en todos los casos, así como la realización de los marcadores genéticos (medida de la translucencia nucal y del hueso nasal)
En el 2do trimestre (22 a 24 semanas), con la finalidad de pesquisar anomalías congénitas (nerviosas, renales, digestivas, cardiovasculares u otras)
En el 3er trimestre (de ser posible), se solicitará mensualmente y se determinará: la placenta su localización, espesor y madurez, el volumen del líquido amniótico (ILA) y la biometría fetal para cálculo de peso.
3. Ecocardiografía fetal: En la semana 24 para buscar malformaciones y en la semana 30 la hipertrofia septal asimétrica.
4. Alfa feto-proteína: marcador sérico que se realiza en sangre materna, debe tomarse la muestra entre las 14 a 20 semanas, su alteración se relaciona con defectos del tubo neural. En caso de alteración, evaluar su práctica en líquido amniótico o seguimiento ecográfico especializado. Otros marcadores que sugieren alteraciones tempranas del feto son la determinación de HCG cuantificada y del estradiol, se realizan en sangre materna entre las 14 a 20 semanas.
B. Control del bienestar fetal: Perfil Biofísico 45, 53,54:
Parámetros de evaluación:
1. Movimientos fetales corporales: a) Automonitoreo b) Cardiotacografía c) Ecografía.
2. Volumen de líquido amniótico. (ILA) (Ecografía)
3. Frecuencia cardiaca fetal. Cardiotacografía.
4. Flujo arterial (velocimetría Doppler)
5. Movimientos respiratorios fetales. Ecografía
6. Tono fetal. Ecografía.
Objetivos:
Evitar la muerte intrauterina, la prematuridad y el exceso de peso corporal neonatal.
En cada visita se realizará el control de los latidos cardíacos fetales, y el Automonitoreo de los movimientos fetales.
Los estudios de línea son:
1. Cardiotacografía para Monitoreo Fetal (CTG): Se comenzará de 28 a 32 semanas cuando exista hipertensión arterial, nefropatía, antecedentes de mortinatos y mal control metabólico. Frecuencia regular cada 7 días. Valorar la frecuencia cardiaca fetal basal, variabilidad, reactividad y ausencia de desaceleraciones. El uso de la cardiotocografía computarizada se asoció con una reducción significativa en la mortalidad perinatal (riesgo relativo [RR]: 0,20; intervalo de confianza [IC] del 95%: 0,004 a 0,88), aunque no hubo diferencias en el riesgo de cesárea, la detección de mortalidad perinatal potencialmente prevenible (mortalidad a causa de factores diferentes a anomalías congénitas letales) y los puntajes de Apgar (valoración que se hace al recién nacido al minuto y a los 5 minutos por parte del pediatra asignándole 0-1, o 2 puntos a cada una de las siguientes categorías: esfuerzo respiratorio, frecuencia cardíaca, tono muscular, reflejos, color de la piel). Las puntuaciones menores de siete a los cinco minutos, se relacionan con aumento en la duración de la hospitalización en la unidad de cuidados intensivos neonatales o la edad gestacional al nacer. Inicio 32 a 34 semanas 53.
En caso de anormalidades se realizará perfil biofísico fetal por ultrasonido (PBF). El perfil biofísico consta de los siguientes parámetros de estudio: El ILA, el movimiento fetal, el tono y postura del feto. Los movimientos respiratorios fetales son otro indicador de bienestar fetal y la determinación de la actividad o reactividad cardíaca fetal. Si el PBF es menor de 4 puntos o la madre está con hiperglucemia mal controlada, estabilizar y considerar la interrupción del embarazo 53,54.
2. Ecografía: volumen de líquido amniótico.
● Volumen aumentado: valorar el grado de control metabólico y/o la posibilidad de alguna malformación que ha escapado a los exámenes ultrasonográficos
● Volumen disminuido: descartar ruptura prematura de membranas (RPM), crecimiento intrauterino restringido o retardado (CIUR) y malformaciones digestivas y/o renales.
3. Velocimetría Doppler: a partir de las 28 semanas
Se realizará en pacientes con: Hipertensión arterial, Retinopatía, Nefropatía, etc.
C. Control de la madurez fetal 45,53,54:
Sólo se realizará cuando sea necesaria la interrupción del embarazo antes de las 37 semanas. La determinación de Fosfatidil Glicerol (FG) son fosfolípidos que aumentan desde la semana 35 en el líquido amniótico y determinan la madurez pulmonar fetal. La síntesis de los FG se retrasa en fetos de madres con diabetes gestacional. Luego de evaluarse los riesgos contra los beneficios, si es necesario el uso de corticoides para la maduración pulmonar se hará, bajo un estricto control metabólico. Valorar el uso de corticoides antes de las 34 semanas. El tratamiento se mantendrá por 72 horas en los casos del uso de corticoides o hasta finalizado el uso de beta mimético. La maduración pulmonar con esteroides tiene las mismas indicaciones que la paciente no diabética y se utiliza el esquema de 12 mg cada 12 horas por dos dosis, y para un adecuado control de la glucemia esta se controla con insulina 45; dosis única siempre y cuando exista adecuado control de la glucemia 54,55. Los fármacos beta miméticos no deben ser utilizados para tratamiento y control del parto pre término (sulfato de magnesio y anti cálcicos preferentemente) si fuera necesario su uso, sería de 12 mg cada 12 horas por dos dosis 53-56.
4) Exámenes complementarios:
Se debe seguir el esquema establecido para toda embarazada no diabética: hematología completa, urea, creatinina, IGG/IGM de rubeola, toxoplasmosis, citomegalovirus, hepatitis A/B, orina, heces, grupo y Rh, VDRL, HIV; también es conveniente que la gestante traiga a cada consulta prenatal una muestra de orina para determinación con cinta el pH, albumina, glucosa, sangre oculta, pigmentos biliares y cuerpos cetónicos. Estos exámenes deben repetirse de ser posible cada tres meses 57.
TRATAMIENTO INTEGRAL DIABETES MELLITUS GESTACIONAL 1, 43-45,57:
El tratamiento inicial en las pacientes con DMG es la modificación en el estilo de vida. La modificación en la dieta y evitar el sedentarismo con ejercicios es fundamental. Se considera prioritaria la evaluación de la embarazada por un nutricionista para que pueda llevar el régimen nutricional adecuado a su condición metabólica.
En general se recomienda:
1) Evitar medicamentos teratogénicos como estatinas, antihipertensivos ARAII o IECA
2) Control de glucemias capilares pre y postprandial según metas
3) Dieta y ejercicio
4) Si no logra metas a la semana comenzar tratamiento farmacológico
5) Preparación para parto o cesárea
6) Post parto evaluación a las 4 a 6 semanas
TRATAMIENTO NUTRICIONAL EN DIABETES MELLITUS GESTACIONAL
Valoración Nutricional
El objetivo de la terapia nutricional en DMG es suministrar una adecuada ingesta de calorías y nutrientes para una apropiada ganancia de peso gestacional, registrar cifras normales de glucemia con ausencia de cetosis 58 .Uno de los métodos más sencillos y prácticos para el diagnóstico nutricional de la embarazada es el Índice de Masa Corporal. Para realizar la evaluación nutricional de la embarazada es preciso conocer el peso pre gestacional, el cual es el peso usual de la paciente antes del embarazo, también puede ser el peso al inicio de la gestación (hasta las 12 semanas), ya que durante las primeras semanas no se observan cambios importantes en el peso de la gestante 59.
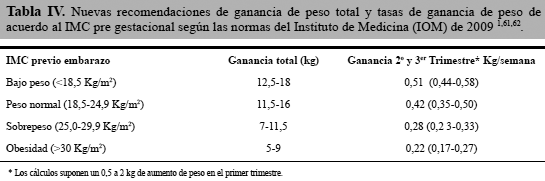
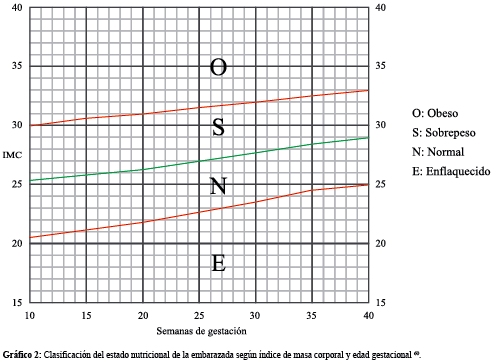
Para la clasificación nutricional y ganancia de peso durante el embarazo se pueden utilizar las Recomendaciones del Instituto de Medicina de los Estados Unidos 59 (Tabla IV) y la Propuesta de un Nuevo estándar de Evaluación Nutricional en embarazadas basado en el IMC y tomando en cuenta la edad gestacional con valores de referencia para la semana gestacional 10 a la 40 (gráfico 2) 60.
Estimación de las necesidades energéticas en embarazada con Diabetes Mellitus Gestacional: de acuerdo a la Asociación Americana de Diabetes1,63, Joslin Diabetes Center and Joslin Clinic Guideline for Detection and Management of Diabetes in Pregnancy 64.
Macronutrientes y Micronutrientes
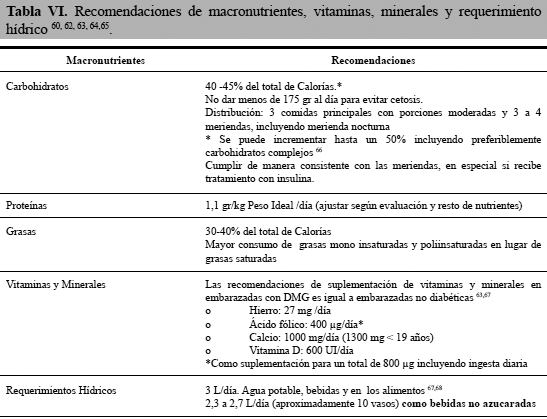
La terapia nutricional se enfoca principalmente en un plan de alimentación con control de carbohidratos, que promueva una adecuada nutrición, apropiada ganancia de peso, normoglucemia, y ausencia de cetosis 61. Esto incluye la cantidad de carbohidratos, el tipo de carbohidratos, la distribución durante el día, carbohidratos a la hora del desayuno, índice glucémico, fibra, y el uso de edulcorantes. El porcentaje de cada uno de estos macronutrientes debe ser considerado según evaluación individualizada tomando en cuenta las metas metabólicas, patrones de ingesta, disponibilidad y tratamiento farmacológico en caso que lo reciba 62. Lo recomendable es solicitar el apoyo de un experto en Nutrición como el Nutricionista como parte del equipo para la atención de la embarazada con DMG (Tabla V y VI) 60, 62-65.
RECOMENDACIONES NUTRICIONALES EN DIABETES MELLITUS GESTACIONAL
Estas recomendaciones nutricionales pueden ayudar a que la embarazada con Diabetes Gestacional culmine su embarazo de acuerdo a los objetivos metabólicos y nutricionales planteados.
Recomendaciones Generales: 60,62,69-71
- Es importante que durante el día, incluya alimentos de todos los grupos: vegetales y verduras, frutas, granos enteros, productos lácteos y carnes bajas en grasa.
- Llenar la mitad del plato de vegetales. Elegir una variedad, incluyendo vegetales verde oscuro, rojas, anaranjadas. En la otra mitad del plato coloque en una parte algún carbohidrato (almidón) como arroz o papas o verduras y la otra parte una porción de proteína como pollo sin piel, pescado o carne. Así estará cumpliendo con todos los grupos de alimentos.
-No realizar ayunos prolongados de más de 3 horas, particularmente si tiene indicado tratamiento con insulina.
-La alimentación diaria debe estar dividida en tres comidas principales y tres meriendas, estos son algunos ejemplos para la merienda:
· Media mañana: Fruta 1 porción (ver las recomendadas)
· Media Tarde: Yogurt natural o ligero ½ taza + almidón 1 porción (galletas soda/integral, cereal, granola sin azúcar)
· Antes de acostarse: Leche descremada y/o deslactosada ½ taza + almidón 1 porción (galletas soda/integral, cereal cocido).
-Es importante el consumo de agua diariamente, trate de consumir por lo menos de 8 a 10 vasos de agua al día. Otras bebidas que están permitidas sin el agregado de azúcar son: limonada, infusiones (manzanilla u otro a tolerancia), gelatina de hoja, agua de coco.
-Disminuir el consumo cafeína a 200 mg por día; esta se encuentra presente sobre todo en té, café, refrescos ligeros y chocolate. Limitar la ingesta de café a 1 taza al día.
-Preferiblemente que la mitad del consumo de sus carbohidratos diarios sea de granos enteros en lugar de granos refinados, como por ejemplo pan, cereales y galletas integrales, así como arepa con agregado de harina integral o afrecho, o linaza, por lo menos 4 o 5 veces a la semana. Diariamente puede incluir alguna opción de carbohidratos saludables como arroz, pasta integral, verduras o cereales, se recomiendan aproximadamente 8 a 10 porciones al día (1 porción es igual a ½ taza de arroz o granos o pasta o verdura (yuca, ñame, papa) o ¼ de unidad de plátano, 1 rebanada de pan integral o 1 arepa mediana).
-Consumir otros alimentos ricos en fibras como avena en hojuelas, cebada, salvado de trigo, granola o arroz integral.
-Escoger granos: caraotas, arvejas, garbanzos etc, de acuerdo a la tolerancia con más frecuencia (2 o 3 veces a la semana). Para mejorar la digestión de estos granos se recomienda mantenerlo en agua durante la noche y luego lavarlos, eliminando sustancias que producen gases.
-Seleccionar vegetales frescos (bien lavados), en lugar de cocidos. Consumir por lo menos 2 a 3 porciones al día, 1 porción de vegetales es igual a 1 taza de lechuga, tomate, pepino, acelgas, etc. o ½ taza de cebolla, auyama, zanahoria, remolacha (las dos últimas solo 2 veces a la semana).
-Evitar el consumo de bebidas endulzadas como: aguas saborizadas, bebidas deportivas (Gatorade), jugos de fruta pasteurizados, malta, chicha, bebidas carbonatadas regulares o ligeras (refrescos). Igualmente, evitar el uso del azúcar blanca o morena, miel, papelón o fructosa. No está permitido sirope, mermeladas, dulces, frutas preparadas en almíbar, postres (tortas, pies y otros dulces).
-Consumir las Frutas preferiblemente enteras, NO en forma de jugo. Se recomienda consumir aproximadamente 5 porciones al día de las frutas recomendadas 1 porción es igual a:
· Naranja, manzana, mandarina, guayaba, durazno: 1 unidad
· Lechosa, melón, patilla picada: 1 tajada mediana
· Fresas: 6 unidades grandes
· Mango: ½ unidad, piña: 1 rebanada, níspero: 1 unidad , cambur: ½ unidad o 1 cambur pequeño (solo 2 veces a la semana)
-Evitar el consumo de frituras. Preparar todos los alimentos horneados, al vapor, a la parrilla o a la plancha. Ser cuidadoso al añadir salsas.
-Escoger aceites saludables, como oliva, canola, girasol, maíz, soya, en pequeña cantidad para condimentar ensaladas y verduras. Para los vegetales también puede preparar aderezos con limón, mostaza, yogurt natural, sal y pimienta. Las ensaladas pueden prepararse con aceite de oliva, jugo de limón o vinagre, cilantro, perejil, célery, ajo y apio españa.
-Otras opciones de grasas saludables son el aguacate (1 rebanada delgada) y las semillas o frutos secos, las cuales se pueden sustituir una cucharadita de aceite o aguacate por 8 o 10 und de frutos secos (maní, avellanas, nueces, almendras).
-Se recomiendan preferiblemente las carnes rojas 2 veces a la semana, bajas en grasa (ganso, muchacho, pulpa negra, falda), pollo sin piel (preferir pechuga).
-Consumir pescado fresco 2 veces a la semana (máximo 120 g, 2 porciones de 60 g c/u a la semana); las sardinas, la trucha y el salmón son las más ricas en grasas omega 3. Puede consumir todos los tipos de pescado, pero limitar el atún blanco a 90 g a la semana y NO consumir blanquillo, cazón, pez espada, ni caballa, debido a que pueden contener altos niveles de mercurio, los cuales son perjudiciales para él bebé.
- Quesos recomendados bajos en grasa como requesón, mozzarella, queso blanco descremado blando.
-No agregar sal a los alimentos luego de cocidos. Recordar que existen alimentos procesados que tienen sal, como los enlatados, embutidos, alimentos curados, salsa, entre otros. Evitar los alimentos con alto contenido de sal como cubitos, sopas deshidratadas, especies preparadas con sal.
-En las mujeres embarazadas y madres lactantes se recomienda una ingesta adecuada de calcio. Su ingesta se puede cubrir con cuatro raciones diarias de lácteos (1 vaso de leche, 1 taza de yogurt natural, 1 o 2 rebanadas de queso o ¼ de taza de cuajada).
En caso de embarazos múltiples: Embarazo gemelar: Es conveniente agregar 450 cal al VCT, a partir del segundo trimestre y adecuar según la curva de peso. En embarazos de 3 ó más fetos se recomienda que el aporte extra de 450 cal al VCT se realice a partir del primer trimestre y hacer el seguimiento según la curva de peso materno y fetal.
RECOMENDACIONES DEL EJERCICIO EN DIABETES MELLITUS GESTACIONAL:
Está demostrado con estudios desde 1950 hasta la fecha, que el ejercicio durante el embarazo es seguro para la madre y el feto, tanto, que el Royal College of Obstetricians and Gynaecologists (RCOG) 72 y el American College of Obstetricians and Gynecologists (ACOG) recomiendan, en ausencia de contraindicaciones, promover el ejercicio durante el embarazo similar a la población general 73.
El ejercicio mejora la sensibilidad a la insulina, es especialmente importante durante el embarazo cuando está asociado a una ganancia excesiva de peso gestacional, principalmente durante el primer trimestre, y en obesidad. La mayoría de las mujeres siguen el sedentarismo o suspenden el ejercicio cuando se dan cuenta del embarazo, lo cual predispone al desarrollo de ciertas patologías como hipertensión arterial, preeclampsia, disnea, obesidad materna e infantil y diabetes mellitus gestacional (DMG). Aunque faltan ensayos clínicos controlados, un meta análisis reciente con 7 estudios de actividad física antes del embarazo, encontró un descenso de 67% de riesgo de desarrollar diabetes gestacional y 5 estudios con ejercicio iniciado temprano en la gestación, encontraron un descenso de 24% 73.
Además de los beneficios fisiológicos, psicológicos, metabólicos y de disminución de la morbimortalidad, la actividad física durante el embarazo mejora la capacidad de ejercicio medida por el consumo máximo de oxígeno de una manera similar al periodo preconcepcional. Además, tiene los siguientes beneficios para la madre: disminuye los calambres y el discomfort músculo esquelético, la lumbalgia, el edema, la depresión, la incontinencia urinaria, la constipación, la duración del trabajo de parto y el número de cesáreas; en el feto, disminuye la masa grasa, mejora la tolerancia al estrés y la maduración neuroconductual avanzada 74. Los ejercicios no isotónicos en los que predominaría la actividad de las extremidades superiores, serían los que menos afectarían al útero, con menor riesgo de desencadenar contracciones o de disminuir su oxigenación 75.
Objetivos obstétricos:
Fortalecimiento del piso pelviano o periné, fortalecimiento de oblicuos abdominales, trabajar la respiración controlada, trabajar la relajación controlada.
Características76:
Frecuencia: Es preferible realizar ejercicios regulares, por lo menos 3 veces por semana, que la actividad en forma irregular o de entrenamientos intensos aislados. Si la paciente no tiene entrenamiento previo, es recomendable que inicie el ejercicio en forma progresiva, hasta alcanzar un adecuado nivel. Antes de iniciar cualquier ejercicio es recomendable realizar técnicas de calentamiento.
Intensidad: La indicación de la intensidad del ejercicio es compleja durante la gestación, debido a que la frecuencia cardíaca en reposo es mayor y la frecuencia cardíaca máxima puede estar disminuida en el tercer trimestre de gestación. Por lo tanto, el uso de los modelos convencionales de frecuencia cardíaca para indicar la intensidad del ejercicio en mujeres no embarazadas es de poca utilidad durante la gestación. Un método práctico de control es la prueba del habla, la cual indica que la intensidad del ejercicio es excesiva si la paciente no puede mantener una conversación verbal durante la actividad física.
Duración: Las actividades aeróbicas de moderada intensidad se pueden mantener por períodos de hasta 30 minutos de duración. Aquellas actividades de baja intensidad se pueden realizar por períodos no mayores de 45 minutos para evitar la hipoglucemia. Las mujeres embarazadas deben detener el ejercicio cuando se sientan fatigadas y nunca ejercitarse hasta quedar exhaustas.
Temperatura corporal: La temperatura materna no debe exceder de 38,5 °C en el primer trimestre del embarazo, tomando en cuenta el posible efecto teratogénico cuando aumenta más de 39,2 °C. Debe utilizar ropa apropiada y entrenar en condiciones ambientales adecuadas para mejorar la disipación de calor. Debe ingerir abundantes líquidos antes y después del ejercicio y, si es necesario, interrumpir la actividad para reponer fluidos.
Ingesta calórica: Durante el embarazo, se requiere una ingesta de 300 kcal diarias adicionales para mantener la homeostasis metabólica, por lo que la mujer gestante que se ejercita debe ingerir una dieta adecuada. En la embarazada que hace ejercicio no son recomendables las dietas reductoras.
Recomendaciones Generales para la actividad física durante el embarazo 77,78:
· Incluya rutinas de calentamiento y enfriamiento para favorecer el control circulatorio.
· Programas de fortalecimiento muscular con particular enfoque en los músculos específicos prenatales como suelo pélvico y musculatura postural.
· Modificar ejercicios en posiciones supinas y de pie estacionaria por otras como cuadrúpeda, sentada en balón suizo y recostada de lado.
· El entrenamiento de flexibilidad debe limitarse a rangos de movimiento confortables, para evitar sobre estiramientos debido al incremento en laxitud de articulaciones y ligamentos durante el embarazo.
· Realizar sesiones de relajación a través de ejercicios respiratorios y técnicas de conexión cuerpo-mente.
· Realizar sesiones de ejercicios psicoprofilácticos (los más específicos para la labor de parto).
· Controlar de manera correcta la intensidad del ejercicio a medida que avanzan los trimestres de gestación.
· Modifique el programa de ejercicios cuando exista riesgos de termorregulación.
· En presencia de condiciones musculo esqueléticas patológicas (dolor o limitación de movimientos) relacionadas con el embarazo incluya ejercicios que mejoren o no compliquen los síntomas.
· Se debe evitar ejercicios de alto impacto, movimientos balísticos o bruscos. Cambios repentinos de intensidad y posiciones, cualquier ejercicio que involucre sostener el aliento conocido también como maniobra de Válsala y cualquier ejercicio que coloque presión excesiva en abdominales o suelo pélvico.
· Se pueden realizar ejercicios de resistencia utilizando pesos ligeros (2 a 5 kg) y repeticiones moderadas (8 a 12).
· Las condiciones que contraindican la realización de ejercicio durante el embarazo se resumen en la Tabla VII.
Tipos de ejercicios en diabetes gestacional 78-82 :
Entrenamiento Cardiovascular:
- Las actividades recomendadas para embarazadas incluyen caminatas, bicicleta estacionaria y actividades acuáticas.
- El equilibrio es un problema para las mujeres embarazadas debido al desplazamiento de su centro de gravedad y cambios en su propiocepción.
-Usar como parámetro de control de intensidad la percepción de esfuerzo físico entre suave a ligeramente fuerte.
-Las actividades acuáticas proveen beneficios cardiovasculares pero además permiten disipar el calor generado durante el ejercicio. El agua permite disminuir el estrés sobre articulaciones en especial columna vertebral, mejorando además la movilidad limitada en algunas fases del embarazo. Este ambiente causa un cambio centrípeto del volumen sanguíneo y una redistribución del fluido extravascular al espacio vascular.
Entrenamiento de Fuerza:
- Al diseñar una rutina de ejercicios de fuerza, se debe enfatizar en la musculatura de la zona media, que ayuda a contrarrestar el estrés lumbar y los síntomas del dolor crónico de espalda.
- Ejercicios isométricos de resistencia muscular de zona media son ideales para embarazadas debido a que mejoran la salud lumbar minimizando el estrés en la columna vertebral. Ejercicios dinámicos abdominales están restringidos en el primer trimestre.
- Realizar 2-3 sesiones de entrenamiento en circuitos de 8-10 ejercicios. Días no consecutivos.
- Realizar un ejercicio por grupo muscular, excepto la zona media donde se puede enfatizar con un máximo de tres. Estimular todos los planos de movimiento para mejorar la capacidad funcional propioceptiva.
- Principiantes: Una serie, 10-15 repeticiones. Intermedio-Avanzado: 2-3 series, 8-12 repeticiones.
- Todas las modalidades de entrenamiento de fuerza pueden ser empleadas: pesos libres, máquinas, ligas, cables, peso corporal.
- Evite ejercitarse en ayunas.
Yoga
- Se centra en la respiración, la relajación, la postura y la conciencia del propio cuerpo.
- Conviene elegir un programa diseñado para embarazadas.
- Disminuye la tensión y la ansiedad.
- Aumenta la resistencia, mejora la postura y el alineamiento, y reduce las molestias propias del embarazo.
Pilates
- Incrementa la tonicidad muscular.
- Refuerza y mejora la flexibilidad.
- Conviene elegir un programa diseñado para embarazadas.
Suspender la actividad cuando haya: Sangrado vaginal, mareos o vértigos, cefalea, dolor precordial, taquicardia, debilidad muscular, mialgias, edema en miembros inferiores, amenaza de parto prematuro, disminución de movimientos fetales, pérdida de líquido amniótico, disnea previa al ejercicio, falta de aliento.
TRATAMIENTO FARMACOLÓGICO DE LA DIABETES MELLITUS GESTACIONAL:
Cuando los objetivos glucémicos no se logran con 1-2 semanas de dieta y ejercicios, se recomienda el tratamiento farmacológico. Aproximadamente 15% de las pacientes con DM gestacional no cumplirán los objetivos glucémicos con las modificaciones del estilo de vida y requieren tratamiento con insulina o un agente hipoglucemiante oral 83.
La eficacia y seguridad de la insulina ha hecho que sea considerada el tratamiento estándar de la diabetes en el embarazo. La terapia con agentes orales, como glibenclamida y metformina, han estado ganando popularidad como tratamiento alternativo. Estudios han demostrado que estas dos drogas son efectivas y no han demostrado daño al feto, aunque todavía permanece preocupación por sus efectos a largo plazo 84.
El tratamiento con insulina puede ser inconveniente por la necesidad de múltiples dosis, costo, dolor por las inyecciones, auto monitoreo, refrigeración, condiciones que dificultan la adherencia al tratamiento 84. Estas consideraciones han llevado a buscar alternativas a la insulina en el tratamiento de la DM gestacional, como son los hipoglucemiantes orales.
HIPOGLUCEMIANTES ORALES:
Glibenclamida
Es una sulfonilurea de segunda generación, de las más usadas a nivel mundial en el tratamiento de la DM tipo 2. Su principal mecanismo de acción es el aumento de la secreción de insulina por las células β del páncreas 85,86. Está contraindicado en pacientes con alteración de la función renal y/o hepática. Estudios han demostrado que la glibenclamida (Clase B-FDA) es un fármaco tan eficaz como la insulina en el control de las pacientes con DM gestacional refractarias al régimen dietético. Existen en la literatura estudios clínicos que han evaluado el uso de glibenclamida durante el embarazo, no encontrándose diferencias significativas con respecto a la insulina en cuanto a malformaciones congénitas, vía del parto, incidencia de pre-eclampsia, frecuencia de macrosomía y mortalidad neonatal87,88. En los últimos años han aparecido estudios que demuestran que la glibenclamida atraviesa la barrera placentaria en cantidades insignificantes, esto debido a su gran afinidad por la albúmina materna. Igualmente la vida media del fármaco (4h) y su rápida eliminación, favorecen el escaso paso transplacentario 89,90.
La dosis de inicio es de 2,5 mg con el desayuno, si no se logra el control óptimo, se aumenta la dosis a 5 mg, pudiendo hacerse ajustes cada 3-7 días según amerite, se puede agregar una segunda dosis de 5 mg en la cena , hasta llegar a la dosis máxima de 20 mg al día. Si aun en dosis máxima no se alcanzan niveles óptimos debe indicarse insulina 91.
Metformina
Es una biguanidas de segunda generación, siendo el medicamento oral más usado para el control de pacientes con DM tipo 2. Su mecanismo de acción lo realiza aumentando la sensibilidad a la insulina y disminuyendo la resistencia a esta. Los efectos de la disminución de la glucemia se atribuyen, en parte, a la disminución de la secreción hepática de glucosa y a una mayor utilización de glucosa periférica por el músculo y tejido adiposo. Tiene una tasa de transferencia materno-fetal de 10-16% 92.
En diversos estudios se ha demostrado la seguridad de la metformina, pudiendo considerarse como el medicamento de primera elección para iniciar el tratamiento de la paciente con DM gestacional 93; tener presente que está contraindicado en pacientes con alteración de la función renal y/o hepática y en aquellas pacientes con problemas que puedan cursar con hipoxia, ya que se incrementa el riesgo de desarrollar acidosis láctica. La metformina es un medicamento Clase B para el uso en el embarazo de acuerdo a la FDA. Un 31-46,3% de las pacientes que usan metformina pueden requerir insulina para un adecuado control. Se debe considerar iniciar insulina en aquellas que no logran control con modificaciones del estilo de vida y dosis máxima de metformina. Con el uso conjunto de ambos fármacos se observa un menor requerimiento de insulina para el control y menor riesgo de hipoglucemia 94.
Es particularmente útil en las pacientes con sobrepeso u obesidad, ya que la ganancia de peso es menor cuando se compara con los otros medicamentos. Hay estudios que han demostrado la seguridad de la metformina en embarazadas con Síndrome de Ovarios Poliquísticos 95.
La efectividad del medicamento varía desde un 53% hasta un 90%. Los principales efectos adversos son gastrointestinales: diarrea, flatulencia, cólicos; estos con dosis iniciales bajas e incrementos progresivos pueden disminuirlo. También las preparaciones de larga duración pueden disminuir los efectos adversos. Solamente un 5 % de las pacientes suspenden el medicamento por los efectos secundarios. El riesgo de hipoglucemia es muy bajo y la incidencia de acidosis láctica ocurre en 0.03 casos por 1000 pacientes año 96.
Dosis de Metformina: Se debe iniciar en aquellas pacientes que no logran control metabólico con dieta y ejercicio, en dosis de 500- 850 mg con la comida más importante, con incrementos semanales, en dosis divididas en 1-3 tomas al día, preferiblemente con las comidas, hasta alcanzar el control metabólico. Los incrementos deben realizarse semanalmente para así disminuir los riesgos de efectos secundarios hasta alcanzar la dosis máxima de 2000- 2500 mg/día 96.
Se requieren estudios de seguimiento a largo plazo de recién nacidos de madres tratadas con metformina para así observar si existen defectos en el crecimiento, desarrollo motor o social de estos niños.
TRATAMIENTO CON INSULINA:
La insulina ha sido considerada como el estándar de oro para el tratamiento de la DM gestacional cuando fallan las modificaciones del estilo de vida. La insulina no cruza la barrera placentaria y ha demostrado su eficacia para alcanzar y mantener un buen control glucémico 97-99.
Existen algunos factores de predicción de insulinoterapia en pacientes con DMG como son: historia familiar de diabetes, obesidad previa al embarazo, glucemia en ayunas > 105 mg/dL. En un estudio multicéntrico, aleatorizado, controlado 100, el tratamiento con insulina se indicó si la mayoría de los valores de glucemia en ayunas o postprandial estuvieron elevados: glucemia en ayunas ≥95 mg/dL o glucosa postprandial (2 horas) ≥120 mg/dl. Una circunferencia abdominal fetal por encima del percentil 70 puede también indicar la necesidad de tratamiento con insulina para lograr el control glucémico 101.
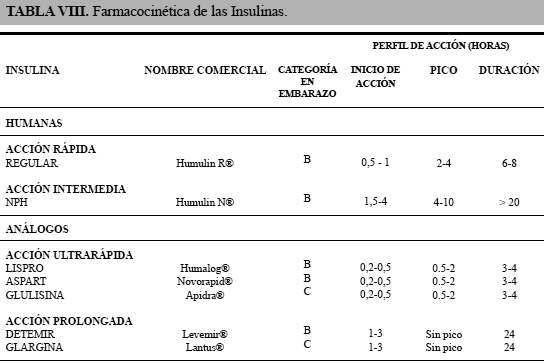
La farmacocinética y categoría de las insulinas en el embarazo se describe en la Tabla VIII102. Todas las insulinas tienen categoría B menos glulisina y glargina que tienen categoría C 103-105. Los nuevos análogos de insulina presentan ventajas en reducir el riesgo de hipoglucemia, sobre todo durante la noche, promoviendo un perfil glucémico más fisiológico en las mujeres embarazadas con diabetes 103. La insulina detemir es segura y comparable a la insulina NPH durante el embarazo, siendo superior en la reducción de la glucosa plasmática en ayunas 104. Los estudios apoyan el uso de insulina detemir como la primera opción de insulina de acción prolongada durante el embarazo, siendo el único análogo basal aprobada por la FDA hasta la actualidad 105. Los análogos de insulina de acción rápida (lispro y aspart) son eficaces en reducir la glucosa postprandial con menor riesgo de hipoglucemia comparados con la insulina regular (cristalina).
Recomendaciones para el uso de insulina en el embarazo 106:
1. Uso del análogo de insulina de acción prolongada detemir para las pacientes que requieren insulina basal y en las que se plantee que la insulina NPH puede ocasionar hipoglucemia.
2. Los análogos de insulina de acción rápida (lispro o aspart: clase B FDA) son preferibles al uso de insulina regular, ya que permiten alcanzar metas post-prandiales con menor probabilidad de hipoglucemia.
3. No se recomienda iniciar infusión continua de insulina durante el embarazo a menos que otras estrategias incluyendo múltiples dosis diarias de insulina sean ineficaces.
4. Se sugiere monitorización continua de la glucosa cuando los niveles de glucosa autosupervisados no son suficientes para evaluar el control de la glucemia (incluyendo tanto la hiperglucemia como la hipoglucemia).
La dosificación de la insulina está basada en el peso de la paciente, semana de embarazo en la que se presenta, así como los valores de glucemia pre y post-prandial. La insulina se dosifica de acuerdo con el peso corporal, entre 0.7-1.0 Unidades/kg 107.
Con el avance de la edad gestacional, la paciente se vuelve más resistente a la insulina y aumentan las necesidades de la misma. Entre las 20 a 32 semanas hay un incremento de hasta el 50% de la dosis inicial de insulina. La dosis en el primer trimestre es de 0,7 unidades/kg, en el segundo trimestre de 0,8 unidades/kg, y a lo largo del tercer trimestre de 0,9-1 unidades/kg 108. El cálculo de la dosificación de insulina se describe en la Tabla IX. Se recomienda que las pacientes con DMG que requieran tratamiento con insulina deben ser evaluadas y controladas por especialistas, para una adecuada dosificación y ajuste de dicho esquema.
Vía del parto:
Se decide bajo las mismas premisas que en la no diabética. El parto vaginal no se recomienda en fetos con peso estimado ≥ a 4000 g, en razón de ser partos distócicos donde se puede presentar distocia de hombros que tiene una morbilidad perinatal elevada. En pacientes bien controladas, que se mantienen con cifras de euglucemia, la resolución se realiza preferiblemente después de las 39 semanas para garantizar la madurez fetal. Se debe informar a neonatología por las posibles complicaciones que pueda presentar el recién nacido 108.
Durante el parto:
El mantenimiento de la homeostasis metabólica durante el parto optimiza la transición postnatal del recién nacido reduciendo el riesgo de hiperinsulinemia neonatal e hipoglucemia subsecuente. El uso de una combinación de infusión de insulina e infusión de glucosa durante el parto para mantener una glucemia en un rango entre 80-110 mg/dL es una práctica común y clínicamente eficiente. Para las mujeres tratadas con dieta, se recomienda una infusión intravenosa de solución salina a una velocidad de 100 a 150 ml/h y un control periódico de la glucosa 109. La Sociedad de Endocrinología sugiere como objetivo valores de glucemia entre 72 a 126 mg/dL durante el parto para mujeres embarazadas con diabetes gestacional 106. Las tasas recomendadas son: insulina regular intravenosa a 0,5 – 1 U/h y solución dextrosa al 5% a 100 ml/h. Se deben realizar controles de glucemia capilar horaria en estas pacientes para ajustar la velocidad de infusión de la insulina con el fin de obtener las metas de glucemia 56.
En las Tablas X y XI se describe el manejo de la paciente embarazada durante el trabajo de parto o cesárea, respectivamente. No es recomendable administrar cantidades elevadas o bolos de glucosa, por el peligro de hipoxia fetal, acidosis fetal o neonatal e hipoglucemia neonatal. El monitoreo de la glucemia debe hacerse más frecuente de continuar con la insulina durante la lactancia.

MANEJO POSTPARTO Y RECOMENDACIONES GENERALES
Al término del embarazo:
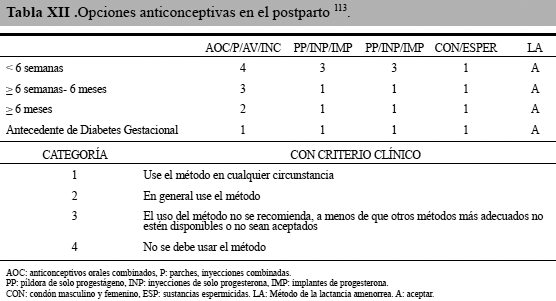
No se debe olvidar la consulta post parto donde las recomendaciones del control de la natalidad debe realizarse con métodos que no afecten el metabolismo de la glucosa como son píldora de progestágenos, implantes o dispositivos intrauterinos, y si no se desean más hijos, la esterilización quirúrgica post parto o durante la cesárea será lo más indicado110. Pocos trabajos se han descrito con anticonceptivos orales en poblaciones de pacientes que tuvieron diabetes gestacional previa 111. Estudios con dosis bajas de anticonceptivos orales combinados han encontrado una incidencia acumulada de DM2 similar a la de pacientes usando métodos no hormonales 112.
Criterios médicos de elegibilidad para uso de Anticonceptivos: El cuadro siguiente muestra las opciones anticonceptivas temporales a utilizar en el postparto y en aquellos pacientes con antecedente de DMG (Tabla XII)113.
Las mujeres con antecedente de DMG tienen que continuar en control a las 6 y 12 semanas después del parto y hasta los 3 años 114. En las mujeres con antecedente de DMG que continuaron con cambios en el estilo de vida y redujeron su peso, la prevalencia de DM2 es menor que su par que no lograron bajar de peso 115. De 3 a 5 mujeres con antecedente de DMG que son intervenidas con metformina y cambios en el estilo de vida pueden disminuir la presentación de DM2 a 3 años 116,117. A las 4 a 6 semanas post parto se le indicará una curva de tolerancia glucosada con 75 g, para su clasificación en normal, prediabetes (glucemia ayunas alterada o intolerancia glucosada) o diabetes mellitus tipo 1 o 2 (Tabla XIII) 1,45,56.
Durante el puerperio persisten los cambios cardiovasculares y musculo esqueléticos, los cuales se comienzan a revertir lentamente y requieren de un período de hasta tres meses para alcanzar su estado normal. Las rutinas de ejercicio que realizaba la paciente antes del embarazo se pueden iniciar gradualmente con base en la capacidad física de la mujer. Se debe tomar en cuenta la forma de nacimiento para decidir cuándo comenzar y qué tipo de ejercicio puede realizar. Si el parto fue vaginal tiene menos limitaciones que si fue por cesárea y la actividad física se puede comenzar a las 2-3 semanas. Las atletas que se han mantenido entrenadas durante el embarazo y no han presentado complicaciones durante el parto, pueden reiniciar su entrenamiento a las 2 semanas postparto. La cesárea tiene más limitaciones por la cicatriz abdominal, así la actividad física se puede comenzar libremente a las 3 semanas, pero los ejercicios de moderada y gran intensidad deben comenzar más tarde, sobre todo los abdominales 56, 113.
La lactancia materna posee beneficios metabólicos en mujeres con DMG114,115. Incentivar la lactancia materna, el asesoramiento nutricional y un plan de ejercicio para evitar re ganancias de peso y logro de un peso saludable 118,119.
CONCLUSIÓN
Con el incremento de la obesidad se hace indispensable una evaluación preconcepcional para prevenir la DMG. Si esto no ha sido posible debe realizarse una evaluación para su detección temprana, y en caso de presentarse DMG, la paciente debe ser evaluada por un equipo multidisciplinario con el objetivo de disminuir todas las comorbilidades materno-fetales. Es necesario un programa de educación a la comunidad en cambios de estilo de vida, basado en una dieta saludable y ejercicio. Los anexos que presentamos son con el objeto de facilitar el trabajo de este equipo y tratar de tener una mejor casuística de nuestra población.
AGRADECIMIENTO
Este Manual se llevó a cabo con el apoyo irrestricto de Novo Nordisk Venezuela-Casa Representación C.A.
REFERENCIAS BIBLIOGRÁFICAS
1. Endocrine Society. Diabetes and pregnancy: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2013,98:4227-4249. [ Links ]
2. HAPO Study Cooperative Research Group, Metzger BE, Lowe LP, Dyer AR, Trimble ER, Chaovarindr U, Coustan DR, Hadden DR, McCance DR, Hod M, McIntyre HD, Oats JJ, Persson B, Rogers MS, Sacks DA. Hyperglycemia and adverse pregnancy outcomes. N Engl J Med 2008;358:1991-2002. [ Links ]
3. Bennewitz HG. De diabete mellito gravidatatis symptomate. MD Thesis. University of Berlin. 1824. [ Links ]
4. Carrington ER, Shuman CR, Reardon HS. Evaluation of the prediabetic state during pregnancy. Obstet Gynecol 1957;9:664-669. [ Links ]
5. Reveno WB. Insulin in diabetic coma complicating pregnancy. JAMA 1923;81: 2101-2102. [ Links ]
6. Graham G. A case of diabetes mellitus complicating pregnancy treatment with insulin. Proc Roy Soc Med 1924;XVII:102-104. [ Links ]
7. O'Sullivan J, Mahan C. Criteria for the oral glucose tolerance test in pregnancy. Diabetes 1964;13:278-285. [ Links ]
8. OSullivan JB, Maham CM, Charles D, Dandrow R. Screening criteria for high-risk gestational diabetic patients. Am J Obstet Gynecol 1973;116:895-900 (level II-2) [ Links ]
9. Gabbe S, Mestman J, Freeman R, Anderson G, Lowensohn R. Management and outcome of class A diabetes mellitus. Am J Obstet Gynecol 1977;127:465- 469. [ Links ]
10. National Diabetes Data Group. Classification and diagnosis of diabetes mellitus and other categories of glucose intolerance. Diabetes 1979;28:1039-1057. [ Links ]
11. Langer O. The significance of one abnormal glucose tolerant test value on adverse outcome in pregnancy. Am J Obstet Gynecol 1987;157:758-763. [ Links ]
12. Langer O, Conway D, Berkus M, Xenekis E, Gonzales O. A comparison of glyburide and insulin in women with gestational diabetes. N Engl J Med 2000;343: 1134-1138. [ Links ]
13. Crowther C, Hiller JE, Moss JR, McPhee JA, Jeffries WS, Robinson JS. Effect of treatment of gestational diabetes mellitus on pregnancy outcomes, for the Australian Carbohydrate Intolerance Study in Pregnant Women (ACHOIS) Trial Group. N Eng J Med 2005;352:2477-2486. [ Links ]
14. Materno- Fetal Medicine Unit (MFMU). N Eng J Med 2009;361:1139-1148. [ Links ]
15. International Association of Diabetes and Pregnancy Study Groups Consensus Panel. Recommendations on the diagnosis and classification of hyperglycemia in pregnancy. Diabetes Care 2010;33:676-682. [ Links ]
16. Febres Balestrini F, Zimmer E, Guerra C. New concept in gestational diabetes mellitus: prospective evaluation of 3.070 pregnancy woman. Rev Obstet Ginecol Venez 2000;60:229-236. [ Links ]
17. Quintana M, Rodríguez D, Rodríguez R, Parra N. Incidencia de diabetes gestacional en los municipios San Felipe, Independencia y Cocorote. Edo Yaracuy Enero 2002- Diciembre 2003. Boletin Médico de Postgrado. Vol XXI, número 1. Enero- Marzo de 2005. UCLA. Decanato de Medicina. Barquisimeto. Venezuela [ Links ]
18. Richardson A, Carpenter M. Inflammatory Mediators in Gestational Diabetes Mellitus. Obstet Gynecol Clin N Am 2007;34:213–224. [ Links ]
19. Campo MN, Posada G. Factores de riesgo para diabetes gestacional en población obstétrica. Rev CES Med 2008;22: 59-69. [ Links ]
20. Di Cianni G, Miccoli R, Volpe L, Lencioni C, Del Prato S. Intermediate metabolism in normal pregnancy and in gestational diabetes. Diabetes Metab Res Rev 2003;19:259-270. [ Links ]
21. García C. Diabetes Mellitus Gestacional. Med Int Mex 2008;24:148-156. [ Links ]
22. Bozkurt L, Göbl C, Pfligl L, Leitner K, Bancher-Todesca D, Luger A, Baumgartner-Parzer S, Pacini G, Kautzky-Willer A. Pathophysiological characteristics and effects of obesity in women with early and late manifestation of gestational diabetes diagnosed by the International Association of Diabetes and Pregnancy Study Groups Criteria. J Clin Endocrinol Metab 2015;100:1113–1120. [ Links ]
23. Lehnen H, Zechner U, Haaf T. Epigenetics of gestational diabetes mellitus and offspring health: the time for action is in early stages of life. Mol Hum Reprod 2013; 19:415-422. [ Links ]
24. Shleithoff C, Voelter-Mahlknecht S, Dahmke IN, Mahlknecht U. On the epigenetics of vascular regulation and disease. Clin Epigenetics 2012;23:1-13. [ Links ]
25. Van Lieshout RJ, Voruganti LP. Diabetes mellitus in offspring. J Psychiatry Neurosci 2008;33:395-404. [ Links ]
26. Smith CJ, Ryckman KK. Epigenetic and developmental influences on the risk of obesity, diabetes, and metabolic syndrome. See comment in PubMed Commons below. Diabetes Metab Syndr Obes 2015;8:295-302. [ Links ]
27. Lo CL, Zhou FC. Environmental alterations of epigenetics prior to the birth. Int Rev Neurobiol 2014;115:1-49. [ Links ]
28. Vickers MH. Early life nutrition, epigenetics and programming of later life disease. Nutrients 2014;6:2165-2178. [ Links ]
29. Simmons D. Prevention of gestational diabetes mellitus: Where are we now? Diabetes Obes Metab 2015;17:824-834. [ Links ]
30. Isolauri E, Rautava S, Collado MC, Salminen S. Role of probiotics in reducing the risk of gestational diabetes. Diabetes Obes Metab 2015;17:713-719. [ Links ]
31. Febres F, Palacios A, Colán J, Arias E. Nueva pesquisa de consenso de la diabetes gestacional, en función del futuro inmediato y a largo plazo del recién nacido. Rev Obstet Ginecol Venez 2014;74:138-142. [ Links ]
32. Hedderson MM, Williams MA, Holt VL, Weiss NS, Ferrara A. Body mass index and weight gain prior to pregnancy and risk of gestational diabetes mellitus. Am J Obstet Gynecol 2008;198:409.e1-409.e7. [ Links ]
33. Poston L, Harthoorn LF, Van Der Beek EM, On Behalf of Contributors To The ILSI Europe Workshop. Obesity in pregnancy: implications for the mother and lifelong health of the child. A consensus statement. Pediatr Res 2011;69:175-80. [ Links ]
34. Simmons D. Diabetes and obesity in pregnancy. Best Pract Res Clin Obstet Gynecol 2011;25:25-36. [ Links ]
35. Lim Ch, Mahmood T. Obesity in pregnancy. Best Pract Res Clin Obstet Gynaecol 2015;29:309-319. [ Links ]
36. Huidobro A, Fulford A, Carrasco E. Incidencia de diabetes gestacional y su relación con obesidad en embarazadas chilenas. Rev Méd Chile 2004;132:931- 938. [ Links ]
37. American Diabetes Association. Standards of medical care in diabetes. Diabetes Care 2013;36(Suppl 1):S11– S66. [ Links ]
38. Wei J, Gao J, Cheng J. Gestational diabetes mellitus and impaired glucose tolerance in pregnant women. Pak J Med Sci 2014;30:1203-1208. [ Links ]
39. Kashanian M, Fazy Z, Pirak A. Evaluation of the relationship between gestational diabetes and a history of polycystic ovarian syndrome. Diabetes Res Clin Pract 2008;80:289-292. [ Links ]
40. Katulski K, Czyzyk A, Podfigurna-Stopa A, Genazzani A, Meczekalski B. Pregnancy complications in polycystic ovary syndrome patients. Gynecol Endocrinol 2015;31:87-91. [ Links ]
41. de Wilde MA, Veltman-Verhulst SM, Goverde AJ, Lambalk CB, Laven JS, Franx A, Koster MP, Eijkemans MJ, Fauser BC. Preconception predictors of gestational diabetes: a multicentre prospective cohort study on the predominant complication of pregnancy in polycystic ovary syndrome. Hum Reprod 2014;29:1327-1336. [ Links ]
42. American Diabetes Association. Standards of medical care in diabetes. Diabetes Care 2015;38 (suppl 1):S1- S93. [ Links ]
43. NICE Guidelines Diabetes in Pregnancy: management of diabetes and its complications from 2015. Preconception to the postnatal period. nice.org.uk/guidance/ng [ Links ]
44. Metzger BE, Buchanan TA, Coustan, De Leiva A, Dunger DB, Hadden DR, Hod M, Kitzmiller JL, Kios SL, Oats JM, Pettit DJ, Sacks DA, Zoupas C. Summary and recommendations of the Fifth International Workshop-Conference on Gestational Diabetes Mellitus. Diabetes Care 2007;30(Suppl 2):S251–S260. [ Links ]
45. Asociación Latinoamericana de Diabetes (ALAD). Consenso Latinoamericano de Diabetes y Embarazo. La Habana, Cuba 2007. Accesado en Octubre 2015. Disponible en http://www.alad-latinoamerica.org/DOCConsenso/DIABETES%20Y%20EMBARAZO.pdf [ Links ]
46. Jensen DM, Korsholm L, Ovesen P. Peri-conceptional A1C and risk of serious adverse pregnancy outcome in 933 women with type 1 diabetes. Diabetes Care 2009; 32:1046– 1048. [ Links ]
47. American College of Obstetricians and Gynecologists (ACOG). Practice Bulletin No 30: Gestational Diabetes. Obstet Gynecol 2001;98:525-538. [ Links ]
48. National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Report of the National High Blood Pressure Education Program Working Group on High Blood Pressure in Pregnancy. Am J Obstet Gynecol 2000;183:S1-S22. [ Links ]
49. American College of Obstetricians and Gynecologists, Task Force on Hypertension in Pregnancy. Hypertension in Pregnancy. Report of the American College of Obstetricians and Gynecologists Task Force on Hypertension in Pregnancy. Obstet Gynecol 2013:122:1122-1131. [ Links ]
50. Bond MJ, Umans JG. Microvascular complications and the diabetic pregnancy. Curr Diab Rep 2006;6:291- 296. [ Links ]
51. Lykke JA, Langhoff-Roos J, Sibai BM, Funai EF, Triche EW, Paidas MJ. Hypertensive pregnancy disorders and subsequent cardiovascular morbidity and type 2 diabetes mellitus in the mother. Hypertension 2009;53:944-951. [ Links ]
52. Seely EW, Solomon CG. Insulin resistance and its potential role in pregnancy-induced hypertension. J Clin Endocrinol Metab 2003;88:2393-2398. [ Links ]
53. Sanders R, Winter T. Clinical Sonography: A Practical Guide 2006. Hagerstown, Lippincott Williams & Wilkins. Fourth Edition. p502 [ Links ]
54. Grivell RM, Alfirevic Z, Gyte GML, Devane D. Antenatal cardiotocography for fetal assessment. Cochrane Database Syst Rev 2010. [ Links ]
55. Ashwood ER, Palmer Se, Taylor JS, Pingree SS. Lamellar body counts for rapid fetal lung maturity testing. Obstet Gynecol 1993;81:619-624. [ Links ]
56. Boulvain M, Stan C, Irion O. Elective delivery in diabetic pregnant women. Cochrane Database Syst Rev 2001. [ Links ]
57. Lima-Martínez, Villalobos M, Aguirre M, Uzcátegui L, Paoli M. Manejo de la diabetes gestacional. Protocolo del Servicio de Endocrinología del Instituto Autónomo Hospital Universitario de Los Andes. Rev Venez Endocrinol Metab 2012;10: 88-93. [ Links ]
58. Reader D, Splett P, Gunderson EP; Diabetes Care and Education Dietetic Practice Group. Impact of gestational diabetes mellitus nutrition practice guidelines implemented by registered dietitians on pregnancy outcomes. J Am Diet Assoc 2006;106:1426-1433. [ Links ]
59. Rasmussen KM, Yaktine AL, Institute of Medicine (US) and National Research Council (US) Committee to Reexamine IOM Pregnancy Weight Guidelines. Weight gain during pregnancy: reexamining the Guidelines. Washington (DC National Academies Press (US); 2009. [ Links ]
60. Atajah E. Propuesta de un nuevo estándar de evaluación nutricional en embarazadas. Rev Méd Chile 1997;125:1429-1436. [ Links ]
61. Institute of Medicine of de National Academies. Dietary reference intakes for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein, and amino acids (macronutrients). Washington DC. National Academies Press (US) 2002. [ Links ]
62. Reader D. Medical nutrition therapy and lifestyle interventions. Diabetes Care, 2007;30(Suppl.2):S188-193. [ Links ]
63. Evert A, Boucher J, Cypress M, Dunbar S, Franz M, Mayer-Davis E, Neumiller JJ, Nwankwo R, Verdi CL, Urbanski P, Yancy WS Jr. Nutrition therapy recommendations for the management of adults with diabetes. Diabetes Care 2014;37:S121-S143. [ Links ]
64. Joslin Diabetes Center and Joslin Clinic. Guideline for detection and management of diabetes in pregnancy. Accesado en Agosto 2015. Disponible en: www.joslin.org/bin_from_cms/Preg_guideline..pdf [ Links ]
65. Academy of Nutrition and Dietetics. Diagnosing and managing gestational diabetes: when do we stand? Journal of the Academic of Nutrition and Dietetics 2013. Accesado en Agosto 2015. Disponible en http://www.andjrnl.org/article/S2212.pdf [ Links ]
66. Marcason W. American Dietetic Association. What is the appropriate amount and distribution of carbohydrates for a woman diagnosed with gestational diabetes mellitus? Journal of the American Dietetic Association.2005; 1673. [ Links ]
67. Hernandez T, Anderson M, Chartier-Logan C, Friedman J, Barbour L. Strategies in the nutritional management of gestational diabetes. Clin Obstet Gynecol 2013; 56: 803–815. [ Links ]
68. Academy of Nutrition and Dietetics. Position of the Academy of Nutrition and Dietetics: Nutrition and lifestyle for a healthy pregnancy outcome. J Acad Nutr Diet 2014;114:1099-1103. [ Links ]
69. Figueroa-Damián R, Beltrán-Montoya S, Reyes E, Segura E. Consumo de agua en el embarazo y lactancia. Perinatol Reprod Hum 2013;27(Supl 1):S24-S30. [ Links ]
70. Moses R, Barker M, Winter M, Petocz P, Brand-Miller J. Gestational diabetes; can a low glycemic index diet reduce the need for insulin? A Randomised Trial. Diabetes Care 2009;32:996–1000. [ Links ]
71. Louie JC, Markovic TP, Ross GP, Foote D, Brand-Miller JC. Timing of peak blood glucose after breakfast meals of different glycemic index in women with gestational diabetes. Nutrients 2012;5:1-9. [ Links ]
72. Royal College of Obstetricians and Gynaecologists (RCOG). 2006. Exercise in pregnancy. RCOG Statement No. 4. January 2006, 1-7. [ Links ]
73. Artal R, OToole M. Guidelines of the American College of Obstetricians and Gynecologists for exercise during pregnancy and the postpartum period. Br J Sports Med 2003;37:6-12. [ Links ]
74. Charlesworth S, Foulds HJ, Burr JF, Bredin SS. Evidence-based risk assessment and recommendations for physical activity clearance: pregnancy. Appl Physiol Nutr Metab 2011;36 Suppl 1:S33-48. [ Links ]
75. Tobias DK, Zhang C, van Dam RM, Bowers K, Hu FB. Physical activity before and during pregnancy and risk of gestational diabetes mellitus: a meta-analysis. Diabetes Care 2011;34:223-9. [ Links ]
76. Zavorsky GS, Longo LD. Exercise guidelines in pregnancy: new perspectives. Sports Med 2011;41:345- 60. [ Links ]
77. Márquez JJ, García V, Ardila R. Ejercicio y prevención de obesidad y diabetes mellitus gestacional. Rev Chil Obstet Ginecol 2012;77: 401-406. [ Links ]
78. Mata F, Chulvi L, Roig J, Heredia E, Isidro F, Benítez Sillero JD, Guillén del Castillo M. Prescripción del ejercicio físico durante el embarazo. Rev Andal Med Deporte 2010;3:68-79. [ Links ]
79. Pruett MD, Caputo JL. Exercise guidelines for pregnant and postpartum women. Strength Cond J 2011;33:100- 103. [ Links ]
80. Schoenfeld B. Resistance training during pregnancy: safe and effective program design. Strength Cond J 2011;33:67-75. [ Links ]
81. Martens DL, Hernandez B, Strickland G. Pregnancy and exercise: physiological changes and effects on the mother and fetus. Strength Cond J 2006;28:78-82. [ Links ]
82. Piper TJ, Jacobs E, Haiduke M. Core training exercise selection during pregnancy. Strength Cond J 2012;34:55-62. [ Links ]
83. Nicholson W, Baptiste-Roberts K. Oral hypoglycemic agents during pregnancy: the evidence for effectiveness and safety. Best Prac Res Clin Obstet Gynecol 2011;25: 51-63. [ Links ]
84. Reece EA, Homko C, Miodovnik M, Langer O. A consensus report of the diabetes in Pregnancy Study Group of North America Conference, Little Rock, Arkansas, May 2002. J Matern Fetal Neonatal Med 2002;12:362-364. [ Links ]
85. Garcia-Bournisen F, Feig DS, Koren G. Maternal fetal transport of hypoglycemic drugs. Clin Pharmacokinetics 2003;42:303-313. [ Links ]
86. Notelowitz M. Sulphonylurea therapy in the treatment of pregnant diabetics. S Afric Med J 1971;45:226-229. [ Links ]
87. Groop L, Luzi L, Melander A, Groop PH, Ratheiser K, Simonson DC, DeFronzo RA. Different effects of glyburide and glypizide on insulin secretion and hepatic glucose production in normal and NIDDM subjects. Diabetes 1987;36:1320-1328. [ Links ]
88. Langer O, Conway DL, Berkus MD, Xenakis EM, Gonzales O. A comparison of glyburide and insulin in women with gestational diabetes mellitus. N Eng J Med 2000;343:1134-1138. [ Links ]
89. Jacobson GF, Ramos GA, Ching JY, Kirby RS, Ferrara A, Field DR. Comparison of glyburide and insulin for the management of gestational diabetes in a large managed care organization. Am J Obstet Gynecol 2005;193:118-124. [ Links ]
90. Elliott BD, Langer O, Schenker S, Johnson RF. Insignificant transfer of glyburide occurs across the human placenta. Am J Obstet Gynecol 1991;165:807- 812. [ Links ]
91. Koben G. Glyburide and fetal safety, transplacental pharmacokinetic considerations. Reprod Toxicol 2001;15:227-229. [ Links ]
92. García-Herrera E. Actualización sobre el uso de hipoglicemiantes orales para el tratamiento farmacológico en diabetes mellitus gestacional. Rev Méd Costa Rica Centroamérica 2014;610:225-29. [ Links ]
93. McCarthy EA, Walker SP, McLachlan K, Boyle J, Permezel M. Metformin in obstetrics and gynecology practice: A review. Obstet Gyn Surv 2004;59:118-123. [ Links ]
94. Langer O. Oral antihyperglycemic agents for the management of gestational diabetes mellitus. Obstet Gynecol Clin North Am 2007;34:255-274. [ Links ]
95. Langer O. Management of gestational diabetes pharmacologic treatment options and glycemic control. Endocrinol Metab Clin North Am 2006;35:53-78. [ Links ]
96. Glueck CJ, Wang P, Kobayashi S, Phillips H, Sieve-Smith L. Metformin therapy throughout pregnancy reduces de development of gestational diabetes in women with Polycystic Ovarian Syndrome. Fert Steril 2002;77;34:255-274. [ Links ]
97. Briggs GC, Yaffe ST, Freeman RK. Drugs in pregnancy and lactation: A referential guide to fetal and neonatal risks. Lippincott Williams Wilkins. 2005; 687-90. [ Links ]
98. Homko CJ, Sivan E, Reece AE. Is there a role for oral antihyperglycemics in gestational diabetes and type 2 diabetes during pregnancy? Treat Endocrinol 2004; 3:133-139. [ Links ]
99. Sapienza A, Vieira R, Coutheux T, Zubaib M. Factors predicting the need for insulin therapy in patients with gestational diabetes mellitus. Diabetes Res Clin Pract 2010;88:81-86. [ Links ]
100. Pérez O, Saba T, Padrón M, Molina R. Diabetes mellitus gestacional. Rev Venez Endocrinol Metab 2012;10 (Supl 1):22-33. [ Links ]
101. Landon MB, Spong CY, Thom E, Carpenter MW, Ramin SM, Casey B, Wapner RJ, Varner MW, Rouse DJ, Thorp JM Jr, Sciscione A, Catalano P, Harper M, Saade G, Lain KY, Sorokin Y, Peaceman AM, Tolosa JE, Anderson GB, Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. A multicenter, randomized trial of treatment for mild gestational diabetes. N Engl J Med 2009;361:1339-1348. [ Links ]
102. Kjos SJ, Schaefer-Graf UM. Modified therapy for gestational diabetes using high-risk and low-risk fetal abdominal circumference growth to select strict versus relaxed maternal glycemic targets. Diabetes Care 2007;30(Suppl. 2):S200-S205. [ Links ]
103. Borgoño CA, Zinman B. Insulins: Past, Present, and Future. Endocrinol Metab Clin N Am 2012;41:1-24. [ Links ]
104. Magon N, Seshiah V. Gestational diabetes mellitus: insulinic management. J Obstet Gynaecol India. 2014;64:82-90. [ Links ]
105. Mathiesen ER, Hod M, Ivanisevic M, Duran Garcia S, Brøndsted L, Jovanovic L. Maternal efficacy and safety outcomes in a randomized, controlled trial comparing insulin detemir with NPH insulin in 310 pregnant women with type 1 diabetes. Diabetes Care 2012;35:2012-2017. [ Links ]
106. Blumer I, Hadar E, Hadden D, Jovanovic L, Mestman JH, Murad MH, Yogev Y. Diabetes and Pregnancy: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2013;98:4227-4249. [ Links ]
107. Hone J, Jovanovic L. Approach to the patient with diabetes during pregnancy. J Clin Endocrinol Metab 2010;95:3578-3585. [ Links ]
108. Lambert K, Holt RI. The use of insulin analogues in pregnancy. Diabetes Obes Metab 2013;15:888-900. [ Links ]
109. Ashwal E, Hod M. Gestational diabetes mellitus: Where are we now? Clin Chim Acta 2015;451:14-20. [ Links ]
110. Moore TR. Diabetes mellitus and pregnancy. 2014. Accesado en Agosto 2015. Disponible en: http://emedicine.medscape.com/article/127547-overview. [ Links ]
111. Beydoun HA, Beydoun MA, Tamim H. How does gestational diabetes affect postpartum contraception in nondiabetic primiparous women? Contraception 2009;79:290–296. [ Links ]
112. Kjos SL, Peters RK, Xiang A, Thomas D, Schaefer U, Buchanan TA. Contraception and the risk of type 2 diabetes mellitus in latina women with prior gestational diabetes mellitus. JAMA 1998;280:533-538. [ Links ]
113. Organización Mundial de la Salud. Criterios médicos de elegibilidad para el uso de anticonceptivos. 4ta Edición 2012. Accesado en Septiembre 2015. Disponible en: http://apps.who.int/iris/bitstream/10665/44710/1/9789243563886_spa.pdf. [ Links ]
114. Kim C, Newton KM, Knopp RH. Gestational diabetes and the incidence of type 2 diabetes: a systematic review. Diabetes Care 2002;25:1862–1868. [ Links ]
115. Tobias DK, Hu FB, Chavarro J, Rosner B, Mozaffarian D, Zhang C. Healthful dietary patterns and type 2 diabetes mellitus risk among women with a history of gestational diabetes mellitus. Arch Intern Med 2012;172:1566–1572. [ Links ]
116. Villamor E, Cnattingius S. Interpregnancy weight change and risk of adverse pregnancy outcomes: a population-based study. Lancet 2006;368:1164-1170. [ Links ]
117. Ratner RE, Christophi CA, Metzger BE. Diabetes Prevention Program Research Group. Prevention of diabetes in women with a history of gestational diabetes: effects of metformin and lifestyle interventions. J Clin Endocrinol Metab 2008;93:4774- 4779. [ Links ]
118. Stuebe AM, Rich-Edwards JW, Willett WC, Manson JE, Michels KB. Duration of lactation and incidence of type 2 diabetes. JAMA 2005;294:2601-2610. [ Links ]
119. Pereira PF, Alfenas R de CG, Araujo RMA. ´Does breastfeeding influence the risk of developing diabetes mellitus in children? A review of current evidence. J Pediatr (Rio J) 2014;90:7-15. [ Links ]
ANEXO 1.- CUESTIONARIO PARA LA PREVENCIÓN DE ENFERMEDADES METABÓLICAS DEL EMBARAZO

ANEXO 2: ESQUEMA DE CONSULTAS MULTIDISCIPLINARIAS