Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Venezolana de Endocrinología y Metabolismo
versión impresa ISSN 1690-3110
Rev. Venez. Endocrinol. Metab. vol.14 no.3 Mérida oct. 2016
Factores asociados a pubertad precoz central en pacientes pediátricos portadores de parálisis cerebral infantil.
Natali González1, María Angelina Lacruz-Rengel2, Yajaira Briceño3, Mariela Paoli3.
1 Postgrado de Puericultura y Pediatría, Departamento de Puericultura y Pediatría, Instituto Autónomo Hospital Universitario de Los Andes. 2 Servicio de Neurología Infantil, Departamento de Puericultura y Pediatría, Instituto Autónomo Hospital Universitario de Los Andes. 3 Servicio de Endocrinología, Instituto Autónomo Hospital Universitario de Los Andes. Mérida, Venezuela.
Dirigir correspondencia a: María Angelina Lacruz-Rengel. Email: lacruz_rengel@hotmail.com
RESUMEN
Objetivo: Determinar los factores asociados a la aparición de pubertad precoz central (PPC) en niños con parálisis cerebral infantil (PCI).
Métodos: Estudio observacional analítico, tipo caso-control, incluyó 45 niños de ambos géneros con PCI, 20 casos con PPC y 25 controles sin PPC que asistieron a las consultas externas de Neuropediatría y Endocrinología Pediátrica del Instituto Autónomo Hospital Universitario de Los Andes (IAHULA), entre Junio 2014 y Mayo 2015. Se determinaron variables clínicas y paraclínicas para diagnóstico de PPC, así como variables demográficas, antropométricas, nutricionales, características clínicas de la PCI, patología endocrinológica asociada, y uso pro-longado de medicamentos.
Resultados: La PPC fue más frecuente en el género femenino (15 de 20 casos; p=0,009), con un riesgo (odds ratio) de 5,33 (IC95%: 1,45-19,57). No se comprobó asociación entre edad, estrato socio-económico, antropometría, etiología o características clínicas de la PCI y la aparición de PPC. La enfermedad endocrinológica concomitante más frecuente fue el hipotiroidismo y no endocrinológica, la epilepsia y los trastornos gastrointestinales. Hubo una asociación significativa entre el uso de medicamentos anticonvulsivantes y la presencia de PPC (85% frente a 48% en aquellos sin PPC; p=0,01), con un odds ratio de 6,14 (IC95%: 1,43-26,34).
Conclusión: En este grupo de pacientes con PCI, el género femenino y el uso de medicamentos anticonvulsivantes, fueron los factores que se encontraron asociados a la presencia de PPC.
Palabras clave: Pubertad precoz central, parálisis cerebral infantil.
Associated factors with central precocious puberty in pediatric patients with cerebral palsy
ABSTRACT
Objective: To determine the factors associated with the development of Central Precocious Puberty (CPP) in children with Cerebral Palsy (CP).
Methods: An analytical observational, case-control study was conducted, including 45 children with CP, 20 with CPP and 25 without it. All attended at pediatric neurology and pediatric endocrinology departments at the Autonomuos Institute University Hospital of Los Andes between June 2014 and May 2015. Clinical and laboratory variables for the diagnosis of CPP were determined, as well as demographic, anthropometric, nutritional variables, clinical characteristics of the CP, endocrine pathology associated, and prolonged use of drugs.
Results: The PPC was more frequent in females (15 of 20 cases; p = 0.009) with a risk (odds ratio) of 5,33 (95CI%: 1,45-19,57). There was not association between demographic characteristics, age, socioeconomic status, anthropometry, etiology or clinical features of CP and the occurrence of CPP. The concomitant most common endocrine disorder was hypothyroidism, and non-endocrine disorder, epilepsy and gastrointestinal disorders. There was a significant association between the use of anticonvulsant drugs and the presence of PPC (85% versus 48% in those without PPC; p=0.01), with a odds ratio of 6,14 (IC95%: 1,43-26,34).
Conclusion: In this group of patients with CP, female gender and use of anticonvulsant drugs were the factors that were associated with the presence of PPC.
Keywords: Central, precocious, puberty, cerebral, palsy.
Articulo recibido en: Mayo 2016. Aceptado para publicación en: Agosto 2016.
INTRODUCCIÓN
La parálisis cerebral Infantil (PCI) es la causa más frecuente de discapacidad en la población infantil. Este es un síndrome producido por lesión o daño del sistema nervioso central (SNC) durante la época prenatal o durante los primeros años de vida, con manifestaciones clínicas muy variables, pero que comparten en común el déficit motor1-3. Dentro de las distintas condiciones patológicas asociadas a la PCI, se tiene que un 48 a 52% de los casos presentan signos clínicos y hallazgos paraclínicos compatibles con pubertad precoz (PP), proponiendo que las lesiones neuronales y astro gliales presentes en estos pacientes podrían ser las causantes de la disregulación en los mecanismos neuroendocrinos de la pubertad4-7.
La pubertad precoz se define como la aparición de caracteres sexuales secundarios a una edad temprana, no fisiológica, esto es, antes de los 8 años en las niñas y de los 9 años en los niños; se acompaña de aceleración de la velocidad de crecimiento y adelanto de la edad ósea8. La edad de inicio puberal puede variar en distintas poblaciones de acuerdo con el estado nutricional, la etnia, condiciones climáticas, desarrollo socioeconómico y la presencia de enfermedades crónicas, entre otros. Esta edad se ha ido adelantando de manera significativa en los últimos años, con una tendencia secular auto limitada4,9.
Los cambios físicos tempranos característicos del comienzo de la pubertad aparecen como resultado de la activación patológica del eje hipotálamohipófisis- gonadal, con un aumento en la secreción pulsátil de hormona luteinizante (LH); se expresa clínicamente como telarquia en las niñas y aumento del volumen testicular en los niños (Tanner estadio II) en sus etapas iniciales10-12.
La PPC se puede dar por diversas vías, por medio de cambios transinápticos, con incremento de estímulos excitatorios de las neuronas secretoras de GnRH (vía glutamato, kisspeptina, neurokinina); por disminución de los estímulos inhibitorios; por disminución del estímulo de neuronas gabaérgicas y de neuronas productoras de sustancias opioides; por cambios en células gliales, las cuales contribuyen a la secreción de GnRH (liberación de factores de crecimiento que actúan sobre receptores de las neuronas GnRH), entre otros. Cualquier anomalía en estos mecanismos puede condicionar alteraciones en el desarrollo puberal, ya sea por adelanto, o por excesivo retraso10-12.
Si bien en la práctica clínica se observa la asociación entre pubertad precoz y parálisis cerebral infantil, existe muy poca literatura al respecto, por lo cual se propone estudiar los factores que pudieran estar asociados a la aparición de pubertad precoz en niños con parálisis cerebral infantil (PCI), incluyendo variables demográficas y nutricionales, tipo y grado de severidad de la PCI y uso crónico de medicamentos.
METODOLOGÍA
Sujetos: Se realizó un estudio observacional, analítico, de tipo caso-control, en pacientes pediátricos entre 5 y 14 años con PCI que asistieron a las consultas externas de Neuropediatría y Endocrinología del Instituto Autónomo Hospital Universitario de Los Andes (IAHULA), en el período comprendido entre Junio 2014 y Mayo 2015. Se excluyeron aquellos pacientes que cursaran con enfermedades degenerativas del SNC y aquellos con PP de origen periférico. Fueron evaluados en 4 apartados: 1. Evaluación demográfica y socio-económica, 2. Evaluación antropométrica y nutricional, 3. Evaluación neurológica y 4. Evaluación endocrinológica.
Procedimiento: La evaluación demográfica y socio-económica se realizó a través del interrogatorio de los representantes. Para la estratificación socio-económica se utilizó el método de Graffar-Méndez Castellanos13. La evaluación antropométrica fue realizada por pediatra a través de la obtención de medidas del paciente: peso en kg, talla en cm e índice de masa corporal (IMC: Kg/m2) bajo las recomendaciones del Programa Biológico Internacional de las Naciones Unidas14. Los patrones de referencia fueron los sugeridos por la Organización Mundial de la Salud (OMS) National Center for Heallth Statistics Growth Reference, EE.UU (NCHS)15 adoptado por el Taller de Evaluación Antropométrica del Estado Nutricional16, y utilizado por el Sistema Nacional de Vigilancia Nutricional (SISVAN) del Instituto Nacional de Nutrición (INN) de Venezuela.
La evaluación neurológica fue realizada por pediatra neurólogo, quien clasificó la PCI según etiología (Hipóxico-isquémica, malformativa, post-infecciosa o postraumática), según área afectada (mono, hemi, para o cuadriplejía) y grado de severidad (leve, moderada o severa) según el sistema de clasificación de la función motora Escala GMFCS (System to classify gross motor function)17.
La evaluación endocrinológica fue realizada por el pediatra endocrinólogo, quien interrogó y examinó aparición de signos puberales, edad de inicio, (telarquia, pubarquia, bromhidrosis, y otros sugestivos de alteración endocrina), clasificando según escala de maduración sexual de Tanner a la población estudiada8. En aquellos pacientes con sospecha clínica de PPC, se solicitó: 1. Titulación de LH, considerándose como punto de corte sugestivo de inicio puberal un valor basal de LH mayor a 0,6 mUI/ml realizado por método de quimioluminiscencia. No se realizó Prueba de estímulo con GnRH por falta de disponibilidad del medicamento. 2. En las niñas se realizó ecografía pélvica, por médicos radiólogos, tomando medidas referenciales del diámetro longitudinal del útero mayor de 3,5 cm y volúmenes ováricos mayores de 1,5 cm3 como sugerentes de inicio puberal. 3. Edad ósea realizada a través de una radiografía de mano y muñeca izquierda reportada por método de comparación con los Atlas de Maduración ósea del Venezolano de Fundacredesa18 y/o por el Atlas de Greulich y Pyle19, determinándose avanzada y sugerente de inicio de la pubertad cuando excedía en más de 2 años a la edad cronológica. En las niñas se consideró Pubertad Precoz Central cuando presentó caracteres sexuales secundarios (Tanner II o mayor) antes de los 8 años de edad acompañado de edad ósea adelantada, un ultrasonido con hallazgos sugestivos de pubertad y una LH mayor de 0,6 mU/mL. En los niños, cuando presentó caracteres sexuales secundarios (Tanner II o mayor) antes de los 9 años de edad acompañado de edad ósea adelantada y una LH mayor de 0,6 mUI/mL20.
Análisis Estadístico: Las variables cuantitativas se presentan en media y desviación estándar y las cualitativas en número absoluto y porcentaje. Para determinar la diferencia estadística entre las medias de las variables cuantitativas se aplicó la prueba T de student, ya que éstas mostraron una distribución normal. La asociación entre variables categóricas se estableció mediante la prueba del chi cuadrado, y cuando fue pertinente se calculó el odds ratio. Se consideró significativa una p<0,05. Se utilizó el programa SPSS (Statistical Packageforthe Social Sciences) versión 21, para Windows.
RESULTADOS
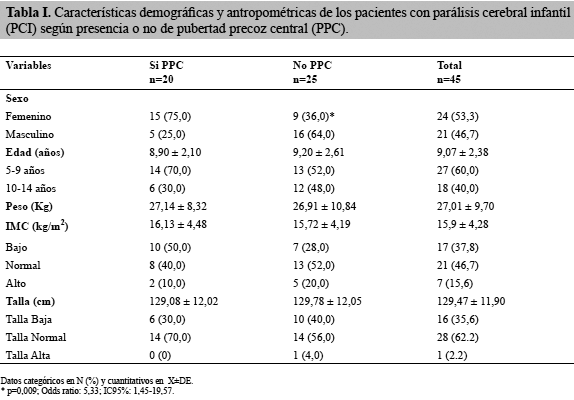
La población estuvo conformada por 45 niños con PCI, con edades comprendidas entre 5 y 14 años, con una media de 9,07 ± 2,38 años; el 53,3% eran de sexo femenino (24 pacientes) y el 46,7% masculino (21 pacientes). El 44,4% era procedente del Distrito Sanitario Mérida, el 13,3% de la zona de El Vigía y el resto de diferentes partes del Estado y de otros Estados. Se observó que 20 pacientes presentaron asociada una PPC, esto es el 44,4% de los pacientes con PCI estudiados; de ellos, el 75% (15 pacientes) eran de sexo femenino y el 25% (5 pacientes) masculino, mientras que en el grupo sin PPC (n=25; 55,6%), la mayoría, el 64% (16 pacientes) eran de sexo masculino y 36% (9 pacientes) femenino; esta asociación de pacientes con PPC y sexo femenino fue estadísticamente significativa (p=0,009), y determinó un riesgo (odds ratio) 5,33 veces mayor de presentar PPC si el paciente era de sexo femenino (IC95%: 1,45-19,57) (Tabla I). El promedio y desviación estándar de la edad no fue diferente entre los grupos con y sin PPC.
En relación a las características antropométricas de la muestra, el peso registrado fue de 27,01± 9,70 Kg y el IMC de 15,9±4,28 kg/m2, sin diferencias entre ambos grupos; en el grupo con PPC hubo 50% de IMC bajo, seguido de un 40% normal, mientras que en el grupo sin PPC hubo 52% normal y 28% bajo. El promedio de talla fue de 129,47±11,90 y se distribuyó en talla normal 62,2% y talla baja 35,6% de los pacientes, sin diferencia entre los grupos. No se encontró asociación entre las variables antropométricas de peso, talla e IMC y aparición de PPC en pacientes estudiados con PCI (Tabla I). La mayoría de los pacientes, el 60%, pertenecían al estrato socioeconómico medio-bajo, sin diferencias entre los grupos.
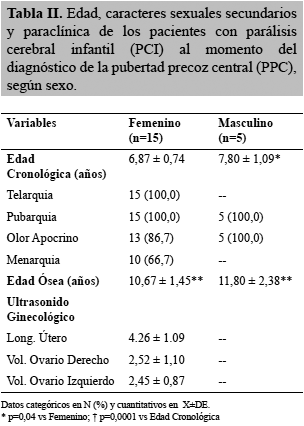
En aquellos pacientes con PPC (n=20), la edad al momento del diagnóstico fue para las niñas de 6,87±0,74 años y para los varones de 7,80±1,09 años de edad, significativamente más tardía en éstos últimos (p=0,04). Los datos clínicos de PPC en las niñas fueron telarquia y pubarquia en el 100% de los casos, seguidos de olor apocrino 86,7% y menarquia en el 66,7% de los casos. Para los casos masculinos, la pubarquia y el olor apocrino estuvieron presentes en el 100% de los casos. Desde el punto de vista paraclínico, en ambos géneros se observó una edad ósea significativamente mayor a la edad cronológica (p=0,0001); la ecografía pélvica describió valores de inicio puberal (Tabla II).
Desde el punto de vista neurológico predominó la etiología hipóxica-isquémica (66,6%), seguida de la postinfecciosa (11,1%), con lesión cuadripléjica espástica en el 42,2% de los casos y afectación motora severa en el 68% de los pacientes. No hubo diferencias al respecto entre los grupos con y sin PPC.
Se reportó comorbilidad en el 88% de la población estudiada; el hipotiroidismo fue la enfermedad endocrina más frecuente (24,4%), y entre las patologías no endocrinológicas, la epilepsia en un 57,8% y las alteraciones gastrointestinales seguida de patologías no endocrinológicas como epilepsia en un 57,8% y gastrointestinales en el 15,6% de los pacientes. No se observaron diferencias entre los grupos con y sin PPC al respecto.
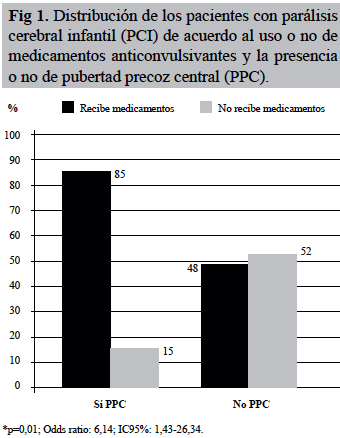
En la figura 1 se presenta la distribución de los pacientes de acuerdo al uso o no de medicamentos anticonvulsivantes y la presencia o no de PPC; del total de los pacientes, 29, el 64,4% usaban esta medicación. Se aprecia que el 85% (17 de 20) del grupo con PPC recibían medicación, mientras que en el grupo sin PPC predomina lo contrario, ausencia de medicación en el 52% (13 de 25) de los pacientes, por lo que se establece una asociación estadísticamente significativa entre el uso de medicamentos anticonvulsivantes y la presencia de PPC (p=0,01); se observó un riesgo (odds ratio) 6,14 veces mayor de presentar PPC si el paciente usaba medicamentos anticonvulsivantes (IC95%: 1,43-26,34). El anticomisial más frecuentemente utilizado en ambos grupos fue el Ácido Valproico en un 50% y 32% respectivamente, seguidos de Oxcarbazepina, Lamotrigina y Fenobarbital en menores proporciones.
DISCUSIÓN
La pubertad precoz es una de las patologías puberales más frecuentes en el género femenino, indistintamente de que la misma sea de origen central o periférico. Ese comportamiento se repite en esta serie con pacientes portadores de PCI, en donde las tres cuartas partes (75%) pertenecían al género femenino, y donde se determinó un riesgo 5,33 veces mayor de presentar PPC si el paciente era de sexo femenino, a pesar de existir una causa orgánica de PPC, la cual es más frecuente encontrarla en el sexo masculino6. Esta predominancia de género de PPC coincide con la descrita por varios autores en población general, así Moreno y cols.20 reportan una frecuencia 10 veces mayor en niñas que en niños, Bridge y cols.21 en una serie de 213 casos registran 197 niñas y 16 niños afectados. Se describe una alta prevalencia de patología orgánica endocraneal en pacientes del género masculino portadores de PPC, entre un 33% y 90%, mientras que en el género femenino la frecuencia varía entre un 8 a un 30%, dependiendo de las series. No obstante, es evidente la elevada prevalencia de patología orgánica entre los varones afectados de PPC6,21,22. No se encontraron en la literatura referencias que describan la predominancia de género en la asociación de PCI y PPC.
La edad de aparición de la PPC en nuestros pacientes de ambos géneros estuvo entre los 6 y 7 años, edades coincidentes con estudios realizados en población sin PCI, como el de Cisternino y cols.22 en Italia, quienes refieren que el 60% de 438 niñas presentaron PPC entre los 7-7,9 años, seguidos de un 40% en niñas iguales o menores a 6 años. Siddigi y cols.23 identificaron 32 pacientes con edad media de inicio de PPC de 7 años y 2 meses en niños y 5 años y 11 meses en las niñas, edad de inicio más temprano en las niñas que en los niños, similar a nuestros resultados.
En relación con el estado nutricional, la población propósito se encontraba dentro de la norma en más de la mitad de la muestra, estos casos son manejados en forma multidisciplinaria y reciben soporte por el servicio de nutrición. Una sexta parte de la muestra cursaba con obesidad, situación infrecuente si lo observamos desde la visual de la PCI; a pesar de que en nuestro estudio no se observó asociación entre adiposidad y PPC, se describe que el exceso de adiposidad durante la infancia influye en el desarrollo puberal y puede generar una pubertad adelantada posiblemente debido a la temprana estrogenización y la acción de la insulina sobre el receptor de IGF-1, entre otros posibles mecanismos. La obesidad moderada (hasta un 30% por encima de peso normal para la edad) se correlaciona con una menarquia precoz24.
La literatura describe que los patrones de crecimiento para los pacientes portadores de PCI son diferentes a la población general, presentan diferencias en peso, crecimiento lineal, masa muscular y reserva grasa; las dificultades en la alimentación y los consiguientes problemas nutricionales son responsables de estos déficits25-29 En un estudio multicéntrico en California U.S.A entre el año 1987 y 2002 se evaluaron anualmente peso y talla en 24.920 pacientes con PCI con el mayor grado de severidad según clasificación motora gruesa, observándose que tienden a pesar menos y ser de menor estatura en general que los que tienen discapacidades leves con predominio en la población masculina 59% vs 51% en femenina27,29.
Con respecto al crecimiento lineal, más de la mitad de la población estudiada se encontró con talla normal, contrario a lo que se describe en la literatura, con predominio de talla baja30-32. Samson-Fang y Stevenson33 refieren que niños púberes con PCI crecen más lentamente de lo esperado, y el género, edad, retraso cognitivo, limitación física y el estado nutricional, son factores que contribuyen a frenar el crecimiento.
Al considerar los parámetros diagnósticos clínicos para pubertad precoz, se aprecia que la condición de discapacidad motora tiene un comportamiento semejante al de la población general en lo relativo a la presencia de signos de pubarquia, telarquia y olor apocrino31. Así mismo, parámetros paraclínicos como la ecografía pélvica con valores de longitud uterina y volumen ovárico incrementados guardan un comportamiento similar al de la población general34,35.
Con respecto a la edad ósea (EO), herramienta usada en el diagnóstico de PPC, en la serie presentada se reportó una EO avanzada en dos o más años con respecto a la cronológica, similar a lo establecido previamente por otros autores en estos casos, como Moreno y cols.20, Sócrates y cols.36 y Mul y cols.37, con efectos deletéreos en la talla adulta definitiva.
Las características propias de la PCI estudiadas en la población propósito, (etiología, topografía, severidad de compromiso motor o alteración del tono predominante) no reportaron relación con la presencia de PPC. Sería necesario ampliar el tamaño muestral en busca de fundamentar estas posibles asociaciones.
En la población propósito se observó una fuerte asociación entre exposición a medicamentos anticonvulsivantes y presencia de PPC, confiriendo un riesgo 6,14 veces mayor de presentar PPC si el paciente los usaba. Dicha indicación está justificada en el control de epilepsia, la cual ha sido relacionada con disfunción endocrina y alteraciones en la fertilidad en mujeres y con crecimiento y desarrollo anormal en niños38-40. No está claro si la disfunción hormonal en pacientes con epilepsia es atribuible a la epilepsia por sí misma, o al tratamiento con fármacos antiepilépticos (FAE) en monoterapia o combinada40-43. Se ha especulado que la actividad de descarga epileptiforme en mujeres pudiera alterar la actividad pulsátil de las hormonas gonadotróficas hipotalámicas, y ser ésta la base de la disfunción, o bien, una modulación inducida por FAE de tipo pro-inhibición (gabaérgicas), como benzodiacepinas y barbitúricos, o controladores de la excitabilidad (glutaminérgicos) como el Ácido Valpróico, Lamotrigina y Carbamazepina.
Dos son los sistemas neuronales, gabaérgico y glutaminérgico, que parecen desempeñar el papel más importante en la activación puberal de la secreción de GnRH. El inicio de la pubertad parece depender de un aumento de las influencias neuronales excitatorias o una disminución de las influencias neuronales inhibitorias que controlan la secreción de GnRH. Es muy posible que los dos sistemas funcionen en intima conexión, de modo que, por ejemplo, un aumento de la neurotransmisión de aminoácidos excitatorios pueda aumentar la secreción de GnRH tanto directamente, por medio de una acción sobre las neuronas productoras de GnRH, como indirectamente, a través de alteraciones en el sistema neuronal gabaérgico, a su vez conectado a las neuronas productoras de GnRH y a otras neuronas que normalmente facilitan la secreción del neuropéptido25,44,45 .
Como conclusión, en este grupo de pacientes con PCI, no se demostró asociación entre características demográficas como procedencia, edad, estrato socio-económico, parámetros nutricionales ni características de la PCI, con la aparición de PPC; el género femenino y el uso de medicamentos anticonvulsivantes fueron los factores que se encontraron asociados a la presencia de PPC, lo cual abre una brecha para la investigación e identificación de grupos de riesgo, a fin de ofertar la atención integral que merecen estos pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Blanco M. Síndrome de parálisis cerebral. En: Enfermedades invalidantes de la infancia: un enfoque integral de rehabilitación. Santiago: Sociedad Pro Ayuda del Niño Lisiado; 1995. [ Links ]
2. Rosenbaum P. Cerebral palsy: what parents and doctors want to know. BMJ 2003;326:970-974. [ Links ]
3. Kruse M, Michelsen S, Flachs E, Brønnum H, Madsen M, Uldall P. Lifetime costs of cerebral palsy. Dev Med Child Neurol 2009;51:622-628. [ Links ]
4. Vargas F, Fuentes M, Lorenzo L, Marco MV, Martinez-Aedo MJ, Ruiz R. Pubertad precoz. Protoc Diagn Ter Pediatr 2011;1:193-204. [ Links ]
5. Kuperminc M. Puberty, statural growth, and growth hormone release in children with cerebral palsy. J Pediatr Rehabil Med 2009;2:131-141. [ Links ]
6. Díaz M, Soriano G, Muñoz C, Pozo J, Argente O. La pubertad precoz central en niños está asociada a una elevada prevalencia de patología orgánica. An Pediatr (Barc) 2006;65:434-438. [ Links ]
7. Garibaldi L, Aceto T, Weber C. The pattern of gonadotrophin and estradiol secretion in exaggerated thelarche. Acta Endocrinol 1993;128:345-350. [ Links ]
8. Carel J, Léger J. Clinical practice. Precocious puberty. N Engl J Med 2008;358:2366-2377. [ Links ]
9. Castro F, Rodríguez P, Conde B, Arias P, Sociedad Española de Endocrinología Pediátrica. Pubertad precoz y talla final. Avances en Endocrinología Pediátrica, Ediciones Médicas; 2007.Pág:31-49. [ Links ]
10. Jung H, Neumaier E, Hauffa B, Partsch C, Dammann O. Association of morphological characteristics with precocious puberty and/or gelastic seizures in hypothalamic hamartoma. J Clin Endocrinol Metab 2003;88:4590-4595. [ Links ]
11. Sepúlveda C, Mericq V. Mecanismos reguladores de la pubertad normal y sus variaciones. Rev Med Clin Condes 2011;22:27-38. [ Links ]
12. Rivarola M, Belgorosky A, Mendilaharzu H, Vidal G. Precocious puberty in children with tumours of the suprasellar and pineal areas: organic central precocious puberty. Acta Paediatr 2001;90:751-756. [ Links ]
13. Méndez-Castellano HM, Méndez MC. Sociedad y Estratificación. Método Graffar-Méndez Castellano. FUNDACREDESA. Caracas 1994:7-35. [ Links ]
14. WHO. Multicentre Growth Reference Study Group. WHO Child Growth Standards: Length/height-for-age, Weight-forage,Weight-for-length, Weight-for-height and Body massindex-for-age: Methods and Development. Geneva: World Health Organization, 2006. [ Links ]
15. WHO, Working Group. Use and interpretation of anthropometrics indicators of nutritional status. WHO 1986;4:929-941. [ Links ]
16. Méndez-Castellano y colaboradores. Estudio Nacional de Crecimiento y Desarrollo Humano de la República de Venezuela. FUNDACREDESA, Ministerio de la Secretaría de la Presidencia, Caracas, Venezuela, 1996. [ Links ]
17. Palisano R, Rosenbaum P. Development and reliability of a system to classify gross motor function in children with cerebral palsy. Dev Med Child Neurol 1997;39:214-223. [ Links ]
18. Izaguirre-Espinoza I, Macias-Tomei C, Gómez-Castañeda M, Mendez-Castellano H. Atlas de maduración ósea del venezolano. An Venez Nutr 2003;16:1. [ Links ]
19. Greulich W, Pyle S. Radiographic Atlas of skeletal development the hand and wrist. 2nd Ed Stanford University Press, 1959. [ Links ]
20. Moreno O, Genoves C, Moreno C, Albiach M. Pubertad precoz completa isosexual; Hallazgo clínicos, de laboratorio y ecografía pélvica. Ann Pediatr (Barc) 2008;69:413-419. [ Links ]
21. Bridges A, Hindmarsh C. Sexual precocity: sex incidence and a etiology. ADC 1994;70:116-118. [ Links ]
22. Cisternino M, Arrigo T, Pasquino A, Tinelli C, Antoniazzi F, Beduschi L. Etiology and age incidence of precocious puberty in girls: a multicentric study. J Pediatr Endocrinol Metab 2000;1:695-701. [ Links ]
23. Siddiqi SU, Van Dyke DC, Donohoue P, McBrien DM. Premature sexual development in individuals with neurodevelopmental disabilities. Dev Med Child Neurol 1999;41:392-395. [ Links ]
24. Christine M, Burt S, McCartney S. Obesity and the pubertal transition in girls and boys. Reproduction 2010;3:399-410. [ Links ]
25. Soriano G, Corripio R, Labarta J, Cañete R, Castro F, Espino R, Argente J. Central precocious puberty in children living in Spain: incidence, prevalence, and influence of adoption and immigration. J Clin Endocrinol Metab 2010;95:4305-4313. [ Links ]
26. Kuczmarski R, Ogden C, Grummer L, Flegal K, Guo S, Wei R, Mei Z, Curtin L, Roche A, Johnson. CDC growth charts: United States. Adv Data 314:1-27. [ Links ]
27. Fung E, Samson-Fang L, Stallings V, Conaway M, Liptak G, Henderson R, Worley G, ODonnell M, Calvert R, Rosenbaum P. Feeding dysfunction is associated with poor growth and health status in children with cerebral palsy. J Am Diet Assoc 2001;102:361-373. [ Links ]
28. Krick J, Murphy P, Zeger S, Wright E. Pattern of growth in children with cerebral palsy. J Am Diet Assoc 1996;7:680-685. [ Links ]
29. Krick J, Van Duyn MA. The relationship between oral-motor involvement and growth: a pilot study in a pediatric population with cerebral palsy. J Am Diet Assoc 1984;84:555-559. [ Links ]
30. Stallings VA, Charney EB, Davies JC, Cronk CE. Nutritional status and growth of children with diplegic or hemiplegic cerebral palsy. Dev Med Child Neurol 1993;35:997-1006. [ Links ]
31. Worley G, Houlihan CM, Herman-Giddens ME, ODonnell ME, Conaway M, Stallings VA, Chumlea WC, Henderson RC, Fung EB, Rosenbaum PL, Samson-Fang L, Liptak GS, Calvert RE, Stevenson RD. Secondary sexual characteristics in children with cerebral palsy and moderate to severe motor impairment: a cross-sectional survey. Pediatrics 2002;110:897-902. [ Links ]
32. Araújo A, Silva L. Anthropometric assessment of patients with cerebral palsy: which curves are more appropriate. J Pediatr 2013;89:307-314. [ Links ]
33. Samson-Fang L, Stevenson R. Linear growth velocity in children with cerebral palsy. Dev Med Child Neurol 1998;10:689-692. [ Links ]
34. Dieguez C, Iturriaga R, Gaztelu L. Actualizaciones Endocrinológicas. Pubertad Mc Graw-Hill, Madrid 2006. Pág:53-67. [ Links ]
35. De Vries L, Horev G, Schwartz M, Phillip M. Ultrasonographic and clinical parameters for early differentiation between precocious puberty and premature thelarche. Eur J Endocrinol 2006;154:891- 898. [ Links ]
36. Socrates D. Causas de pubertad precoz en niños. Manejo en el Servicio de Endocrinología del Hospital Infantil Manuel de Jesús Rivera. 2003. [ Links ]
37. Mul D, Hughes IA. The use of GnRH agonists in precocious puberty. Eur J Endocrinol 2008;159 Suppl 1:S3-S8. [ Links ]
38. Guo CY, Ronen GM, Atkinson SA. Long-term valproate and lamotrigine treatment may be a marker for reduced growth and bone mass in children with epilepsy. Epilepsia 2001;42:1141-1147. [ Links ]
39. Bauer J, Isojärvi JI, Herzog AG, Reuber M, Polson D, Taubøll E, Genton P, van der Ven H, Roesing B, Luef GJ, Galimberti CA, van Parys J, Flügel D, Bergmann A, Elger CE. Reproductive dysfunction in women with epilepsy: recommendations for evaluation and management. J Neurol Neurosurg Psychiatry 2002;73:121-125. [ Links ]
40. El-Khayat HA1, Abd El-Basset FZ, Tomoum HY, Tohamy SM, Zaky AA, Mohamed MS, Hakky SM, El Barbary NS, Nassef NM. Physical growth and endocrinal disorders during pubertal maturation in girls with epilepsy. Epilepsia 2004;45:1106-1115. [ Links ]
41. Sanfilippo JS. Hirsutism and polycystic ovarian syndrome. In: Kliegman RM, Behrman RE, Jenson HB, Stanton BF, editors. Nelson textbook of Pediatrics. 18th ed. Philadelphia, Pa: Saunders Elsevier; 2007. Pág: 2282-2284. [ Links ]
42. Bilo L, Meo R. Epilepsy and polycystic ovary syndrome: where is the link? Neurol Sci 2006;27:221-230. [ Links ]
43. Goldberg-Stern H, Yaacobi E, Phillip M, de Vries L. Endocrine effects of valproic acid therapy in girls with epilepsy: a prospective study. Eur J Pediatr Neurol 2014;18:759-765. [ Links ]
44. Partsch C, Sippell W. Pathogenesis and epidemiology of precocious puberty. Effects of exogenous estrogens. Hum Rep Update 2001;7:292-302. [ Links ]
45. Parent A, Teilmann G, Juul A. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev 2003;24:668-693. [ Links ]