Boletín de Malariología y Salud Ambiental
versión impresa ISSN 1690-4648
Bol Mal Salud Amb v.46 n.1 Maracay jul. 2006
Detección de infecciones subclínicas por Trypanosoma vivax en bovinos de fincas ganaderas de Mérida, Venezuela
Nota Científica
Ana Maria Bolívar1, Pablo García-Lugo1, Gladys Crisante1, Agustina Rojas1, Marta MGTeixeira2, Nestor Añez1*
1 Investigaciones Parasitológicas J. F. Torrealba, Universidad de los Andes, Facultad de Ciencias, Departamento de Biología, Mérida, 5101, Venezuela.
2 Departamento de Parasitologia, Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, SP, Brasil.
*Autor de Correspondencia: nanes@ula.ve
Se registra la detección de infecciones subclínicas por Trypanosoma vivax en bovinos asintomáticos de fincas ganaderas de Mérida, Venezuela. El diagnóstico fue realizado utilizando métodos parasitológicos (examen microscópico de muestra fresca, micro-capilar y láminas coloreadas); bioquímicos (Western blot) y moleculares (PCR) en muestras sanguíneas. Se advierte sobre el riesgo potencial que infecciones asintomáticas, ocultas o inaparentes pudieran representar para los rebaños bovinos. Se discute su significado y su importancia epizootiológica para regiones ganaderas del país.
Palabras claves: Trypanosoma vivax, ganado bovino, infecciones subclínicas.
Detection of Trypanosoma vivax subclinic infections in cattle from Merida, Venezuela
SUMMARY
Subclinic infections of Trypanosoma vivax were detected in symptomless animals from cattle farms in Merida, Venezuela. Parasitological (microscopical examination of: fresh, capillary tubes and stained slides-blood samples); biochemical (Western blot) and molecular (PCR) methods were used for diagnosis in blood sample. The significance, potential risk and epizootiological importance, are discussed.
Key Words: Trypanosoma vivax, cattle, subclinic infection.
Recibido el 26/04/2006 Aceptado el 05/06/2006
Trypanosoma (Duttonella) vivax Ziemann (1905), es el agente causal de una de las más importantes formas de tripanosomiasis detectadas en animales ungulados silvestres y domésticos entre los que se encuentran bovinos, búfalos, cabras, ovejas, camellos y ciervos de países tropicales y subtropicales de Asia, África y América (Sandoval et al., 1996, Vet. Trop. 21: 13-33; Tamasaukas & Roa, 1996, Tripanosomiasis bovina (T. vivax): Una Revisión, FONAIAP, Maracay, Venezuela). A pesar de la amplia gama de hospederos, es en el bovino donde el curso de la infección ha sido mayormente estudiado debido fundamentalmente a las implicaciones económicas, entre las que se mencionan infertilidad en el ganado y pérdidas basadas en el número de animales afectados por finca, duración del brote, mortalidad, abortos, gastos por tratamiento (drogas tripanocidas, reconstituyentes y electrolitos), asistencia veterinaria, diagnóstico de laboratorio, retardo en el crecimiento y pérdidas en la producción de leche, carne y cuero (Guillen et al., 2001, Vet. Trop. 26: 47-62).
Las manifestaciones clínicas producidas por T. vivax son muy variables, observándose desde accesos febriles, emaciación, disentería y anemia que pueden ocasionar la muerte hasta infecciones totalmente asintomáticas o subclínicas (Silva et al., 1996, Mem. Inst. Oswaldo Cruz, 91: 561-562). Existe consenso sobre el mecanismo de transmisión vectorial de T. vivax, incriminándose entre otros, dípteros hematófagos de los géneros Glossina, Tabanus y Stomoxys (Otte & Abuabara, 1991, Acta Tropica., 49: 73-76), aunque la transmisión puede ser llevada a cabo por especies de los géneros Boophilus, Culicoides y Psilopelmia (Rodríguez-Vivas et al., 2003, Rev. Biomed. 14: 29-33); habiéndose señalado la transmisión transplacentaria por algunos autores (Meléndez et al. 1993, J. Parasitol. 79: 293-294; González & Espinoza, 1994, Vet. Trop. 19: 41-53).
Los medios más comunes para detectar infecciones por T. vivax incluyen entre otros, métodos serológicos y parasitológicos. Estos últimos confrontan como inconveniente principal la baja sensibilidad en la medida que la infección tiende a la cronicidad o la parasitemia se mantiene en bajos niveles (De Almeida et al., 1997, Acta Tropica, 66: 45-50). Los métodos serológicos como el ensayo inmunoenzimático (ELISA) y la inmunofluorescencia indirecta (IFI) parecieran ser los métodos que han proporcionado los mejores resultados. Sin embargo, sus principales deficiencias son no poder discriminar entre infecciones recientes y pasadas y no diferenciar entre reacciones cruzadas con otros patógenos con los que T. vivax comparte similitud antigénica como Trypanosoma evansi y T. theileri (Desquesnes, 1997, Acta Tropica, 65: 139- 148; Morlais et al., 2001, Acta Tropica, 80: 207-213). Recientemente, las técnicas de biología molecular, particularmente la reacción en cadena de la polimerasa (PCR), ha permitido revelar infecciones en animales sintomáticos o asintomáticos sin parasitemia detectable (Dirie et al., 1993. Parasitol. 106: 21-29). Diferentes secuencias de ADN y ARN han sido diseñadas a partir de aislados africanos y americanos a fin de obtener mayor sensibilidad y especificidad en el diagnóstico. Sin embargo, a pesar de ello, su uso en diagnósticos de campo ha sido limitado (Ventura et al., 2001. Exp Parasitol, 99: 37-48). En el presente, muchos investigadores han utilizado la compatibilidad genética con T. evansi para justificar el uso de antígeno de este parásito en la elaboración de pruebas diagnósticas para la detección de tripanosomiasis por T. vivax (Uzcanga et al., 2002. Parasitol. 124: 287-299). Sin embargo, esta situación pudiera generar inconvenientes en zonas ganaderas donde la tripanosomiasis por T. evansi también sea endémica, pudiéndose atribuir reacciones positivas observadas a la presencia de T. evansi en bovinos en ausencia de T. vivax (Toro et al., 1980. Vet. Trop. 5: 43-50). En relación con la prevalencia de la tripanosomiasis bovina por T. vivax en Venezuela, durante la última década se han venido detectando valores de 20,8% al 57,8% por exámenes serológicos e infecciones activas de 1% a 3,9% por exámenes parasitológicos directos (Toro, 1990. Seroepidemiología de las Hemoparasitosis en Venezuela, USB-FCV-UCV, Venezuela; Perrone et al., 1991, Acta Cient. Venezol. 42(Supl.1): 208; Tamasaukas et al., 1996, Acta Cient. Venezol. 48(Supl.1): 71). A pesar de estos hallazgos, el interés por la investigación sobre T. vivax es escaso, circunstancia que ha traído como consecuencia que en muchas zonas ganaderas la comprensión de su verdadera epizootiología y el verdadero papel que juega como limitante de la producción bovina sean restringidos (Rivera, 1996. Hemoparasitosis bovinas: tripanosomiasis. UCV. C.D.C.H, Venezuela).
En el presente trabajo se registra la detección de infecciones subclínicas o asintomáticas producidas por T. vivax en bovinos de fincas ganaderas del estado Mérida localizadas entre el pie de monte andino y la depresión de la cuenca del Lago de Maracaibo, área escogida por su jerarquía de zona ganadera. Tres métodos diagnósticos fueron utilizados:
1) Diagnóstico parasitológico directo mediante el empleo de microcapilar, examen al fresco y frotis sanguíneo coloreado.
2 ) P C R c o m o h e r r a m i e n t a m o l e c u l a r , empleando los oligonucleotidos especieespecíficos-TviSL1 y TviSL2- de secuencia 5 G C T C T C C A AT C T TA A C C C TA 3 ´ y 5 ´ G T T C C A G G C G T G C A A A C G T C 3 ´ respectivamente, siguiendo la metodología descrita por Ventura et al. (2001, loc cit.).
3) Western blot con proteínas citosólicas de las formas sanguícolas de T. vivax (Bolívar et al., 2006 en preparación). El material biológico para realizar la detección de infecciones por T. vivax en bovinos consistió de sangre completa anticoagulada para la realización de los métodos parasitológicos y molecular (PCR) y suero como anticuerpo primario para la prueba de Western blot. La muestra de sangre en cada animal fue tomada por punción de la vena yugular colectándose en tubos con citrato de sodio al 3,8% (dilución 1:9) y en tubos secos sin anticoagulante según el caso. Las muestras debidamente rotuladas fueron transportadas en frío al laboratorio para los análisis respectivos.
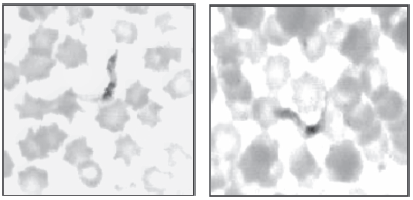
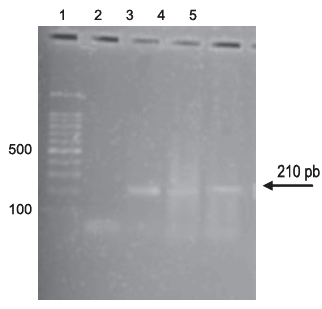
Un total de 72 bovinos de diferentes tamaños, edades y razas fueron examinados en 7 fincas ganaderas del estado Mérida. Los mismos de acuerdo al examen veterinario no presentaban signos o síntomas asociados a tripanosomiasis bovina. Los controles negativos fueron bovinos de la raza Holstein de la zona alta de Mérida, la cual ha sido catalogada como área no endémica para la tripanosomiasis bovina. Las pruebas parasitológicas revelaron positividad en 2 de los 72 bovinos examinados (2,8%). La detección de parásitos circulantes por las técnicas de examen al fresco y frotis sanguíneo coloreado fueron reconocidos morfológicamente de acuerdo a los criterios de Hoare (1972). La Fig. 1 muestra especimenes detectados durante el examen de sangre. Ambos animales positivos pertenecían al mismo rebaño y los mismos exhibían buena condición física. Las infecciones subclínicas o asintomáticas detectadas por métodos parasitológicos fueron corroboradas por PCR en muestra de sangre de ambos animales. En este caso el producto de amplificación de PCR, reveló una banda de 210 pb correspondiente al fragmento amplificado de la región intergénica del gen SL de T. vivax (Fig. 2). Similarmente, la detección de infección subclínica por T. vivax en bovinos fue también confirmada con la utilización de una fracción proteica de membrana del parásito, la cual fue utilizada como antígeno en una reacción de Western blot donde el anticuerpo primario fue el suero de animales expuestos a la infección (ver Bolívar et al., 2006). En este caso se obtuvo en uno de los 2 animales positivos una banda de aproximadamente 54 kDa. Quizás la razón de no detectar la misma señal en el otro animal positivo podría deberse a una infección reciente en la que los niveles de IgG a la cual se asocia el método usado hayan estado muy bajos en el animal infectado. Durante esta prueba fue comprobada la especificidad de la reacción para T. vivax, utilizando suero de animales con infecciones causadas por Anaplasma marginale, Mycobacterium bovis, Mycobacterium paratuberculosis y T. evansi los cuales fueron negativos. Detalles de la reacción de Western blot utilizando la fracción proteica de membrana de T. vivax se muestra en la Fig. 3.
Fig. 1. Trypanosoma vivax en sangre periférica de bovinos asintomáticos. Frotis sanguíneo coloreado con Giemsa 1000X.
Fig. 2. Detección de infecciones asintomáticas por T. vivax empleando la Reacción en Cadena de la Polimerasa.
1: marcador de peso molecular; 2: control de reacción (agua); 3: ADN genómico T. vivax; 4 y 5: muestras sanguíneas de bovinos positivas a T. vivax por métodos parasitológicos.
Fig. 3. Detección de Infecciones por T. vivax en bovinos mediante Western blot.
1: marcador de peso molecular; 2: control positivo de reacción; 3 y 4: suero de bovinos positivos a T. vivax por parasitología y PCR; 5, 6 y 7: suero de bovino positivo a A. marginale, M. bovis y M. paratuberculosis respectivamente; 8: suero de equino positivo a T.evansi.
Analizando los resultados obtenidos en esta experiencia, se considera que los siguientes aspectos justifican la presente comunicación:
1.- Se detecta la presencia de infecciones subclínicas, asintomáticas o inaparentes causadas por T. vivax en bovinos aparentemente saludables en un área de importancia ganadera del Estado Mérida, Venezuela.
2.- La coincidencia diagnóstica de métodos parasitológicos, bioquímicos y moleculares confirman la presencia de infecciones ocultas por T. vivax, demostrando la circulación del parásito en animales portadores sanos, lo cual los convierte en reservorios potenciales.
3.- Se advierte sobre la posibilidad de que animales con infecciones subclínicas por T. vivax puedan reactivar la infección en condiciones de compromiso inmunológico, convirtiéndose en fuente de infección para animales jóvenes, los cuales actuarían como génesis potencial de epidemias.
4.- Se sugiere la posibilidad de que las infecciones subclínicas pudieran estar superando el número de casos clínicos sintomáticos y se insta a la realización de trabajos similares con un mayor número de ejemplares que los reportados en la presente nota preliminar.
5.- Se sugiere la utilización de métodos sensibles y específicos como PCR y/o bioquímicos (Western blot) para estimar la prevalencia real de las infecciones por T. vivax en áreas ganaderas de importancia económica.
AGRADECIMIENTO
Agradecemos la colaboración de los Med. Vet. R. Bolívar y C. Rivas durante el trabajo de campo. A los productores quienes facilitaron el estudio en sus fincas. Soporte económico recibido por CDCHT-ULAC- 1210-03-03-EM (NA).












 uBio
uBio