Boletín de Malariología y Salud Ambiental
versión impresa ISSN 1690-4648
Bol Mal Salud Amb v.49 n.1 Maracay jul. 2009
Supervivencia e infectividad de formas metacíclicas de Trypanosoma cruzi en alimentos experimentalmente contaminados
Néstor Añez*, Gladys Crisante & Maximiliano Romero
Investigaciones Parasitológicas J. F. Torrealba, Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes, Mérida, 5101, Venezuela.*Autor de correspondencia: nanes@ula.ve
Se registra el tiempo de supervivencia de formas metacíclicas de Trypanosoma cruzi, obtenidas del tracto digestivo deRhodnius prolixus, sobre alimentos contaminados experimentalmente. Observaciones entre 1h y 18h post-contaminación revelaron la presencia de abundantes y activos metacíclicos en los alimentos contaminados durante las primeras 6 horas, declinando la población de los mismos sobre la décima hora. La actividad de las formas metacíclicas no mostró diferencias en alimentos contaminados en fase sólida o líquida. Asimismo, se demuestra la alta infectividad de metacíclicos de T. cruzi que sobreviven en alimento contaminado luego de ser ingeridos por un hospedador vertebrado.
Palabras clave: Trypanosoma cruzi, metacíclico, contaminación, alimento, supervivencia, infectividad.
Survival and infectivity of Trypanosoma cruzi metacyclic forms in experimentally contaminated food
SUMMARY
The survival of Trypanosoma cruzi metacyclic forms in contaminated food is reported. Observations carried out 1-18h after contaminating food with metacyclics from infected Rhodnius prolixus, revealed abundant and active flagellates during the first 6h post-contamination. The same activity was observed in metacyclics maintained on liquid or solid contaminated food. In addition, the infectivity of surviving T. cruzi metacyclic forms in contaminated food after being ingested by a vertebrate host is demonstrated.
Key words: Trypanosoma cruzi, metacyclic, contamination, food, survival, infectivity.
Recibido el 29/11/2008 Aceptado el 11/03/2009
INTRODUCCIÓN
En previa publicación aparecida recientemente en este medio Añez & Crisante (2008) registran la supervivencia de formas de cultivo de Trypanosoma cruzi en alimentos experimentalmente contaminados. En la misma los autores señalan que en el 73% las muestras de frutas y hortalizas utilizadas en sus experimentos, los parásitos permanecieron vivos por períodos entre 6 y 72 horas post contaminación estimando, asimismo, el mayor número de flagelados vivos entre las 6h y 18h. Aun cuando estos hallazgos se refieren a formas no infectivas del parásito, la encilla metodología empleada y los interesantes resultados obtenidos ofrecen una opción experimental que pudiera ser evaluada mediante el uso de formas infectivas provenientes de triatominos infectados con T. cruzi. Este enfoque permitiría tener idea de lo que pudiera estar ocurriendo en áreas donde la enfermedad de Chagas es endémica, cuando triatominos infectados por T. cruzi, colonizando domicilios o invadiendo los mismos desde ambientes selváticos o peridomiciliares, contaminen con sus heces infectadas alimentos que permanecen expuestos en el ámbito doméstico, dentro o fuera de la casa, los cuales son finalmente ingeridos a diferentes tiempos por los habitantes de la misma.
En el presente ensayo se indaga sobre la supervivencia de formas metacíclicas de T. cruzi, colectados de especimenes de Rhodnius prolixus experimentalmente infectados, luego de contaminar muestras de frutas, hortalizas, jugos y leche fluida con material fecal, obtenido de la ampolla rectal. Asimismo, se registra la infectividad de los metacíclicos de T. cruzi, colectados de uno de los alimentos contaminados, exponiendo ratones lactantes a la ingestión oral.
MATERIALES Y MÉTODOS
Aislado de T. cruzi
Todos los experimentos fueron llevados a cabo utilizando el aislado MHOM/Ve/92/2-92 de T. cruzi, obtenido de un caso agudo severo de enfermedad de Chagas proveniente de la localidad La Maporita, estado Barinas, Venezuela. El mismo fue previamente caracterizado molecularmente como T. cruzi I (Añez et al., 2004). Este aislado es mantenido en nuestro laboratorio mediante pasajes periódicos por triatominos y/o ratones experimentalmente infectados.
Triatominos.
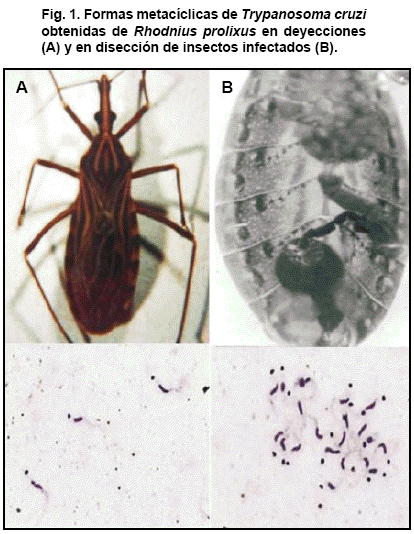
Ejemplares adultos de R. prolixus provenientes de la colonia del Laboratorio de Entomología Herman Lent, Departamento de Biología, Facultad de Ciencias, Universidad de Los Andes, Mérida, Venezuela, fueron utilizados para realizar los experimentos. Los insectos fueron ingurgitados sobre ratones infectados con T. cruzi mostrando altas parasitemias. Una vez infectados los triatominos fueron mantenidos en incubador a 25ºC y 70% de humedad relativa, siendo examinados frecuentemente mediante observación microscópica de muestras de deyecciones obtenidas de cada insecto hasta la detección de las formas metacíclicas (Fig.1A). Confirmada la infección, los insectos fueron disecados, obteniéndose el contenido de la ampolla rectal para proceder luego a contar los parásitos microscópicamente para estimar el número de formas metacíclicas por volumen (Fig. 1B).
Alimentos utilizados.
Frutas y hortalizas, en trozos de 3 cm x 3 cm o triturados para obtener sus jugos, además de agua de coco y leche fluida expendida en envases de ½ litro, fueron utilizadas en los experimentos. Las muestras de frutas incluyeron cambur, melón y lechoza, en sus dos presentaciones en trozos y en jugos, mientras que de las hortalizas, sólo tomate se presentó en las dos formas, ya que papa y zanahoria, ambas cocidas, fueron colocadas en trozos del tamaño indicado. La muestra de zanahoria fue eliminada por presentar alta contaminación inicial. Las muestras en trozos fueron colocadas en envases plásticos (TC-Plate 6 well, sterile–cellstar) de 3,5 cm de diámetro en cada pozo, debidamente separados y tapados (Fig.2). Las muestras de jugos, agua de coco y leche fueron mantenidas en viales estériles plásticos de 5 ml con tapa de rosca.
Procedimiento.
Una vez disecados los triatominos infectados, el pool del contenido intestinal fue observado en microscopioAxioscop (Zeiss) con objetivo de contraste de fase a 400x para detectar y estimar la cantidad de metacíclicos de T. cruzi presentes por volumen (Fig. 1B). La concentración de metacíclicos obtenidos fue estimada en 200/mL, dispensándose sobre cada muestra un volumen de 25µL, equivalentes a 5x103 metacíclicos por muestra contaminada (Fig.2). Observaciones de las muestras fueron realizadas 1, 3, 6, 10 y 18 horas post contaminación con metacíclicos de T. cruzi. Las mismas consistieron en tomar una alícuota de aproximadamente 5 µL con pipeta graduada Gilson con punta de volumen fijo luego de agitar suavemente la muestra, procediéndose luego a colocarla en una lámina portaobjeto de vidrio para ser examinada microscópicamente como se indicó anteriormente. La presencia de parásitos en cada muestra fue registrada cualitativamente como se indica en previa publicación (Añez & Crisante, 2008). Asimismo, la actividad de las formas metacíclicas en las muestras que resultaron positivas fue registrada con video-cámara digital (Noticam 480) adaptada al microscopio Axioscop y conectada a computador HP con programa Motic Images 2000 Version 1.3.
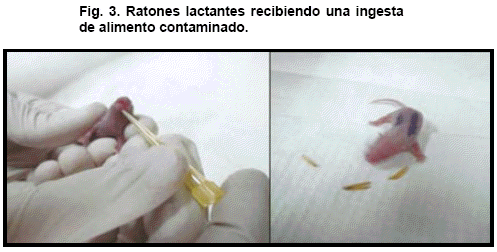
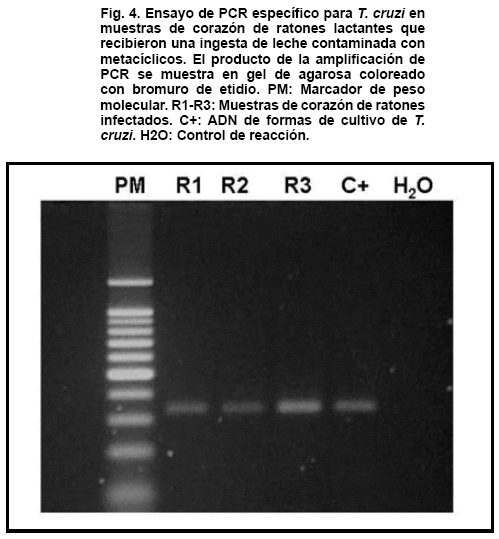
La prueba de infectividad de los metacíclicos fue realizada utilizando únicamente muestras de leche contaminada y obtenida en alícuotas de 50mL 1, 3 y 6 horas post contaminación. Cada muestra así obtenida fue ofrecida por vía oral a un par de ratones lactantes de 5 días de nacidos por cada tiempo (Fig.3). Muestras de sangre de cada ratón fueron examinadas microscópicamente entre los 7 y los 24 días post ingesta del inóculo conteniendo metacíclicos sobrevivientes, con la finalidad de indagar sobre la capacidad infectiva de los mismos. La observación fue hecha, por duplicado, en preparaciones al fresco de sangre tomada de la cola de cada ratón y de extendidos de muestras sanguíneas, fijadas y coloreadas con colorante de Giemsa al 10% en buffer fosfato pH 7,2. Adicionalmente, para el mismo propósito muestras de corazón de algunos de los ratones infectados fueron sometidas a un ensayo de PCR específico para ADN de T. cruzi (Sturn et al., 1989; Guhl et al., 2002).
RESULTADOS
Supervivencia de metacíclicos de Trypanosoma cruzi en alimentos experimentalmente contaminados.
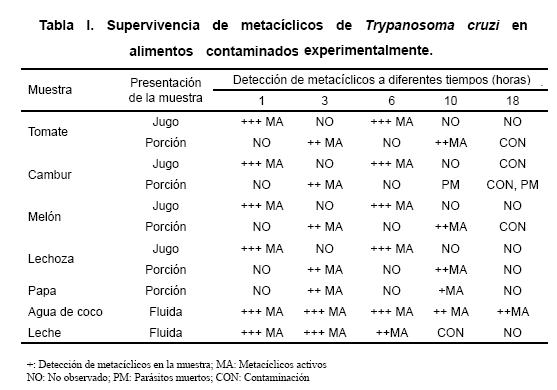
Observaciones microscópicas llevadas a cabo entre 1h y 18h sobre muestras de alimentos previamente contaminados con metacíclicos de T. cruzi, reveló la presencia de estos flagelados en todas las formas de presentación de frutas, hortalizas y fluídos, mostrando activos movimientos y un desplazamiento similar al detectado en el inóculo original proveniente del contenido intestinal presente en la ampolla rectal de R. prolixus. En general, durante las primeras 6h de observación fue notada una cantidad abundante de metacíclicos activos en casi todas las muestras, declinando la misma hacia la hora 10 post contaminación. La observación correspondiente a la hora 18 mostró actividad registrable en los metacíclicos sólo en la muestra de agua de coco; el resto de las muestras, para ese tiempo, estaban fuertemente contaminadas por bacterias, detectándose en algunas de ellas sólo parásitos muertos. En la Tabla I se detalla el resultado del registro sobre la supervivencia de los metacíclicos en los diferentes alimentos contaminados, incluyendo la forma de presentación de la muestra y la actividad detectada durante todo el período de observación.
Infectividad de metacíclicos de T. cruzi colectados de leche contaminada
Observaciones microscópicas sobre muestras sanguíneas tomadas de ratones nuevo nacidos,
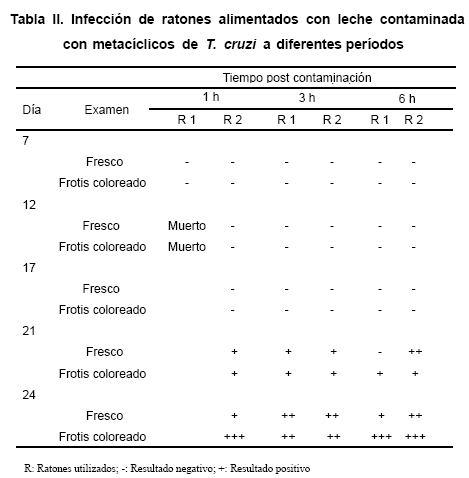
los cuales habían ingerido una alícuota de leche contaminada con metacíclicos de T. cruzi provenientes de especimenes infectados de R. prolixus, revelaron la presencia de tripomastigotes sanguícolas a partir de los 21 días post ingesta. Todos los animales que ingirieron el alimento con 1h, 3h y 6h post-contaminación con metacíclicos, adquirieron indistintamente la infección, la cual fue detectada por los dos métodos parasitológicos utilizados (Tabla II). Similarmente, la infección fue detectada utilizando un ensayo de PCR, en el cual fue amplificado un fragmento de 330 pb cuando se utilizaron los primers S35 y S36 permitiendo revelar una porción del genoma de T. cruzi en corazón de ratones infectados (Fig.4).DISCUSIÓN
La contaminación de alimentos por triatominos vectores de T. cruzi de procedencia selvática y/o doméstica es probablemente un factor importante para la transmisión oral de casos de enfermedad de Chagas en Venezuela. Sin embargo, el verdadero significado de este sospechado hecho es ignorado en áreas venezolanas donde la enfermedad de Chagas es endémica, a pesar de existir información sobre episodios epidémicos de esta dolencia en localidades del vecino Brasil, atribuidas a infección oral por T. cruzi (Crescente et al., 1992; Valente et al., 2001). De la misma manera, los factores responsables por la alta infectividad de los parásitos ingeridos no son bien conocidos, aunque la ocurrencia de casos severos y/o muertes de individuos infectados pudieran estar indicando la alta patogenicidad de los flagelados por su capacidad de penetración al hospedador vertebrado (Camandaroba et al., 2002). En Venezuela el conocimiento sobre la transmisión oral de la infección chagásica es limitada y aparte de algunos reportes de transmisión experimental en animales realizados hace 40 años (Diaz-Ungría, 1968), el único evento impactante conocido en los últimos tiempos, relacionado con este modo de transmisión, corresponde a un brote agudo recientemente ocurrido en una comunidad urbana de la región capital, involucrando escolares presuntamente infectados por consumo de jugos contaminados con T. cruzi posiblemente provenientes de ejemplares triatominos con infección naturalmente adquirida (DGE, MPPS, 2007). Similarmente, escasa información existe sobre la supervivencia de T. cruzi en alimentos normalmente ingeridos en áreas de transmisión activa y aunque previamente sospechado en áreas de alta prevalencia (Crisante et al., 2006), el poco y más reciente conocimiento que se tiene al respecto está referido a formas de cultivo del parásito contaminando algunos alimentos experimentalmente expuestos (Añez & Crisante, 2008).
En el presente trabajo se demuestra que metacíclicos de T. cruzi provenientes del tracto intestinal de R. prolixus pueden sobrevivir períodos de 10 horas o más en alimentos sobre los cuales se ha producido una contaminación, conservando los flagelados su actividad típica. La comparación del tiempo de supervivencia de los parásitos sobre trozos y/o jugos de frutas y hortalizas u otros fluidos como agua de coco verde o leche, reveló en todas las muestras metacíclicos muy activos entre 1 y 10 horas, detectándose, además, que en la muestra de agua de coco los mismos permanecieron con suficiente actividad hasta las 18 horas post contaminación. Sobre las 10 h un acelerado proceso de contaminación bacteriana fue observado en las muestras, provocando la desaparición de la población parasitaria. Esta observación utilizando formas metacíclicas de T. cruzi corrobora previas observaciones llevadas a cabo en nuestro laboratorio utilizando formas de cultivo y las mismas muestras de alimentos ( Añez & Crisante, 2008). Los resultados obtenidos en el presente trabajo, pudieran reflejar un hallazgo de potencial importancia epidemiológica tomando en consideración que las muestras utilizadas constituyen alimento de consumo humano en áreas rurales venezolanas donde la enfermedad de Chagas es endémica. Esto, aunado a la existencia de triatominos vectores domiciliados o provenientes de ecotopos peridomésticos o selváticos, albergando infección por T. cruzi en su tracto intestinal, podrían convertirse en un factor de riesgo de contaminación del alimento encontrado. Por otra parte, la capacidad de supervivencia de las formas metacíclicas infectivas sobre estos alimentos pudiera considerarse un riesgo latente de infección para el humano consumidor, el cual podría resultar un evento de mayor frecuencia y eficacia que la misma transmisión vectorial. Aun cuando esta última aseveración necesita comprobación experimental, su potencial posibilidad no debería ignorarse.
Otro aspecto de relativa importancia epidemiológica considerado en el presente trabajo es la demostración de la capacidad infectiva que conservan los metacíclicos de T. cruzi luego de pasar hasta 6h contaminando alimentos expuestos. En esta oportunidad la utilización de leche contaminada con esta forma infectiva del parásito para alimentar ratones lactantes, reveló la infección por T. cruzi en todos los animales expuestos. Este hecho demuestra la infectividad de los metacíclicos independientemente de su permanencia por 1h, 3h o 6h en el alimento contaminado, conservando su típica agresividad al mostrar abundantes formas tripomastigotes circulantes e invasión a tejidos como corazón y músculo esquelético.
Finalmente, la demostración simultánea de la supervivencia y la infectividad de metacíclicos de T. cruzi en alimentos contaminados, advierte sobre la posibilidad de contar con otro factor de riesgo epidemiológicamente importante en la transmisión de la infección chagásica en localidades rurales de Venezuela, dada el grado de adaptabilidad y la eficiencia para penetrar la célula hospedadora que tiene esta forma del parásito.
AGRADECIMIENTOS
Los autores agradecen al Lic. Néstor Añez-Rojas su asistencia en la preparación del manuscrito. Trabajo financiado por los proyectos FONACIT-G2005-000370 (NA) y FONACIT-G-2005-000387 (ON).
REFERENCIAS
1. Añez N. & Crisante, G. (2008). Supervivencia de formas de cultivo de Trypanosoma cruzi en alimentos experimentalmente contaminados. Bol. Mal. Salud Amb. 48: 91-94. [ Links ]
2. Añez N., Crisante G., Maia da Silva F., Rojas A., Carrasco H., Umezawa E. S., Stolf A. M. S., Ramirez J. L. & Teixeira M. M. G. (2004). Predominance of lineage I among Trypanosoma cruzi isolates from Venezuelan patients with different clinical profiles of acute Chagas disease. Trop. Med. Int. Health. 9: 1319-1326. [ Links ]
3. Camandaroba E. L. P., Pinheiro Lima C. M. & Andrade S. G. (2002). Oral transmission of Chagas disease: importance of Trypanosoma cruzi biodeme in the intragastric experimental infection. Rev. Inst. Med. Trop. São Paulo. 44: 97-103. [ Links ]
4. Crescente J. A., Valente S. A. S., Valente V. C. & Araújo J. A. (1992). Ocorrência de 4 casos agudos de doença de Chagas na vila de Icoarací-PA. Ver. Soc. Brás. Méd. Trop. 25 (Suppl. 1): 29 (res.062). [ Links ]
5. Crisante G., Rojas A., Teixeira M. M. G. & Añez, N. (2006). Infected dogs as a risk factor in the transmission of human Trypanosoma cruzi infection in western Venezuela. Acta Trop. 98: 247-254. [ Links ]
6. DGE-MPPS (2007). Vigilancia de enfermedad de Chagas. Guía para el diagnóstico, manejo y tratamiento de enfermedad de Chagas en fase aguda a nivel de los establecimientos de salud. 1era. Edición. Caracas, Venezuela. [ Links ]
7. Diaz-Ungría C. (1968). Estudio experimental del Trypanosoma cruzi en el perro y otros vertebrados. El problema de la transmisión. Kasmera. 3: 73-88. [ Links ]
8. Guhl F., Jaramillo C., Carranza J. C. & Vallejo G. A. (2002). Molecular characterization and diagnosis of Trypanosoma cruzi and T. rangeli. Arc. Med. Res. 33: 362-370. [ Links ]
9. Sturn N. R., Degrave W., Morel C. & Simpson L. (1989). Sensitive detection and schizodeme classification of Trypanosoma cruzi cells by amplification kinetoplast minicircle DNA sequences: use in diagnosis of Chagas disease. Mol. Biochem. Parasitol. 33: 205-214. [ Links ]
10. Valente V. C., Valente S. A. S. & Pinto A. Y. N. (2001). Perfil parasitológico e serológico em microepidemia familiar de doença de Chagas em Abaetetuba, Estado de Pará. Rev. Soc. Brás Méd. Trop. 34: 20-21. [ Links ]












 uBio
uBio