Boletín de Malariología y Salud Ambiental
versão impressa ISSN 1690-4648
Bol Mal Salud Amb v.51 n.1 Maracay jun. 2011
Monitoreo in vitro de la susceptibilidad del Plasmodium falciparum a cinco drogas antimalaricas. Estado Amazonas, Venezuela
Monitoring susceptibility of Plasmodium falciparum vs. five antimalaric drugs. Amazonas state, Venezuela
Irma Rodríguez*, Aníbal Carrasquel & Margarita González
Servicio Autónomo Centro Amazónico de Investigación y Control de Enfermedades Tropicales "Simón Bolívar", Puerto Ayacucho, Estado Amazonas, Ministerio del Poder Popular de Salud.
*Autor de correspondencia: rodir@hotmail.com
RESUMEN
Se evaluó la susceptibilidad a cinco drogas antimaláricas en aislados de Plasmodium falciparum, en el municipio Atures del estado Amazonas. Se empleó la técnica de maduración de esquizontes (sistema de la OMS Mark II). Los parásitos fueron sensibles: a 64 pmol de mefloquina en 56/56 aislados; a 256 pmol de quinina en 56/60 aislados; a 1000 pmol de sulfadoxina/ pyrimetamina en 15/22 aislados; a 4 pmol de amodiaquina en 34/59 aislados y a 8 pmol de cloroquina en 34/58 aislados. Los valores del 50% de la Concentración Inhibitoria en pmol/pozo a mefloquina es 1,11; a quinina 7,60; a sulfadoxina-pyrimetamina 21,60; acloroquina 1,23 y a amodiaquina 0,66. Se demostró en aislados de P. falciparum sensibilidad a mefloquina, disminución de la sensibilidad a quinina y resistencia a cloroquina, amodiaquina, sulfadoxina-pyrimetamina. Se sugiere implementar in vitro un monitoreo de variaciones temporales en la susceptibilidad a los antimaláricos empleados por el Programa de Control de la Malaria en Amazonas, como un sistema de alerta temprana de la resistencia.
Palabras clave: Plasmodium falciparum, in vitro, susceptibilidad, antimaláricos, Amazonas.
SUMMARY
The susceptibility of isolates of Plasmodium falciparum of the municipality Atures in Amazonas state, Venezuela, to five antimalarial drugs was evaluated using the schizont maturation inhibition technique (OMS Mark II). Parasites were sensible to: 64 pmol mefloquine in 56/56 isolates; 256 pmol of quinine in 56/60 isolates; 1000 pmol of sulfadoxinepyrimethamine in 15/22 isolates; 4 pmol of amodiaquine in 34/59 isolates; 8 pmol of chloroquine in 34/58 isolates. The values of the 50% inhibition concentration (IC50, geometric mean) were as follows: mefloquine = 1.11pmol; quinine = 7.60 pmol; sulfadoxine-pyrimethamine = 21.60 pmol; chloroquine= 1.23 pmol; amodiaquine = 0.66 pmol. The present study confirms full sensibility of the strains to mefloquine, and decreasing sensibility to quinine, chloroquine, amodiaquine and sulfadoxine-pyrimethamine. The susceptibility of P. falciparum to antimalarial drugs needs continuous monitoring in order to detect the emergence of resistant strains and to guarantee the quality of the malaria control programme of Amazonas, Venezuela.
Key words: Plasmodium falciparum, in vitro, susceptibility, antimalarial, Amazonas.
Recibido el 28/12/2010
Aceptado el 18/03/2011
INTRODUCCIÓN
La malaria es una enfermedad parasitaria, producida por 4 especies de Plasmodium: P. ovale, P. malarie, P. vivax y P. falciparum, siendo esta última especie causante de la malaria grave, complicada y de muertes. En el 2008 se registró 247 millones de casos de paludismo, causantes de cerca de un millón de muertes, sobre todo en niños africanos. En África, cada 45 segundos muere un niño de paludismo, y la enfermedad es responsable de un 20% de las muertes infantiles (OMS, 2011). La situación en América no es tan grave, probablemente porque P. vivax causa la mayoría de los casos, y raramente se ha observado complicaciones por P. vivax, sin embargo esta especie causa múltiples recidivas y considerable morbilidad, debido a que los fármacos con acción curativa radical disponibles requieren de un esquema de tratamiento prolongado y por razones operacionales se dificulta el cumplimiento (Pérez, 2004). Sin embargo, existen áreas con transmisión de P. falciparum resistente a drogas antimaláricas (Tangpukdee et al., 2009; Mendis et al., 2001).
La resistencia a las drogas antimaláricas por P. falciparum fue reportada en Venezuela en el año 1959: en Trujillo se registró la resistencia a los inhibidores de la dihidrofolato reductasa (DHFR) como la pirimetamina (Maberti, 1960), en Bolívar se reportó la resistencia a la sulfadoxina-pyrimetamina (Godoy et al., 1977; Caraballo & Rodríguez, 1999), resistencia a la cloroquina (Navarrete et al., 1986; Caraballo & Rodríguez, 1999; Aché et al., 2002). En Amazonas se ha reportado falla terapéutica de la cloroquina en el municipio Atures en 50% de 22 pacientes evaluados, (Maynadié et al., 1989), en 100% de 20 pacientes evaluados (Rodríguez et al., 2005); en el Municipio Manapiares en 33% de 18 pacientes evaluados; en el Municipio Alto Orinoco 68% de 22 pacientes evaluados (Certad et al., 2005).
Para la década de los 90, el mayor índice parasitario anual de malaria lo presentaba Amazonas, con 12% de los 22.000 casos registrados en Venezuela, 67% P. vivax, 31,2% P. falciparum y 0,8% P. malarie e infecciones mixtas. (Aché, 1998; Informe de gestión CAICET, 1998). El año 2007 en Amazonas se registraron 7736 casos (83%) de P. vivax, 1416 (16%) casos de P. falciparum, 12 casos (0,1%) de P. malariae y 40 cases (0,4%) infecciones mixtas (Metzger, et al., 2009). El año 2010 en Amazonas se registraron 2118 casos (75%) de P. vivax, 635 (22%) casos de P. falciparum, 57 cases (2%) de P. malariae y 18 cases (0,6%) infecciones mixtas. En el año 2003 se registraron 2193 casos de P. falciparum, lo que representa una disminución de 3,5 veces menos casos de P. falciparum en Amazonas respecto el año 2010 (Sub Dirección de Salud Ambiental Amazonas, 2010).
La disminución de los casos de malaria P. falciparum, obedece a la toma de acciones al cambiar el tratamiento de primera línea (cloroquina) por la combinación de mefloquina-artesunato-primaquina (esquema de tres días) para la malaria no complicada causada por P. falciparum, y continuar con el uso de cloroquina y primaquina (esquema de 14 días) para la malaria causada por P. vivax. (Metzger et al., 2009).
Con el fin de desarrollar un monitoreo de la resistencia para generar información base del uso de antimaláricos adecuados en poblaciones que viven en Atures, y establecer con el uso de pruebas in vitro un sistema de vigilancia de las drogas antimaláricas en Amazonas; se monitoreó in vitro la susceptibilidad del P. falciparum a los antimalaricos: quinina, mefloquina, amodiaquina, cloroquina y sulfadoxina-pyrimetamina, en el municipio Atures.
MATERIALES Y MÉTODOS
Área de estudio y población
El presente trabajo fue desarrollado en el municipio Atures del estado Amazonas venezolano durante 1998- 2002 (en los meses Julio a Diciembre de 1988; Febrero a Agosto de 1999 y de 2000; Noviembre a Diciembre de 2001 y Enero a Julio de 2002). Para la selección de los voluntarios se consideraron tres puestos de diagnostico de malaria en Puerto Ayacucho: Centro Amazónico de Investigación para el Control de Enfermedades Tropicales (CAICET), Laboratorio Central de Malaria y Hospital José Gregorio Hernández. En estos puestos se hace el examen microscópico "La gota gruesa y extendido" para determinar la morfología y parasitemia de la especie de Plasmodium que causa la malaria o paludismo. Para el estudio se seleccionaron aquellos individuos procedentes del municipio Atures, que cumplieron con los criterios de selección de la OMS (1990): pacientes con malaria no complicada, mayores de 1 año, únicamente con anillos y trofozoitos de P. falciparum, con parasitemias entre 1000 y 80.000 parasitos/μl de sangre, que no habían ingerido antimalaricos en los últimos tres meses y previamente informados sobre el estudio accedieron voluntariamente a donar las muestras de sangre.
Parásitos
De cada voluntario se extrajeron tres mililitros de sangre venosa recolectada en tubos con citrato de sodio, cada muestra de sangre se conservó a 37ºC hasta el momento de su uso, en el laboratorio del CAICET, las muestras se centrifugaron a 2.500 rpm 5 minutos a temperatura ambiente, para obtener la capa sedimentada de eritrocitos, se descartó el plasma y las células blancas. El paquete de eritrocitos, se centrifugó a 2.500rpm por 5 minutos por tres veces con una solución A pH 6,8: de 10,4g/L de RPMI 1640, suplementado con 2g/L de glucosa, 5,9g/L de Hepes, 0,1g/L de hypoxantina y 5mL/L al 5% (p/v) NaHCO3. Se obtuvieron los aislados frescos de P. falciparum de cada paquete de eritrocitos. Todos los productos fueron de la casa: Sigma-Aldrich, St Louis, MO, USA.
Ensayo de susceptibilidad a las drogas antimaláricas
Los eritrocitos parasitados se mezclaron con medio de cultivo RPMI 1640: solución A + 1mL/L al 3% (p/v) L-glutamine y 1mL/L al 5% (p/v) glutathione (para el caso de cloroquina, amodiaquina, quinina, y mefloquina); y medio de cultivo LPLF® (para el caso de la prueba con sulfadoxina/ pirimetamina), ambos medios suplementados al 10% con plasma humano AB+ (cortesía del Banco de Sangre del Hospital José Gregorio Hernández) inactivado a 56ºC/30. De cada mezcla sangre (4% de eritrocitos parasitados) medio, 50μl fueron agregados en duplicado en cada pozo de las placas predosificadas con las drogas antimaláricas (producidas por la OMS Filipinas/ OMS Malasia), luego se incubó en una cámara con CO2 (producido al encender una vela) a 37ºC por 24 a 48 horas, al finalizar la incubación, de cada pozo se hizo una gota gruesa, se coloreó con Giemsa al 20% pH 6,8 por 5 minutos y luego se examino por microscopia.
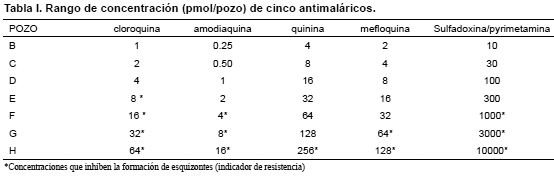
Cada prueba se consideró valida al observar en cada gota gruesa con objetivo de 100X en el pozo control (sin droga), la presencia de más de 10% (20 esquizontes/200 parásitos asexuales: trofozoitos+esquizontes) esquizontes de 3 o más núcleos para cloroquina, amodiaquina, quinina, y mefloquina, y esquizontes de 8 o más núcleos para sulfadoxina/ pyrimetamina. La resistencia se consideró cuando se observó esquizontes de P. falciparum en presencia de la mínima concentración de la droga que inhibe el desarrollo de los parásitos (Tabla I) y se evaluó para cada droga la concentración inhibitoria (IC) que inhibe el 50% de los parásitos (OMS, 1990). Con 10 pruebas válidas el resultado del análisis de la susceptibilidad es aceptable (OMS, 1990- 2001).
Análisis estadístico
Para cada droga se estimó con el software PROBIT la media geométrica de IC50 que se requiere para inhibir el crecimiento del 50% de la población de Plasmodium.
Consideraciones éticas
Este estudio fue aprobado por el Comité Ético del Centro Amazónico de Investigación y Control de Enfermedades Tropicales "Simón Bolívar" (CAICET).
RESULTADOS
Durante los meses: Julio a Diciembre de 1988; Febrero a Agosto de 1999 y de 2000; Noviembre a Diciembre de 2001 y Enero a Julio de 2002, se mantuvo vigilancia en los centros centinelas para la búsqueda de los casos de P. falciparum. Se registraron 210/ 955= 22% casos de P. falciparum que cumplieron con los criterios de selección recomendados por la OMS (1990) y solo 88/210= 42% voluntarios donaron las muestras de sangre venosa. Los cultivos exitosos resultaron ser, aquellas muestras de sangre procesadas antes de las 4 horas luego de la extracción venosa, aislados con parasitemias de inicio entre 1.200 a 9.000 parásitos/ μl de sangre. El tiempo medio de duración de los cultivos fue de 34±4 horas; al finalizar el cultivo, en cada pozo control se contaron desde 20 a 182 esquizontes por 200 parásitos asexuales.
La distribución general de pruebas válidas fue 58/88 = 66% para la cloroquina 59/88 = 67% para la amodiaquina 60/88 = 68% para la quinina, 56/88 = 64% para la mefloquina, 22/47 = 47% para la sulfadoxina/pyrimetamina, el número de aislados 47 difiere de 88 debido a que el medio de cultivo LPLF® se adquirió con retraso.
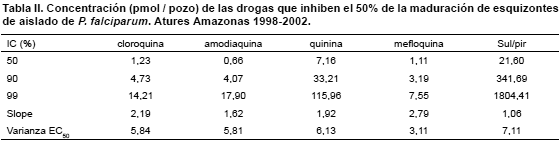
La inhibición completa de la maduración de los esquizontes fue 34/58 = 59% aislados a 8 pmol/pozo de cloroquina; 34/59 = 58% aislados a 4 pmol/pozo de amodiaquina; 56/60 = 93% aislados a 256 pmol/pozo de quinina; 56/56 = 100% aislados a 64 pmol/pozo de mefloquina y de 15/22 = 68% aislados a 1000 pmol/pozo de sulfadoxina/ pyrimetamina, de acuerdo a los estándares de la OMS (1990) cada una de estas concentraciones son consideradas para representar la susceptibilidad a las drogas. La concentración de cada droga que inhibe el 50% de la maduración de los esquizontes (IC50) fue calculada con el software PROBIT y se resume en la Tabla II.
DISCUSIÓN
El ensayo de susceptibilidad a las cinco drogas antimaláricas del Plasmodium falciparum, a través de las pruebas de maduración de esquizontes de la OMS: permitió determinar entre 24 a 48 horas, en parásitos frescos aislados en campo, la concentración de la droga que inhibe la maduración de esquizontes; básicamente sin riesgo para el paciente, puesto que no incluye procedimientos invasivos a parte de la recolección de muestra de sangre periférica, sin embargo, tiene una intensa labor particular, puesto que requiere de personal altamente entrenado en microscopia. Los valores de la media geométrica IC50 en pmol/pozo de cloroquina 1,23; amodiaquina 0,66; quinina 7,60; mefloquina 1,11 y sulfadoxina-pyrimetamina 21,60, están por debajo de las concentraciones consideradas inhibitorias del crecimiento de los parásitos, de acuerdo a la los valores estándares de la micro-prueba in vitro (Mark II). Noedl et al. (2004) señalan que las pruebas in vitro, permiten medir la resistencia intrínseco de una droga en Plasmodium, pero una de las limitaciones de las pruebas in vitro con aislados frescos, es que estos aislados son pul de poblaciones de parásitos sensibles y/o resistentes. Cuando en un aislado la proporción de parásitos resistentes y sensibles a una droga son iguales, predominará el valor de la IC50 de los parásitos resistentes.
Sin embargo, la proporción de aislados que mostraron esquizontes en las concentraciones inhibitorias del crecimiento de los parásitos en cada una de las drogas evaluadas, cloroquina, amodiaquina, quinina, mefloquina y sulfadoxina-pyrimetamina en 41%, 42%, 7%; 0% y 36% respectivamente, evidencia la presencia de P. falciparum resistente a la: cloroquina, amodiaquina y sulfadoxina-pyrimetamina. Reducción de la sensibilidad a la quinina en 7% y sensibilidad a la mefloquina en 100%, si comparamos estos resultados con los observados previamente en el municipio Atures por Maynadié, et al. (1989), quienes reportaron aislados de P. falciparum resistentes a la cloroquina en 25% y resistencia a la mefloquina en 11%. Estas observaciones muestran un aumento de la proporción de aislados resistentes del P. falciparum a la cloroquina, amodiaquina (4-aminoquinoleinas); inclusive podrían considerarse como un aviso de alerta temprana de la disminución de la actividad antimalárica de quinina y un alerta para el uso adecuado de la mefloquina, debido a la similitud en la estructura molecular en ambas drogas, como lo mencionó Maynadié et al. (1989).
La resistencia a las drogas antimaláricas está condicionada por presión de la droga sobre los parásitos (Young et al., 1961; Kremsner et al., 1989; Brasseur et al., 1993; Watkins et al., 1993; Legrand et al., 2008). En Venezuela desde 1946 se ha utilizado la cloroquina para el tratamiento de la malaria, se dejó de utilizar por un periodo de cuatro años (1988-1992) y durante este periodo, se administró la amodiaquina como droga de primera línea. La sulfadoxina-pirimetamina fue la droga de segunda línea y la quinina la droga de tercera línea. Las drogas cloroquina y amodiaquina son derivados de 4-aminoquinoleinas, poseen semejanza estructural y funcional y se han administrando en Venezuela por más de 5 décadas para el tratamiento de malaria a P. falciparum.
En el año 2005 en Venezuela se implementó cambios en la política de antimaláricos para tratamiento de la malaria por P. falciparum: se sustituyó a cloroquina como tratamiento de primera línea por la combinación de artesunato vs mefloquina, el coartem® como tratamiento de segunda línea, y la combinación quinina vs clindamicina como tratamiento de tercera línea. Al respecto Noedl et al. (2005), indican que la susceptibilidad a las drogas antimalaricas necesariamente deben ser monitoreadas continuamente para prevenir emergencias de la resistencia, las experiencias con cloroquina y sulfadoxina-pyrimetamina son muy claras, si las acciones son tomadas después de las fallas clínicas, esto al mismo tiempo, impide salvaguardar lo valioso de las drogas para el control de la malaria. En este sentido Bacon et al. (2007a), señalan que la actividad de las drogas antimaláricas sobre los parásitos se va perdiendo con el tiempo porque los parásitos desarrollan estrategias para evadir la acción antimalárica. Tomando en cuenta estas observaciones se considera que la vigilancia y prevención de la resistencia a las drogas son muy importantes en los Programas de Control de Malaria.
La OMS, plantea un sistema de monitoreo de variaciones temporales y espaciales en la susceptibilidad a los antimaláricos, como un sistema de alerta temprana de resistencia. Propone una metodología universal basada en la medición de los procedimientos y lectura de la prueba en condiciones controladas, con el uso de cepas de referencia resistentes y sensibles, puesto que no hay un valor estándar universal de IC50 comparable de laboratorio a laboratorio (Bacon et al., 2007a; Kaddouri et al., 2008). Actualmente se conocen 4 ensayos para evaluar las pruebas in vitro: la prueba morfológica del sistema de la OMS Mark III (OMS, 2001); los ensayos isotópicos, que miden la incorporación de hypoxantina tritiada por el parásito; los métodos basados en ELISA: HRP II® y pLDH® y el ensayo de detección de DNA: SYBR®Green I o pico green (Noedl et al., 2002, 2003; Basco, 2007; Bacon et al., 2007b). El microtest de la OMS, requiere una intensiva labor particular, microscopistas altamente entrenado para disminuir variabilidad individual entre observadores. El ensayo isotópico, requiere alta parasitemias, equipo especializado y exclusivo, con riesgos de radiactividad. Los métodos basados mediante un ensayo inmunoenzimático ELISA, es fácil de ejecutar, requiere equipos de uso común, además, tiene sensibilidad similar al método microscópico y es altamente reproducible como el método radioisotópico (Noedl et al., 2004); no obstante, requiere reactivos específicos para revelar la presencia de P. falciparum mucho más costosos que la gota gruesa del ensayo de la OMS. El uso de marcadores moleculares de la resistencia a los antimalàricos, también permiten servir como sistema de alarma de resistencia en poblaciones de parásitos del área en estudio (Sibley & Ringwald, 2006).
La IC50, permite establecer la sensibilidad basal de los parásitos a una droga, evaluar el cambio en dicha sensibilidad en el tiempo, y los datos son la base para los estudios de eficacia terapéutica a nivel local (Ringwald, 2005). En los últimos 5 años, los países fronterizos con la amazonia venezolana, Colombia, Brasil y La Guyana, vienen empleando los métodos para evaluar la susceptibilidad a los antimaláricos in vitro recomendados por la OMS. Han reportado en aislados frescos de P. falciparum la media geométrica de la IC50 de cloroquina 422, 9 nM; amodiaquina131,4 nM; quinina 269,7 nM; mefloquina 56,3 nM y artesunato 1,88 nM, en Colombia (Arango et al., 2008). La IC50 de cloroquina 100.1 nM; amodiaquina 22.3 nM; quinina 22.3 nM; mefloquina 22.3 nM y artemeter 2,03 nM; aunque en un área aislada se reportó artemeter 82.6 nM; en La Guyana Francesa (Legrand et al., 2008). La IC50 de artesunato 0.85 nM y artemeter 3.0 nM; para Brasil en el estado Amazónico de Pará (Ferreira et al., 2008). El área endémica en Guyana es un indicador de un alerta temprano del uso racional de los derivados de artemisina al Sur de América y que debe mantenerse la vigilancia de los antimaláricos. Los valores altos de IC50 de las 4 aminoquinolinas se debe a que continúa sobre P. falciparum la presión de la cloroquina, puesto que se emplea esta droga para el tratamiento de P. vivax, áreas donde ocurren infecciones mixtas (Lawpoolsri et al., 2010).
En éste trabajo, se demuestra, que durante el periodo 1998 al 2002 en el municipio Atures circulaban P. falciparum que no eran eliminados con la cloroquina, amodiaquina y sulfadoxina-pyrimetamina, pero si por la mefloquina, con pérdida de la efectividad de quinina. Resultados que para ese momento generaron información importante que obligaron a evaluar los esquemas de tratamiento de primera y segunda línea P. falciparum en la región: como el estudio de Rodríguez et al., 2005 y el de Certad et al., 2005; los aportes de éstas investigaciones, sumados a los esfuerzos conjuntos de los países Amazónicos e instituciones (OPS/OMS, USAID, CDC, USP, MSH) para Hacer Retroceder la Malaria en la región de las Américas (Roll Back Malaria initiative), impulsaron al Programa de Control de Malaria a participar en La Red Amazónica de Vigilancia de la Resistencia a los Antimaláricos (RAVREDA) y la Iniciativa Amazónica para la Malaria (AMI), cuyos resultados produjeron el cambio de las políticas del tratamiento terapéutico para P. falciparum en Venezuela.
Este estudio ratifica que las pruebas in vitro permiten monitorear la susceptibilidad a los antimaláricos, por lo que se recomienda implementar un sistema de monitoreo de variaciones temporales y espaciales en la susceptibilidad a los antimaláricos de primera línea artesunato, mefloquina, y de segunda línea quinina que actualmente emplea el Programa de Control de la Malaria P. falciparum en Amazonas. Esto permitiría lograr un sistema de alerta temprana de la resistencia y poder preservar lo valioso de la actividad de las drogas.
AGRADECIMIENTOS
Los autores agradecen el soporte financiero de la Agenda Salud FONACIT- proyecto Mal-96004. A Magda Magris; a Carlos Botto, al personal del Servicio de Endemias de Amazonas: por su colaboración en la realización del estudio.
REFERENCIAS
1. Aché A. (1998). Situación actual de la malaria en Venezuela. Bol. Malar. Saneam. Amb. 38: 31-36. [ Links ]
2. Aché A., Escorihuela M., Vivas E., Páez E., Miranda I., Matos A., Pérez W., Díaz O. et al. (2002). In vivo drug resistance of P. falciparum malaria in mining areas of Venezuela. Trop. Med. Int. Healtht. 7: 737-743. [ Links ]
3. Arango E., Carmona-Fonseca J. & Blair S. (2008). Susceptibilidad in vitro de aislamientos colombianos de Plasmodium falciparum a diferentes antipalúdicos. Documento en línea: http://www.scielo.org.co/scielo.php (Consultado 2011, Marzo 16). [ Links ]
4. Bacon D. J., Jambou R., Fandeur T., Le Bras J., Wongsrichanalai Ch., Ringwald P., et al. (2007a). World Antimalarial Resistance Network (WARN) II: In vitro antimalarial drug susceptibility. Mal J. 6: 120. [ Links ]
5. Bacon D. J., Latour C., Lucas C., Colins O., Ringwald P. & Picos S. (2007b). Comparison of a SYBER green I-based assay with a histidine-rich protein II enzyme-linked immunosorbent assay for in vitro antimalarial drug efficacy testing and application to clinical isolates. Antimicrob Agents Chemother. 51: 1172-1178. [ Links ]
6. Basco L. K. ( 2007). Field application of in vitro assays sensitivity of human malaria parasites antimalarial drugs. WHO. Geneva, Switzerland. [ Links ]
7. Basco L. & Pascal R. (2007). Molecular epidemiology of malaria in Cameoon. XXXIV. Trends of in vitro antimalarial drug responses in Yaunde, Cameroon. Am. J. Trop. Med. Hyg. 76: 20-26. [ Links ]
8. Brasseur P., Bitsindou P., Mayon R., Eggelte T., Samba G., Penchenier L., et al. (1993). For emergence of Plasmodium falciparum resistence to halofantrine. Lancet. 341: 901-902. [ Links ]
9. Caraballo A. & Rodríguez A. (1999). La quimioterapia de malaria y resistencia a las drogas antimalariales en el área de Guyana Venezuela. Am. J. Trop. Med. Hyg. 61: 120-124. [ Links ]
10. Certad G., Wide A., Rodríguez I., Capaldo J., Zárate M., Galbán N., et al. (2005). Respuesta terapéutica y parasitemia en pacientes con malaria por Plasmodium falciparum en diferentes comunidades del estado Amazonas, Venezuela. Bol. Mal. Salud Amb. 45: 19-25. [ Links ]
11. Ferreira, I. D., Martinelli, A., Rodrigues, L. A., Do Carmo, E. L., Do Rosário, V. E., Póvoa, M. M. and Cravo, P. (2008). Plasmodium falciparum from Pará state (Brazil) shows satisfactory in vitro response to artemisinin derivatives and absence of the S769N mutation in the SERCA-type PfATPase6. Trop. Med. Int. Health. 13: 199-207. [ Links ]
12. Godoy G. A., Volcan G. S., Guevara R., Medrano C., Castro J. & Texeira A. (1977). Venezuelan strains of Plasmodium falciparum resistant to sulfa and pyrimetamine by in vitro test. Rev. Latinoam. Microbiol. 19: 229-231. [ Links ]
13. Kaddouri H., Abdoulaye D., Souleymane D., Aly K., Mamadou T., Ve´ronique H., Aminatou K. et al. (2008). Baseline in vitro efficacy of ACT component drugs on Plasmodium falciparum clinical isolates from Mali. Int. J. Parasitol. 38: 791–798. [ Links ]
14. Kremsner P., Zatter G., Feldmeier H., Bienzleu U., Janse-Resseck R., Graninger W., et al. (1989) Differences in drug response of Plasmodium falciparum within an area of the Amazon region. Trans. R. Soc. Trop. Med. Hyg. 83: 158-161. [ Links ]
15. Lawpoolsri S., Chavéz I. F., Yimsamran S., Puangsa-art S., Thanyavanich N., Maneeboonyang W. et al. (2010). The impact of human reservoir of malaria at a community-level on individual malaria occurrence in a low malaria transmission setting along the Thai-Myanmar border. Documento en línea: http://www.malariajournal.com/content/9/1/143 (consultado: 2010, Agosto 04). [ Links ]
16. Legrand E., Volney B., Meynard J.B., Mercereau-Puijalon O. & Esterre P. (2008). In vitro Monitoring of Plasmodium falciparum Drug Resistance in French Guiana: a Synopsis of Continuous Assessment from 1994 to 2005. Documento en línea: http://www.ncbi.nih.gov/pmc/articles/PMC2223885 (Consultado: 2011, Marzo15). [ Links ]
17. Maberti S. (1990). Desarrollo de resistencia a la pyrimetamina. Presentación de 15 casos estudiados en Trujillo, Venezuela. Archivos Vzlan. de Med. Trop. y Parasitol. Méd. 3: 239-259. [ Links ]
18. Maynadié M., Peceño C., Noriega P. & Yarzabal L. (1989). Susceptibility of Plasmodium falciparum strain to chloroquine and mefloquine in the Amazonas Federal Territoriy of Venezuela. Trans. R. Soc. Trop. Med. and Hyg. 83: 586-588. [ Links ]
19. Mendis K., Sina B. J., Marchesini P., Carter R. (2001). The neglected burden of Plasmodium vivax malaria. Am. J. Trop. Med. Hyg. 64: 97-106. [ Links ]
20. Metzger W. G., Girón A., Vivas-Martinez S., González J., Charrasco A. J., Mordmuller B. G. & Magris M. (2009). A rapid malaria appraisal in the Venezuelan Amazon. Document en línea: http://www.malariajournal.com/content/8/1/291 (consultado: 2010, Agosto 02). [ Links ]
21. Navarrete L., Garron A., Flores F. & Morales de G. (1986). Resistencia de Plasmodium a la cloroquina en el Estado Bolívar. Servicios de Endémias Rurales, zona III, MSDS. Caracas, Venezuela. [ Links ]
22. Noedl H., Wernsdorfer W. H., Miller R. S. & Wongsrichanalai C. (2002). Histidine-Rich Protein II: a novel approach to malaria drug sensitivity testing. Antimicrob. Agents. Chemother. 46: 1658-1664. [ Links ]
23. Noedl H., Wongsrichanalai C. & Wernsdorfer W. H. (2003). Malaria drug-sensitivity testing: newassays, new perspectives. Trends Parasitol. 19: 175-181. [ Links ]
24. Noedl H., Attlmayr B., Wernsdorfer W.H., Kollaritsch H., Smiller R. (2004). A histidine-rich protein 2-based malaria drug sensitivity assay for field use. Am. J. Trop. Med. Hyg. 6: 711-714 [ Links ]
25. Noedl H., Bronnert J., Yingyuen K., Attlmayr B., Kollaritsch H. & Fukuda M. (2005). Simple Histidine-Rich Protein 2 Double-Site Sandwich Enzime-Linked Inmunosorbent assay for Use in Malaria Drug Sensitivity Testing. Antimicrob. Agents. Chemother. 49(8): 3575-3577. [ Links ]
26. OMS (1990). In vitro Micro-Tes (Mark II) for the assessment of response of Plasmodium falciparum to chlroquine, mefloquine, quinine, sulfadoxine/pyrimetamine an amodiaquine. WHO/MAP/87.2, Rev 1. Geneva, Switzerland. [ Links ]
27. OMS (2001). In vitro micro-tes (Mark III) for the assessment of response of Plasmodium falciparum to chlroquine, mefloquine, quinine, amodiaquine, sulfadoxine/pyrimetamine an artemisinine. CTD/MAL/97.20, Rev. 2. Geneva, Switzerland. [ Links ]
28. OMS (2011). Nota descriptiva Nº 94. Actualizada en abril de 2010. Documento en línea: http://www.who.int/mediacentre/factsheets/es/ (consultado: 2011, Marzo 16) [ Links ]
29. Pérez H. (2004). El paludismo por Plasmodium vivax y los desafíos del tratamiento adecuado y oportuno. Bol. Mal. Salud Amb. 44: 1-8. [ Links ]
30. Rodríguez I., Giron A., Veloso G., Carrasquel A. & González M. (2005). Ensayo clínico aleatorizado, comparativo de cloroquina y quinina para el tratamiento de la malaria por Plasmodium falciparum en Amazonas Venezuela. Bol. Mal. Salud Amb. 45: 11-18. [ Links ]
31. Ringwald P. (2005). Susceptibility of Plasmodium falciparum to antimalarial drugs. Report on global monitoring 1996-2004. WHO/HTM/MAL/2005.1103. Geneve: World Health Organization. [ Links ]
32. Sibley C. H. & Ringwald P. (2006). A database of antimalarial drug resistance. Malaria J. 5: 48. [ Links ]
33. Tangpukdee N., Duangdeev C., Wilaratana P. & Krudsood S. (2009). Malaria Diagnosis: a brief review. Korean J. Parasitol. 47: 93-102. [ Links ]
34. Watkins W. M. & Masobo M. (1993). Treatment of Plasmodium falciparum malaria with pyrimethamine-sulfadoxine: selective pressure for resistance is a function of long elimination half.life. Trans. R. Soc. Trop. Med. Hyg. 87: 75-78. [ Links ]
35. Young M. D. & Moore D. V. (1961). Choloroquine resistance in Plasmodium falciparum. Am. J. Trop. Med. Hyg. 10: 319-320. [ Links ]












 uBio
uBio