Boletín de Malariología y Salud Ambiental
versão impressa ISSN 1690-4648
Bol Mal Salud Amb vol.53 no.1 Maracay jan. 2013
Jesús Berti1*, Damary Manzo2 , Mariela Ramos2 & Luis Antonio Guerra1
1 Servicio Autónomo Instituto de Altos Estudios "Dr. Arnoldo Gabaldon" (MPPS). Centro de Estudio de Enfermedades Endémicas y Salud Ambiental. Las Delicias, Maracay, Venezuela.
2 Universidad de Carabobo. Facultad de Ciencias de la Salud. Núcleo La Morita, Maracay, estado Aragua, Venezuela.
*Autor de correspondencia: jbertimoser@yahoo.com
RESUMEN
Pyriproxyfen es un análogo sintético de la hormona juvenil ampliamente usado para el control de mosquitos. Esta investigación describe bioensayos realizados en condiciones de laboratorio con una formulación granulada del producto, utilizando larvas del IV instar de Aedes aegypti. Este producto (Sumilarv G-0,5%) fue formulado en Brasil, con 0,5 % del ingrediente activo (Pyriproxyfen: S-31183). El objetivo fue determinar la eficacia del producto y evaluar su acción residual a tres concentraciones (0,002; 0,01 y 0,05 ppm) sobre larvas de Ae. aegypti. Para tal fin, se realizaron seis ensayos sucesivos: El ensayo inicial (semana 0) y después a 1, 2, 4, 6 y 8 semanas post-tratamiento al agua. Según los resultados obtenidos, la actividad residual del producto con la concentración de 0,05 ppm, fue bastante satisfactoria durante 8 semanas (60 días) post-tratamiento, obteniéndose valores del porcentaje de Inhibición de la Emergencia (% IE) de 77%. Sin embargo, tanto a 0,002 ppm como a 0,01 ppm, su eficacia disminuyó considerablemente a partir de la primera y segunda semana post-tratamiento. La mortalidad en la fase de pupa fue mucho mayor que la mortalidad larval a todas las concentraciones probadas. Asimismo, en otro experimento se evaluó el efecto del aumento de la densidad de larvas expuestas, sobre la eficacia del producto a la misma concentración de 0,05 ppm. La densidad larvaria no afectó la eficacia del producto; ya que no hubo diferencias estadísticamente significativas entre tratamientos o densidades probadas. El análisis estadístico no reveló ninguna relación significativa entre densidad larvaria y mortalidad de pupas o inhibición de la emergencia de adultos de Ae. aegypti. Según lo cual, se concluye que al aumentar progresivamente la cantidad de larvas a tratar, no disminuye la mortalidad de pupas, ni la inhibición de emergencia de adultos, por lo que no se afecta negativamente la eficacia del producto.
Palabras clave: Análogos de la hormona juvenil, Reguladores de crecimiento, pyriproxyfen, control bioquímico, larvas, pupas, Aedes aegypti, vectores, dengue.
Efficacy and residual activity of insect growth regulator pyriproxyfen on larvae of Aedes aegypti (Diptera: Culicidae) under laboratory conditions
SUMMARY
Pyriproxyfen is a synthetic juvenile hormone analogue and it has been widely used in mosquito control. This re search paper describes experiments or trials carried out under laboratory conditions with a granular formulation of pyriproxyfen (Sumilarv -G 0.5% in granules), using IV instars larvae of Aedes aegypti. This is a granular formulation of pyriproxyfen with 0.5% of active ingredient. The efficacy and residual activity of pyriproxyfen were evaluated on larvae and pupae of Ae. aegypti using three final concentrations: 0.002, 0.01 and 0.05 ppm; at (initial day = week 0) and at 1, 2, 4, 6 and 8 weeks after treatment (post-treatment). According to the results, the efficacy of pyriproxyfen was very satisfactory during 8 weeks (60 days) post-treatment, using 0.05 ppm of pyriproxyfen with 77% (% IE). It was observed that mortality in the pupa stage was higher than larvae mortality for all three concentrations. However, the percentage of IE in treated water diminished after the initial week (week 0) to 56.7 % (0.002 ppm) and after first week to 98.8 % (0.01ppm). The other aim of the study was to evaluate the efficacy of pyriproxyfen at 0.05 ppm, in relation to the larval density of Aedes aegypti under laboratory conditions. Five larval densities: 25, 50, 75, 100 and 125 larvae, were evaluated at 0.05 ppm. The statistical analysis not revealed significant differences between these densities, and did not reveal a relationship between the mosquito larval density and pupae mortality of Ae. aegypti. Whereby, it is concluded that by progressively increasing the number of larvae treated, mortality of pupae or adult emergence inhibition do not decrease, therefore it does not adversely affect the product performance.
Key words: Insect growth regulators, juvenile hormone analogues, pyriproxyfen, biochemical control, Aedes aegypti, larvae, pupae, vectors, dengue.
Recibido el 30/03/2012 Aceptado el 09/03/2013
INTRODUCCIÓN
Dentro del grupo de los insecticidas bioquímicos se encuentran los reguladores del crecimiento de insectos (IGRs: Insect growth regulators). Estas sustancias son clasificadas como: hormonas mímicas o análogas sintéticos de la hormona juvenil, inhibidores del desarrollo, inhibidores de la muda e inhibidores de la síntesis de quitina. La acción fundamental de los reguladores de crecimiento, se basa en la interrupción del normal crecimiento y desarrollo, inhibiendo la emergencia de adultos y/o afectando la normal reproducción del insecto adulto (Berti & Zimmerman, 1998). Estos son considerados compuestos biológicamente específicos, no tóxicos al hombre o a los mamíferos, biodegradables y menos propensos al desarrollo de resistencia (Mulla et al., 1974, 1985, 1986; Aguilera et al., 2001).
El metopreno fue el primer regulador de crecimiento registrado comercialmente para el control de mosquitos, es análogo sintético de la hormona juvenil y es muy usado en EE.UU. para el control de vectores (Berti & Zimmerman, 1998). La actividad biológica y química de la hormona juvenil y sus análogos fue ampliamente discutida por Menn & Beroza (1972). En los insectos, durante su metamorfosis, las mudas tienen lugar de un estadio larval al otro, siempre en presencia de altos valores de la hormona juvenil y la ecdisona (Bower, 1971). Un exceso de ecdisona causa la muda. En cambio, valores muy altos de la hormona juvenil mantienen al mosquito en su estado normal (Bower, 1971). Cuando el insecto alcanza el punto crítico de su metamorfosis para pasar de larva a la fase pupa, los valores de la hormona juvenil bajan e igualmente cuando se produce la ultima muda y tiene lugar la emergencia del adulto (Arias, 1973; Bower, 1971).
En muchos insectos el desarrollo del huevo también está bajo la influencia de la hormona juvenil. Existen evidencias de que esta hormona estimula el proceso de vitelo-génesis o síntesis del vitelo (Chen et al., 1976; Engelmann, 1970). En el mosquito adulto, el desa rrollo de los huevos se produce cuando la hembra realiza su comida sanguínea, esta alimentación estimula la liberación de una hormona del cerebro, llamada hormona neuro-secretora del desarrollo del huevo (Lea, 1972; Engelmann, 1970). Esta hormona estimula al ovario para liberar la ecdisona, la cual actúa sobre el cuerpo graso causando la síntesis del vitelo o vitelo-génesis (Hagedorn & Fallon, 1973; Lea, 1972).
La emergencia del adulto de Anopheles stephensi, fue inhibida por efecto del metopreno y de extractos de la hormona juvenil de áfidos (Dash & Ranjit, 1992). Asimismo, los adultos sobrevivientes que lograron emerger después de exponer las larvas de la especie a la concentración letal 50 (CL50%) del producto presentaron una clara reducción de su fecundidad y fertilidad (Dash & Ranjit, 1992). Por otro lado, Arias y Mulla (1975) comprobaron que las hembras resultantes de aquellas larvas de Culex tarsalis tratadas con metopreno a la dosis de 0,4 ppb, presentaron una reducción de 43% en la producción de huevos en comparación con las que no fueron tratadas; asimismo, observaron la presencia de malformaciones y anomalías en adultos de Cx. tarsalis que lograron emerger después de exponer las larvas a una concentración sub-letal del producto (Arias & Mulla, 1975). En Venezuela, también con una concentración sub-letal del producto, se observó presencia de malformaciones en adultos de Anopheles albimanus y se comprobó que las hembras sobrevivientes presentaron una clara reducción de su fertilidad (Berti & Navarro, 2008; Navarro et al.,2007).
En la década de los 80, fue sintetizado en Japón el regulador de crecimiento Pyriproxifen, el cual también es un análogo sintético de la hormona juvenil (Berti & Zimmerman, 1998); este actúa sobre la fisiología de la morfogénesis, reproducción y embriogénesis del mosquito. En Japón, su efecto fue evaluado en condiciones de campo sobre larvas del vector de malaria Anopheles farauti, con excelentes resultados (Susuki et al., 1989). En otro estudio de campo, cinco pozos (charcos) que contenían larvas de Anopheles punctimaculatus fueron tratados con cuatro concentraciones de pyriproxyfen. El Pozo I y el II a 0,1 ppm; el Pozo III a 0,05 ppm; el Pozo IV a 0,02 ppm y el Pozo V a 0,01 ppm. La mortalidad ocurrió principalmente durante la fase de pupa o durante la emergencia del adulto. La emergencia del adulto (% IE) fue inhibida completamente durante dos meses a la dosis de 0,1 ppm; durante un mes a la concentración de 0,05 ppm y por 20 días a las concentraciones de 0,02 ppm y 0,01 ppm (Okazawa et al. 1991). Pyriproxyfen es altamente activo contra gran variedad de insectos, incluyendo pulgas, moscas domésticas, moscas tse-tsé, cucarachas y hormigas (Hirano et al., 1998). Estudios con pyriproxyfen realizados bajo condiciones de laboratorio, han demostrado altos niveles de actividad residual contra Aedes aegypti (Estrada & Mulla, 1986). Este producto tiene mayor actividad tóxica que metopreno, el mismo fue mucho más tóxico que metopreno, cuando ambos se probaron contra larvas y pupas de Aedes albopictus, Ae. aegypti, Anopheles quadrimaculatus, Culex nigripalpus y Ochleretatus taeniorhynchus en Florida, EE.UU. (Nayar et al., 2002).
En Venezuela, se realizaron estudios sobre la duración de la actividad tóxica de metopreno (Altosid-G, 1,5%) sobre An. albimanus W. Esta formulación presentó una corta actividad residual sobre pupas de An. albimanus. Al aumentar la perma nencia del producto en el agua tratada (15, 30 y 60 días post-tratamiento) se afectó negativamente su eficacia (Berti y Navarro, 2008; Navarro et al., 2008). También en el país, Suárez (2008) realizó la evaluación de la actividad residual de pyriproxyfen sobre larvas de Aedes aegypti a dos concentraciones, obteniéndose muy buenos resultados a la concentración de 0,05 ppm, con porcentajes de Inhibición de la Emergencia (% IE) mayores del 90% durante las cuatro primeras semanas y comprobándose la eficacia del producto durante 60 días (Suárez, 2008). Otros autores, (Oviedo et al., 2007; Suárez, 2008) observaron la presencia de malformaciones y anomalías en adultos de Ae. aegypti que lograron emerger después de que las larvas fueron expuestas a una concentración sub-letal de pyriproxyfen.
En los últimos años, el uso indiscriminado de insecticidas a nivel mundial ha generado una fuerte presión de selección en las poblaciones de mosquitos, desarrollándose poblaciones con individuos genéticamente resistentes a compuestos químicos. Ante esta situación, se presenta la alternativa del uso de reguladores de crecimiento; sobre todo debido a la disminución de la susceptibilidad al abate (Temephos) y aparición de resistencia en poblaciones de Ae. aegypti de Brasil (Braga et al., 2004), Cuba (Rodríguez et al., 2006) y Venezuela; donde se refiere una población de Ae. aegypti resistente al temephos en Paramito, estado Trujillo (Álvarez et al., 2006). En consecuencia, debemos considerar la alternativa de aplicar insecticidas bioquímicos como pyriproxifen, dentro de la estrategia de manejo integrado de este vector. El propósito de este trabajo fue evaluar bajo condiciones de laboratorio la eficacia y acción residual de pyriproxyfen (Formulación: Sumilarv G-0,5%) contra Ae. aegypti, a las concentraciones de 0,002; 0,01 y 0,05 ppm del ingrediente activo, y durante 0, 1, 2, 4, 6 y 8 semanas post-tratamiento; también se intenta determinar el efecto del aumento de la densidad larval sobre la eficacia del producto a la concentración de 0,05 ppm.
MATERIALES Y MÉTODOS
En todos los bioensayos se utilizaron larvas del IV instar temprano (entre 0-16 h después de la muda), las cuales se obtuvieron de la progenie de hembras provenientes de la población colonizada de Ae. aegypti. La población inicial de esta colonia proviene de hembras y larvas capturadas en La Cooperativa, Maracay; colonia que fue mantenida durante cinco años en el Centro de Estudio de Enfermedades Endémicas y Salud Ambiental del IAE Dr. Arnoldo Gabaldon. En la cría de larvas y la preparación de todas las soluciones se utilizó agua mineral de consumo humano embotellada en envases de plástico de 18 litros de capacidad. Las condiciones ambientales para la cría de larvas y para la realización de cada bioensayo fueron las siguientes: temperatura de 29 ± 4ºC; la humedad relativa de 80 ± 5% y el foto periodo de 12:12 hrs (luz: oscuridad).
El producto utilizado (Sumilarv G-0,5%) es una formulación sólida y granulada con el 0,5 % de ingrediente activo (Pyriproxyfen: S-31183). Se probaron tres concentraciones (0,002; 0,01 y 0,05 ppm) usando larvas de IV estadio temprano de Ae. aegypti, que después de ser expuestas en envases plásticos a las respectivas concentraciones se colocaban en observación (de tres a cuatro días) en estos mismos envases, hasta alcanzar la fase de pupa y/o adulto. Para tal fin, se utilizaron envases plásticos circulares de 20 x 5 cm, donde se agregó 1000 mL por cada envase tratado de la respectiva concentración (0,002; 0,01 y 0,05 ppm.). Se calcularon los siguientes parámetros para cada concentración: porcentaje de mortalidad larval, porcentaje de mortalidad de pupas, porcentaje de pupas formadas, porcentaje de mortalidad total, porcentaje de emergencia de adultos y porcentaje de inhibición de la emergencia de adultos (% IE). También en el grupo control, salvo el porcentaje de inhibición de la emergencia de adultos (% IE), el cual solo se puede calcular para las larvas expuestas a la respectiva concentración.
Obtención de las larvas experimentales
Se colocaron machos y hembras provenientes de la colonia, dentro de cestos o jaulas de metal de 19 x 29 x 32 cm, se suministró un algodón empapado en miel de abeja diluida en agua como fuente de alimento. En estas jaulas se llevó a cabo el apareamiento de adultos de ambos sexos. Las jaulas están recubiertas casi totalmente de tela metálica, salvo en la parte superior, que cuenta con una malla fina de tul, donde se inmovilizó una paloma que se colocó con la parte dorsal descubierta, de modo que se permitiera su contacto a través del tul con las hembras y poder cumplir con su alimentación. Una vez alimentadas y apareadas, en el fondo de estas jaulas se colocaron pedazos de papel de filtro humedecido con agua para mantener la humedad relativa y estimular la ovoposición. Después se esperaron tres días para iniciar el retiro y conteo de huevos. Cada día se extraía el papel de filtro con las posturas, se procedía al conteo de huevos y se sustituía este papel por uno limpio. Las larvas emergidas de estos huevos, fueron utilizadas para la realización de los respectivos bioensayos. Estas fueron alimentadas con la misma fórmula usada en la alimentación de larvas de An. albimanus y An. aquasalis (Berti & Navarro, 2008).
El alimento consistió de la mezcla de Ictiosan ® (alimento para peces, 55 %), levadura de cerveza (15 %), avena (7,5 %), germen de trigo (7,5 %) e hígado de res deshidratado en polvo (15 %). El cual se suministraba cada día entre 8:00 y 8:30 hrs; para lo cual se agregaban 20 mg de la mezcla en cada envase con larvas, tanto en envases tratados como en los controles.
Preparación de las soluciones a las respectivas concentraciones
Se realizaron diluciones de 8 mg de Pyriproxyfen al 0,5% en 20 litros de agua mineral potable para obtener la concentración de 0,002 ppm; 40 mg/20 litros para la concentración de 0,01 ppm y de 200 mg/20 litros para la concentración de 0,05 ppm. Cada una de estas concentraciones fue preparada y almacenada en pipotes plásticos de 25 litros de capacidad. Adicionalmente se dejaba otro pipote, pero solo con agua mineral como control para cada ensayo.
Determinación de la residualidad de piriproxyfen a tres concentraciones
Para tal fin, se realizaron seis ensayos sucesivos: el primer día (ensayo inicial = semana 0) y a 1, 2, 4, 6 y 8 semanas del tratamiento, es decir, que a 1, 2, 4, 6 y 8 semanas después del tratamiento inicial, se colocaron nuevas larvas, tanto en los envases tratados como en los controles. Se utilizaron envases plásticos circulares de 20 x 5 cm, donde se agregó 1000 ml de la respectiva concentración en cada envase por cada repetición.
El número de repeticiones por concentración fue de cuatro. En cada ensayo (0, 1, 2, 4, 6 y 8 semanas post-tratamiento) fueron establecidas 4 repeticiones por tratamiento (0,002, 0,01 y 0,05 ppm) y 4 por control. En cada ensayo (6 ensayos sucesivos) se dispuso de 4 unidades experimentales de 25 larvas por repetición de cada concentración probada y 4 unidades experimentales adicionales del control.
Una vez esperado el día previsto (0, 7, 15, 30, 45, 60 días) se colocaron de forma simultánea 25 larvas del IV estadio temprano en cada envase por repetición (tanto del control como del grupo tratado). Diariamente se procedió a registrar la mortalidad tanto en cada grupo tratado como en el control, mediante el conteo de larvas y pupas muertas. La mortalidad larvaria se registró a partir del primer día de la exposición.
La mortalidad de pupas sólo fue registrada a partir del tercer día de exponer las larvas al producto. Con los datos obtenidos para las tres concentraciones, se calcularon después los siguientes parámetros: 1- Porcentaje de mortalidad de larvas = [(Lm/L expuestas) x 100], donde Lm= larvas muertas; 2- Porcentaje de mortalidad de pupas = [(Pm/Pm+ ad) x 100], donde Pm= pupas muertas; 3- % de inhibición de emergencia de adultos (% IE) = (100-(100-E/C) donde, E = % de emergencia de expuestos; C = % de emergencia del control. También se calcularon para cada grupo control, porcentaje de mortalidad larval, porcentaje de pupas formadas, porcentaje de mortalidad de pupas, porcentaje de mortalidad total y porcentaje de emergencia de adultos. El porcentaje de inhibición de la emergencia de adultos (% IE) solo se puede calcular para las larvas expuestas. En cada tratamiento se determinó el porcentaje de inhibición de emergencia de adultos (% IE) y se aplicó un análisis de varianza con un solo criterio de clasificación o de una vía. Los porcentajes de inhibición de emergencia fueron transformados a arcoseno, para normalizar los datos y luego aplicar las pruebas de separación de medias de Duncan y del mínimo rango significativo con un nivel de significación del 5 %. La mortalidad observada fue corregida con la mortalidad del control, sólo en los casos en que ésta excedió el 5 % y según la fórmula siguiente: % Mortalidad corregida = (X-Y / X) x 100, donde X = Porcentaje de larvas vivas en el control, e Y = Porcentaje de larvas vivas en el tratamiento.
Determinación del efecto del aumento de la densidad larvaria sobre la eficacia de piriproxyfen
Con la finalidad de determinar el efecto del aumento de la densidad larvaria sobre la eficacia del producto y analizar si existe disminución del porcentaje de mortalidad de pupas en función del aumento de la densidad larval, se realizó el experimento de exponer las larvas de Ae. aegypti con la concentración de 0,05 ppm, la cual se aplicó en los mismos envases plásticos; para después agregar a los mismos diferentes densidades larvarias. Las densidades probadas (tratamientos) fueron de 25, 50, 75, 100 y 125 larvas por litro en cada envase tratado (0,05 ppm). Las larvas se colocaron de forma simultánea para todos los tratamientos y cada grupo control, que solo contenía la respectiva cantidad de larvas (25, 50, 75, 100 y 125 larvas) por litro de agua mineral. Se aplicó un diseño experimental completamente aleatorizado o aleatorio, se prepararon cuatro repeticiones por tratamiento (densidad) y tres repeticiones en el control de cada densidad. La mortalidad larvaria se registró a partir del primer día de exposición y la mortalidad de pupas fue registrada a partir del tercer día de exponer larvas al producto. En cada repetición de los tratamientos y controles, se determinó el porcentaje de mortalidad de pupas. Se aplicó un análisis de varianza con un solo criterio de clasificación o de una vía; y después un análisis de pruebas de separación de medias de Duncan y del mínimo rango significativo con un nivel de significación del 5 %; antes de la aplicación del ANOVA, estos porcentajes de mortalidad fueron transformados a arcoseno, a fin de normalizar los datos. No se aplicó el factor de corrección de
mortalidad, ya que la misma siempre fue igual o menor del 5% en cada grupo control.
RESULTADOS
Los resultados obtenidos confirman la eficacia y actividad residual prolongada de pyriproxyfen a la concentración de 0,05 ppm (Tabla III). Según los mismos, la actividad residual del producto con esta concentración fue bastante satisfactoria durante 8 semanas (60 días) post-tratamiento, obteniéndose valores del porcentaje de Inhibición de la Emergencia (% IE) superiores al 98 % tanto el día inicial (semana 0) como en la primera semana (Tabla III); después en las semanas 2 y 4 post-tratamiento, este valor fue de 98,9 % IE y 88 % IE respectivamente; en la semana 6, el valor aumentó a 91,8% IE y finalmente en la semana 8, disminuyó a 77% IE(Tabla III). Según estos resultados, la eficacia durante las 6 primeras semanas fue muy alta, ya que sus valores fluctuaron entre 88% (semana 4) y 98,9 % (semana 2). A la concentración de 0,01 ppm, el producto fue eficaz solamente durante una semana con 98,98% de Inhibición de la Emergencia (Tabla II). En cambio, con la concentración de 0,002 ppm, solo fue eficaz en la semana inicial (Semana 0); ya que solo produjo 56,7 % de inhibición de emergencia en la primera semana (Tabla I). Según estos resultados, al aumentar la perma nencia del producto en el agua tratada, se afectó negativamente su eficacia, tanto a la concentración de 0,002 como a la concentración de 0,01 ppm (Tabla I y Tabla II). La mortalidad en la fase de pupa, fue mayor que la mortalidad larval a todas las concentraciones probadas (Tablas I, II y III). La mortalidad, tanto de larvas como de pupas fue menor del 5%, en los grupos control de todas las semanas de evaluación (Tabla IV). En conclusión esta formulación presenta una alta residualidad sobre larvas de Ae. aegypti a la concentración de 0,05 ppm, manteniendo su eficacia durante 8 semanas (60 días) post-tratamiento. Con las demás concentraciones probadas tiene muy corta actividad residual.
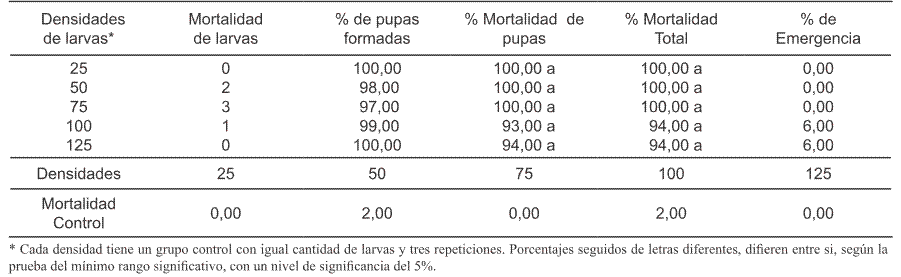
Por otra parte, el aumento de la densidad larvaria a la concentración de 0,05 ppm no afectó negativamente la eficacia del producto; ya que el porcentaje de mortalidad de pupas a las densidades de 25, 50 y 75 larvas fue del 100%, de 93% con 100 larvas/litro y de 94% con 125/litro (Tabla V). El análisis de varianza no mostró diferencias significativas entre las medias de los tratamientos (F = 4,53; g.l. = 4, 10; P<0,05) a un nivel de confiabilidad del 95%. Es decir, no hubo diferencias estadísticamente significativas entre las densidades. Este resultado sugiere que al aumentar progresivamente la cantidad de larvas a tratar con pyriproxyfen (0,05 ppm), no disminuyó la mortalidad de pupas como se esperaba y tampoco se afectó negativamente la eficacia del producto.
Asimismo, el aumento de la densidad larvaria en el grupo control, tampoco afectó negativamente la sobrevivencia de las pupas de Ae. aegypti (Tabla V). Este resultado permite rechazar la hipótesis de que el aumento de la densidad larval aumentaría la Inhibición de la Emergencia (% IE) superiores al 98 % tanto el día inicial (semana 0) como en la primera semana (Tabla III); después en las semanas 2 y 4 post-tratamiento, este valor fue de 98,9 % IE y 88 % IE respectivamente; en la semana 6, el valor aumentó a 91,8% IE y finalmente en la semana 8, disminuyó a 77% IE(Tabla III). Según estos resultados, la eficacia durante las 6 primeras semanas fue muy alta, ya que sus valores fluctuaron entre 88% (semana 4) y 98,9 % (semana 2). A la concentración de 0,01 ppm, el producto fue eficaz solamente durante una semana con 98,98% de Inhibición de la Emergencia (Tabla II). En cambio, con la concentración de 0,002 ppm, solo fue eficaz en la semana inicial (Semana 0); ya que solo produjo 56,7 % de inhibición de emergencia en la primera semana (Tabla I). Según estos resultados, al aumentar la perma nencia del producto en el agua tratada, se afectó negativamente su eficacia, tanto a la concentración de 0,002 como a la concentración de 0,01 ppm (Tabla I y Tabla II). La mortalidad en la fase de pupa, fue mayor que la mortalidad larval a todas las concentraciones probadas (Tablas I, II y III). La mortalidad, tanto de larvas como de pupas fue menor del 5%, en los grupos control de todas las semanas de evaluación (Tabla IV). En conclusión esta formulación presenta una alta residualidad sobre larvas de Ae. aegypti a la concentración de 0,05 ppm, manteniendo su eficacia durante 8 semanas (60 días) post-tratamiento. Con las demás concentraciones probadas tiene muy corta actividad residual.
Por otra parte, el aumento de la densidad larvaria a la concentración de 0,05 ppm no afectó negativamente la eficacia del producto; ya que el porcentaje de mortalidad de pupas a las densidades de 25, 50 y 75 larvas fue del 100%, de 93% con 100 larvas/litro y de 94% con 125/litro (Tabla V). El análisis de varianza no mostró diferencias significativas entre las medias de los tratamientos (F = 4,53; g.l. = 4, 10; P<0,05) a un nivel de confiabilidad del 95%. Es decir, no hubo diferencias estadísticamente significativas entre las densidades. Este resultado sugiere que al aumentar progresivamente la cantidad de larvas a tratar con pyriproxyfen (0,05 ppm), no disminuyó la mortalidad de pupas como se esperaba y tampoco se afectó negativamente la eficacia del producto.
Asimismo, el aumento de la densidad larvaria en el grupo control, tampoco afectó negativamente la sobrevivencia de las pupas de Ae. aegypti (Tabla V). Este resultado permite rechazar la hipótesis de que el aumento de la densidad larval aumentaría la sobrevivencia de pupas tratadas, por lo que afectaría negativamente la eficacia del producto.
DISCUSIÓN
Se comprobó una prolongada actividad residual de pyriproxyfen contra Ae. aegypti a la concentración de 0,05 ppm. La eficacia durante las 6 primeras semanas fue muy alta, ya que sus valores fluctuaron entre 88% IE (semana 4) y 98,9 % IE (semana 2). Estos resultados confirman una residualidad prolongada del producto durante las 6 primeras semanas, pero solamente a la concentración de 0,05 ppm (Tabla III). En Venezuela, Suárez et al. (2011) obtienen resultados muy similares con la misma concentración (0,05 ppm), según estos autores la acción residual del producto arrojó valores de Inhibición de Emergencia de Ae. aegypti, superiores al 90% durante las cuatro primeras semanas, para después disminuir a valores entre 59% IE y 73 % IE a partir de la semana 8. Los mismos autores, también señalaron una mayor mortalidad en la fase de pupa, resultado que coincide con el presente trabajo (Tablas I, II, III). Por otra parte, Carvalho de Resende & Antonaci Gama (2006) en ensayos de laboratorio en Brasil, señalaron una actividad residual muy prolongada sobre larvas de Aedes aegypti a la dosis de 0,05 ppm; con valores del porcentaje de Inhibición de la Emergencia, entre 99 % y 100 % IE a 60 días (8 semanas) post-tratamiento y entre 68,5% y 98 % IE a 120 días post-tratamiento (16 semanas); resultados que difieren del presente trabajo. Probablemente esto se deba a que se trata de una población colonizada de Ae. aegypti que es altamente susceptible a este producto.
En estudios de campo, fueron tratados cinco pozos (charcos) que contenían larvas de An. punctimaculatus, con cuatro dosis de pyriproxyfen. Pozos I y II a 0,1 ppm; el Pozo III a 0,05 ppm; el Pozo IV a 0,02 ppm y el Pozo V a 0,01 ppm. La emergencia del adulto (% IE) fue inhibida completamente durante dos meses a la dosis de 0,1 ppm; durante un mes a la concentración de 0,05 ppm y por 20 días a 0,02 ppm y 0,01 ppm (Okazawa et al., 1991). Por otro lado, en Corea del Sur, fue evaluada su eficacia a dosis de 0,05 ppm contra Aedes togoi (Theobald) en criaderos de alta salinidad, obteniéndose excelentes resultados, con porcentajes de mortalidad de pupas de 100% hasta 40 días post-tratamiento y 74,6% a 51 días del tratamiento (Dong-Kyu, 2001). La eficacia del producto disminuye en condiciones de campo, debido a los factores climáticos adversos y parámetros físico-químicos del agua, lo cual obliga a incrementar las dosis de aplicación.
Tabla I. Porcentaje de mortalidad de larvas, porcentaje de mortalidad de pupas, porcentajes de emergencia de adultos (larvas expuestas y controles) y porcentaje de Inhibición de la Emergencia de adultos (% IE) después del tratamiento al agua con pyriproxyfen a la concentración de de 0,002 ppm.
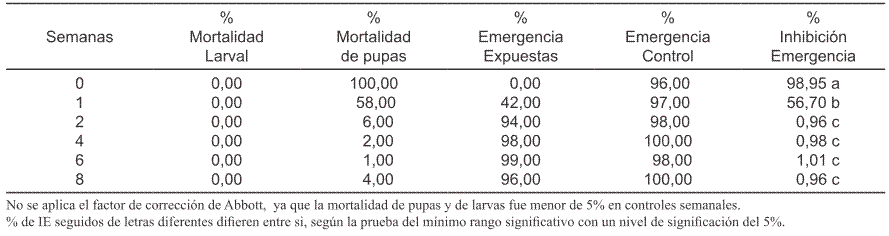
Tabla II. Porcentaje de mortalidad de larvas, porcentaje de mortalidad de pupas, porcentajes de emergencia de adultos (larvas expuestas y controles) y porcentaje de Inhibición de la Emergencia de adultos (% IE) después del tratamiento al agua con pyriproxyfen a la concentración de 0,01 ppm.
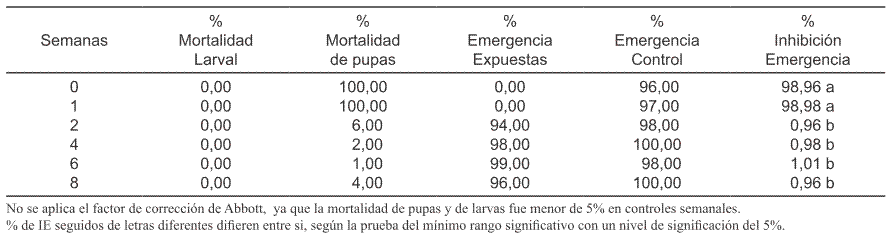
Tabla III. Porcentaje de mortalidad de larvas, porcentaje de mortalidad de pupas, porcentajes de emergencia de adultos (larvas expuestas y controles) y porcentaje de Inhibición de la Emergencia de adultos (% IE) después del tratamiento al agua con pyriproxyfen a la concentración de 0,05 ppm.
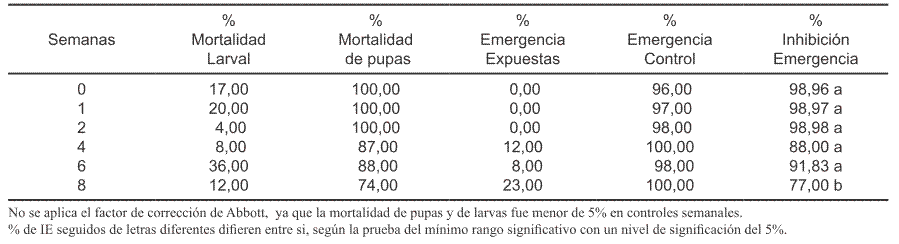
Tabla IV. Porcentaje de mortalidad de larvas y pupas, porcentaje de pupas formadas (vivas), porcentaje de mortalidad total y porcentaje de emergencia de adultos en los grupos control (sin tratamiento) de las semanas 0, 1, 2, 4, 6 y 8 post-tratamiento.
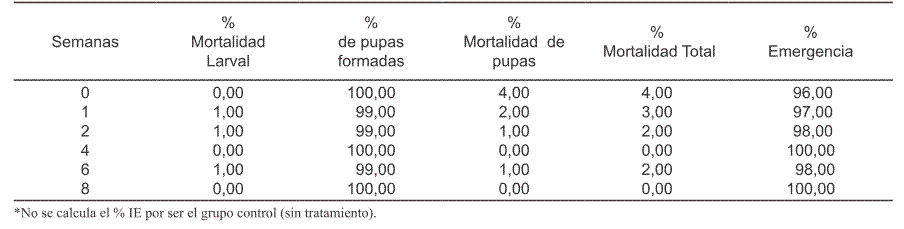
Tabla V. Porcentaje de mortalidad de larvas, Porcentaje de mortalidad de pupas, porcentaje de pupas formadas (vivas), porcentaje de mortalidad total y porcentaje de emergencia de adultos a diferentes densidades de larvas tratadas con pyriproxyfen a una concentración de 0,05 ppm.
REFERENCIAS
1.Aguilera L., Marquetti M. & Navarro A. (2001). Actividad biológica del diflubenzuron sobre Blattella germánica (Dictyoptera: Blattellidae). Rev. Cuban. Med. Trop. 53: 48-52. [ Links ]
2.Álvarez L., Briceño A. & Oviedo M. (2006) Resistencia al Temephos en poblaciones de Aedes aegypti (Dipera: Culicidae) del occidente de Venezuela. Rev. Colomb. Entomol. 32: 172-175.
[ Links ]
3.Arias J. (1973). Biophysiological activity of insect growth regulators against mosquitoes (Dissertation). Tesis Doctoral. Riverside California Univ. California, USA. [ Links ]
4.Arias J. & Mulla S. (1975). Morphogenetic aberrations induced by a juvenile hormone analogue in the mosquito Culex tarsalis (Diptera: Culicidae). J. Med. Entomol. 12: 309-16. [ Links ]
5.Berti J. & Zimmerman R. (1998). Métodos para el REFERENCIAS Aguilera L., Marquetti M. & Navarro A. (2001). Actividad biológica del diflubenzuron sobre Blattella germánica (Dictyoptera: Blattellidae). Rev. Cuban. Med. Trop. 53: 48-52. [ Links ]
6.Álvarez L., Briceño A. & Oviedo M. (2006) Resistencia al Temephos en poblaciones de Aedes aegypti (Dipera: Culicidae) del occidente de Venezuela. Rev. Colomb. Entomol. 32: 172-175. [ Links ]
7.Arias J. (1973). Biophysiological activity of insect growth regulators against mosquitoes (Dissertation). Tesis Doctoral. Riverside California Univ. California, USA.
[ Links ]
8.Arias J. & Mulla S. (1975). Morphogenetic aberrations induced by a juvenile hormone analogue in the mosquito Culex tarsalis (Diptera: Culicidae). J. Med. Entomol. 12: 309-16. [ Links ]
9.Berti J. & Zimmerman R. (1998). Métodos para el control integrado de los vectores de la malaria en Venezuela. Bol. Malariol. San. Amb. 38: 123-136. [ Links ]
10.Berti J. & Navarro E. (2008). Efectividad y persistencia de la actividad letal de metopreno sobre pupas de Anopheles albimanus (Diptera: Culicidae). Rev. Biomed. 19: 27-34.
[ Links ]
11.Bower W. S. (1971). Insect hormones and their derivates as in secticides. Bull. World. Health Org. 44: 381-89.
12. [ Links ]Braga I., Pereira J., Da Silva S. & Valle D. (2004). Aedes aegypti resistance to Temephos during 2001 in several municipalities in the state of Rio de Janeiro, Sergipe, and Halagaos, Brazil. Mem. Inst. Oswaldo Cruz. 99: 199-203. [ Links ]
13.Carvalho de Resende M. & Antonaci Gama R. (2006).Persistencia e eficacia do regulador de crescimento pyriproxyfen en condicoes de laboratorio para Aedes aegypti. Rev. Socied. Bras. Med. Trop. 39: 72-75.
[ Links ]
14.Chen T., Couble P., De Lucca F. & Wyatt G. (1976). The Juveniles Hormones. New York: Plenum Press. New York, USA. [ Links ]Dash A. & Ranjit M. (1992). Comparative efficacy of aphid extracts and some juvenoids against the development of mosquitoes. J. Am. Mosq. Contr. Assoc. 8: 247-51.
15.Dong-Kyu L. (2001). Field evaluation of an insect growth regulator, pyriproxyfen, against Aedes togoi larvae in brackish water in South Korea. J. Vector Ecol. 26: 39-42.
16.Estrada J. & Mulla M. (1986). Evaluation of two new Insect growth regulators against mosquitoes in the laboratory. J. Am. Mosq. Contr. Assoc. 2: 57-60.
17.Engelmann F. (1970). The Physiology of Insect Reproduction. New York: Pergamon Press. New York, USA.
18.Hagedorn H. & Fallon A. (1973). Ovarian control of vitellogenin synthesis by the fat body in Aedes aegypti. Nature. 244: 103-05.
19.Hirano M., Hatakoshi M., Kawada H. & Takimoto Y. (1998). Pyriproxifen and other juvenile hormone analogues. Rev. Toxicol. 2: 357-394.
20.Lea A. (1972). Regulation of egg maturation in the mosquito by the neurosecretory system: The role of the corpus cardia cum. Gen. Comp. Endocrin. 8 (Suppl 3): 602-608.
21.Menn J. & Beroza M. (1972). Insect Juvenile Hormones. Chemis try and action. New York Academic. New York, USA.
22.Mulla M., Barnard D. & Norland R. (1974). Insect growth regulators against mosquitoes with notes on nontarget organisms. J. Am. Mosq. Contr. Assoc. 2: 314-320.
23.Mulla M., Darwazeh H., Ede L. & Kennedy B. (1985). Laboratory and field evaluation of the insect growth regulator fenoxycarb against mosquitoes. J. Am. Mosq. Contr. Assoc. 1: 442-448.
24.Mulla M., Darwazeh H., Kennedy B. & Dawson, D. (1986). Insect growth regulators in vector control. J. Econ. Entomol. 67: 329-332.
25.Navarro E., Berti J. & González J. (2007). Efecto del metopreno sobre la fecundidad y fertilidad control integrado de los vectores de la malaria en Venezuela. Bol. Malariol. San. Amb. 38: 123-136.
26.Berti J. & Navarro E. (2008). Efectividad y persistencia de la actividad letal de metopreno sobre pupas de Anopheles albimanus (Diptera: Culicidae). Rev. Biomed. 19: 27-34.
27.Bower W. S. (1971). Insect hormones and their derivates as in secticides. Bull. World. Health Org. 44: 381-89.
28.Braga I., Pereira J., Da Silva S. & Valle D. (2004). Aedes aegypti resistance to Temephos during 2001 in several municipalities in the state of Rio de Janeiro, Sergipe, and Halagaos, Brazil. Mem. Inst. Oswaldo Cruz. 99: 199-203.
29.Carvalho de Resende M. & Antonaci Gama R. (2006). Persistencia e eficacia do regulador de crescimento pyriproxyfen en condicoes de laboratorio para Aedes aegypti. Rev. Socied. Bras. Med. Trop. 39: 72-75.
30.Chen T., Couble P., De Lucca F. & Wyatt G. (1976). The Juveniles Hormones. New York: Plenum Press. New York, USA.
31.Dash A. & Ranjit M. (1992). Comparative efficacy of aphid extracts and some juvenoids against the development of mosquitoes. J. Am. Mosq. Contr. Assoc. 8: 247-51.
32.Dong-Kyu L. (2001). Field evaluation of an insect growth regulator, pyriproxyfen, against Aedes togoi larvae in brackish water in South Korea. J. Vector Ecol. 26: 39-42.
33.Estrada J. & Mulla M. (1986). Evaluation of two new Insect growth regulators against mosquitoes in the laboratory. J. Am. Mosq. Contr. Assoc. 2: 57-60.
34.Engelmann F. (1970). The Physiology of Insect Reproduction. New York: Pergamon Press. New York, USA.
35.Hagedorn H. & Fallon A. (1973). Ovarian control of vitellogenin synthesis by the fat body in Aedes aegypti. Nature. 244: 103-05.
36.Hirano M., Hatakoshi M., Kawada H. & Takimoto Y. (1998). Pyriproxifen and other juvenile hormone analogues. Rev. Toxicol. 2: 357-394.
37.Lea A. (1972). Regulation of egg maturation in the mosquito by the neurosecretory system: The role of the corpus cardia cum. Gen. Comp. Endocrin. 8 (Suppl 3): 602-608.
38.Menn J. & Beroza M. (1972). Insect Juvenile Hormones. Chemis try and action. New York Academic. New York, USA.
39.Mulla M., Barnard D. & Norland R. (1974). Insect growth regulators against mosquitoes with notes on nontarget organisms. J. Am. Mosq. Contr. Assoc. 2: 314-320.
40.Mulla M., Darwazeh H., Ede L. & Kennedy B. (1985). Laboratory and field evaluation of the insect growth regulator fenoxycarb against mosquitoes. J. Am. Mosq. Contr. Assoc. 1: 442-448.
41.Mulla M., Darwazeh H., Kennedy B. & Dawson, D. (1986). Insect growth regulators in vector control. J. Econ. Entomol. 67: 329-332.
42.Navarro E., Berti J. & González J. (2007). Efecto del metopreno sobre la fecundidad y fertilidad de hembras de Anopheles albimanus Wiedemann (Diptera: Culicidae), expuestas en fase de larva a una concentración sub-letal del producto. Bol. Malariol. Salud Amb. 47: 249-251.
43.Navarro E., Berti J. & González J. (2008). Efectividad del metopreno en el control de Anopheles albimanus Wiedemann (Diptera:Culicidae) en condiciones de laboratorio: Efecto de la densidad larvaria. Bol. Malariol. Salud Amb. 48: 45-52.
44.Nayar J., Aly A. & Zaim M. (2002). Effectiveness and residual activity comparison of granular formulations of insect growth regulators pyiriproxyfen and methoprene against Florida mosquitoes in laboratory and outdoors conditions.J. Am. Mosq. Contr. Assoc. 18: 196-201.
45.Okazawa T., Bakotte B., Kawada H. & Kere N. (1991). Field Evaluation of a new Insect growth regulator, pyriproxyfen (S-31183) against Anopheles punctimaculus on North Guadalcanal, Salomon Islands. J. Am. Mosq. Contr. Assoc. 7: 604-607.
46.Oviedo M., Suárez J., González A. & Álvarez L. (2007). Teratogénesis en poblaciones de Aedes aegypti emergidas de larvas tratadas con Pyriproxyfen en condiciones de laboratorio. XX Congreso Venezolano de Entomología. Sociedad Venezolana de Entomología. San Cristóbal, Venezuela.
47.Rodríguez M., Bisset J., Pérez O., Ramos F. & Risco G. (2006). Modo de herencia de la resistencia a Temephos en Aedes aegypti (Diptera: Culicidae) de Cuba. Rev. Cubana Med. Trop. 58: 142-147.
48.Suárez J., Oviedo M., Álvarez L., González A. & Lenhart A. (2011). Evaluación del regulador de crecimiento Pyriproxifen en poblaciones de Aedes aegypti de Trujillo, Venezuela. Rev. Colombiana Entomol. 37: 91-94.
49.Suárez J. (2008). Evaluación de un regulador de crecimiento (Pyriproxifen) en tres poblaciones de Aedes aegypti del Estado Trujillo, Venezuela. Trabajo de grado. Universidad de los Andes, Núcleo Universitario Rafael Rangel, Trujillo, Venezuela.
50.Susuki H., Okazawa T., Kere N. & Kawada, H. (1989). Field evaluation of a new insect growth regulator: pyriproxyfen (S-31183) against Anopheles farauti, the main vector of malaria in the Solomon Islands. Jap. J. Sanit. Zool. 40: 253-257.












 uBio
uBio 
