Boletín de Malariología y Salud Ambiental
versión impresa ISSN 1690-4648
Bol Mal Salud Amb vol.53 no.1 Maracay ene. 2013
Yasmin Rubio-Palis1,2*, Freddy Ruiz-Lopez3,4 , Hernán Guzmán5 , Víctor Sánchez5 , Jorge E. Moreno5 , Yarys Estrada5 ,Mariapia Bevilacqua6 , Lya Cárdenas6 & Ángela Martínez7
1 Dirección de Control de Vectores, Dirección de Salud Ambiental, Ministerio del Poder Popular para la Salud. Maracay, Venezuela.
2 BIOMED, Universidad de Carabobo, Maracay, Venezuela.
3 Division of Entomology, Walter Reed Army Institute of Research, 503 Robert Grant Avenue, Silver Spring, MD 20910.
4 Department of Entomology, National Museum of Natural History, Smithsonian Institution. Museum Support Center, Suitland, MD 20746.
5 Servicio Autónomo Instituto de Altos Estudios “Dr. Arnoldo Gabaldon” (MPPS), Centro de Investigaciones de Campo “Dr. Francesco Vitanza”, Tumeremo, estado Bolívar, Venezuela.
6 Asociación Venezolana para la Conservación de Áreas Naturales (ACOANA), Caracas, Venezuela
7 Instituto de Salud Pública del estado Bolívar, Ciudad Bolívar, Venezuela
*Autor de correspondencia: rubiopalis@gmail.com
RESUMEN
Se registran por primera vez Anopheles albitarsis F y Anopheles oswaldoi B recolectadas en localidades de los Municipios Sucre y Cedeño del estado Bolívar. Los análisis morfométricos de hembras adultas mostraron que los caracteres analizados en las manchas claras y oscuras de la vena Costa del ala y los tarsómeros de las patas posteriores para An. albitarsis F caen dentro de los rangos reportados para An. marajora sensu lato, mientras que para An. oswaldoi B los rangos de variación de los caracteres medidos están dentro del rango reportado para An. oswaldoi s.l., An. oswaldoi sensu stricto de Brasil y An. konderi. Sin embargo, el análisis de ADN mitocondrial (región código de barras, 658 pb) mostró una divergencia genética entre An. oswaldoi B y An. oswaldoi s.s. de 3,2%, mientras entre An. albirtarsis F y An. marajoara s.s. esta fue de 5,2%, valores que están por encima de los limites propuestos para delimitación de especies.
Palabras clave: Anopheles oswaldoi B, Anopheles albitarsis F, complejos de especies, malaria, Venezuela.
First record of Anopheles (Nyssorhynchus) oswaldoi B y Anopheles (Nys.) albi-tarsis F from the Caura river basin, Bolívar State, Venezuela
SUMMARY
Anopheles albitarsis F and Anopheles oswaldoi B were first recorded from collections in Sucre and Cedeño Municipalities, Bolivar State. Morphometric analysis of dark and pale spots on wing Costa and hind tarsomeres of adult females, showed that the range of variation for An. albitarsis F are within the reported ranges for An. marajoara sensu latu For An. oswaldoi B the range of variation are within the ranges reported for An. oswaldoi s.l., An. oswaldoi sensu stricto from Brazil and An. konderi. DNA mitochondrial analysis (Barcode region 658 bp) showed 3.2% of genetic divergence between An. oswaldoi B and An. oswaldoi s.s., while this divergence was 5.2% between An. albirtarsis F and An. marajoara s.s. Both these values are above the proposed limits for species delimitation.
Key words: Anopheles oswaldoi B, Anopheles albitarsis F, species complex, malaria, Venezuela.
Recibido el 13/11/2012 Aceptado el 10/03/2013
Hasta el presente se han reportado para Venezuela 42 especies de anofelinos (Rubio-Palis, 2005. Bol. Mal. Salud Amb. 45: 1-10), de las cuales 11 han sido incriminadas en la transmisión de malaria (Moreno et al., 2005. Med. Vet. Entomol. 19: 329-332; Rubio-Palis, 2000. Anopheles (Nyssorhynchus) de Venezuela: taxonomía, bionomía, ecología e importancia médica. Publicación de la Escuela de Malariología y Saneamiento Ambiental “Dr. Arnoldo Gabaldon”. Maracay-Venezuela). El mayor número de especies vectoras en Venezuela se encuentra dentro del subgénero Nyssorhynchus (n = 8), el cual ha sido considerado complicado desde el punto de vista taxonómico debido a la gran variabilidad morfológica intraespecífica y la presencia de especies isomórficas [Faran, 1980. Contrib. Am. Entomol. Inst. 15: 1-215; Harbach, 1994. Bull. Ent. Res. 84: 331-342; Knight & Stone, 1977. A catalog of the mosquitoes of the En cuanto al Complejo Oswaldoi, Marrelli et al. (1999. Op. cit.), usando secuencias de ITS2 (ADNr), sugirieron que An. oswaldoi estaba formado por al menos cuatro especies: An. oswaldoi sensu stricto, An. konderi Galvão & Damasceno, y otras dos especies aun no descritas. Sin embargo, Ruiz et al. (2005. Op. cit.) utilizando secuencias del ITS2, confirmó que dos de los cuatro grupos reportados por Marrelli et al. (1999, Op. cit.) fueron errores taxonómicos y que en realidad se trataba de especies isomórficas ( An. benarrochi B, reportado como An. oswaldoi sensu lato en Perú (GB: AF055071) y An. evansae, reportado como An. oswaldoi s.s. (GB: AF055072) en Espirito Santo, Brasil). Los especimenes de An. oswaldoi B secuenciados por Ruiz et al. (2005. Op. cit.) de Putumayo (Colombia), mostraron alta similitud con las secuencias previamente reportadas por Marrerlli et al. (1999. Op. cit.) para Amapá en Brasil (GB: AF056318) y Ocamo, en el estado Amazonas de Venezuela (GB: AF055070). Posteriormente, Motoki et al. (2007, Zootaxa. 1588: 31-51) re-describieron el lectotipo de An. oswadoi s.s. y confirmaron los resultados previamente publicados por Ruiz et al. (2005. Op. cit.), los cuales sugieren An. oswaldoi B de Putumayo (Colombia) (Ruiz et al., 2010. Mem. Inst. Oswaldo Cruz. 105: 899-903) como una especie diferente de An. oswaldoi s.s.
Los resultados anteriores muestran una situación epidemiológica compleja en Venezuela, puesto que An. albitarsis s.l. y An. oswaldoi s.l. han sido incriminados como vectores de malaria en el occidente de Venezuela (Rubio-Palis et al., 1992, Acta Tropica. 52: 167-174), mientras que An. marajoara se ha señalado como vector principal de malaria en algunas localidades mineras del municipio Sifontes del estado Bolívar junto con An. darlingi (Moreno et al., 2005. Op. cit.; 2009, Mem. Inst. Oswaldo Cruz. 104: 764-768).
Las recolectas de anofelinos se realizaron entre Marzo de 2008 y Julio de 2009 en tres localidades del Bajo río Caura, estado Bolívar: comunidad criolla Jabillal (07°03’N, 64° 58’W) (municipio Sucre) y comunidades indígenas El Palmar (06º 34´53.35”N, 064º 49´35.25”W) y Boca de Nichare (06° 36’N, 64° 49’W) (municipio Cedeño). La descripción eco-epidemiológica y demográfica del área de estudio ha sido previamente publicada (Bevilacqua et al., 2009. Bol. Mal. Salud Amb. 49(1): 53-71; Medina et al., 2011. Bol. Mal. Salud Amb. 51: 129-144; world (Diptera: Culicidae). Ed. 2, Entomol. Soc. Am. (Thomas Say Foundation vol. 6). College Park; Linthicum, 1988. Mosq. Syst. 20: 98-271; Peyton et al., 1992. Mosq. Syst. 24: 51-69].
Estudios moleculares, citogenéticos y morfológicos han revelado la presencia de complejos de especies dentro de este subgénero. Así tenemos el Complejo Oswaldoi (Marrelli et al., 1999. J. Med. Entomol. 36: 679-684; Ruiz et al., 2005. Mem. Inst. Oswaldo Cruz. 100: 155-160; Sallum et al., 2008. J. Med. Entomol. 45: 970-9819; Scarpassa & Conn, 2006. Genet. Mol. Res.. 5: 493-502), el Complejo Albitarsis (Krzywinski et al., 2011. Mol. Phylogenet. Evol. 58: 469-477; Lehr et al., 2005. Ann. Entomol. Soc. Am. 98: 908-9178; Merrit et al., 2005. Mol. Phyl. Evol. 35: 719-724; Motoki et al., 2009. Mem. Inst. Oswaldo Cruz. 104: 823-850; Ruiz et al., 2012. Parasit. Vectors. 5: 44; Wilkerson et al., 1995. J. Med. Entomol. 32: 697-704), el Complejo Strodei (Sallum et al., 2010. J. Med. Entomol. 47: 504-526) y el Complejo Nuneztovari (Calado et al., 2008. Mem. Inst. Oswaldo Cruz. 103: 791-799; Conn et al., 1993. J. Amer. Mosq. Control Assoc. 9: 294-301; Foster et al., 2013, PLoS ONE 8: e54063. doi:10.1371).
El Complejo Albitarsis incluye cinco especies formalmente descritas: An. albitarsis Lynch-Arribálzaga, An. deaneorum Rosa-Freitas, An. marajoara Galvão & Damasceno, An. oryzalimnetes Wilkerson & Motoki y An. janconnae Wilkerson & Sallum; tres especies recientemente postuladas, basadas en estudios moleculares (ADNm y ADNr): An. albitarsis F (Brochero et al., 2007. Amer. J. Trop. Med. Hyg. 76: 1113-1117), An. albitarsis G (Krzywinski et al., 2011. Op. cit.; Ruiz et al., 2012. Op. cit.) y An. albitarsis I (Gutiérrez et al., 2010. Mem. Inst. Oswaldo Cruz. 105: 1019-25; Ruiz et al., 2012. Op. cit.), además de un linaje mitocondrial, An. albitarsis H (Ruiz et al., 2012. Op. cit.). Rubio-Palis et al. (2003. J. Amer. Mosq. Control Assoc. 19: 107-114) basados en estudios morfométricos y moleculares (RAPD-PCR), habían señalado para entonces que An. marajoara era la única especie del Complejo presente en Venezuela; cabe destacar que los estudios morfométricos no reportaron diferencias significativas entre las 12 poblaciones analizadas y los estudios moleculares confirmaron la presencia de An. marajoara con base al análisis de especímenes de la población de Calabozo, estado Guárico.Rubio-Palis et al., 2010. Bol. Mal. Salud Amb. 50: 95-107). Para las capturas de hembras adultas se utilizaron trampas Mosquito Magnet Liberty Plus® y en la localidad de Jabillal se realizaron capturas con cebos humanos, actuando los autores como cebos, práctica usual por parte del personal del MPPSalud.
La metodología de captura ha sido descrita en detalle por Rubio-Palis et al. (2012, Mem. Inst. Oswaldo Cruz. 107: 545-549). Además se realizaron capturas en criaderos previamente caracterizados (Rubio-Palis et al., 2010. Op. cit.) con el propósito de obtener estadios inmaduros y desarrollar crías asociadas para estudios morfométricos. Para dicho estudio se incluyeron tanto las hembras silvestres y madres con su progenie asociada de las hembras adultas de An. oswaldoi s.l. (n=10) colectadas en cada localidad.
Para An. albitarsis s.l. (n=4), solo se contó con hembras adultas colectadas en Jabillal. Se siguió la metodología descrita por Rubio-Palis (1998, Bol. Entomol. Vzlana. 13: 141-172), la cual consiste en realizar mediciones de caracteres del ala derecha, patas anteriores y patas posteriores. La morfometría se realizó con un microscopio estereoscópico marca Leica modelo MS5 ocular 10x con micrómetro (50 div = 5 mm) y zoom 4x. La nomenclatura y abreviaciones utilizada es la de Harbach & Knight (1980, Taxonomists’ glossary of mosquito anatomy. Plexus Publishing, Inc.) y Wilkerson & Peyton (1990, J. Med. Entomol. 27: 207-224).
Un total de 19 especimenes, 10 An. oswaldoi s.l. y nueve An. marajoara s.l. previamente identificados por morfología empleando las claves de Rubio-Palis (2000. Op. cit.) fueron secuenciados para la región código de barras, el cual es un fragmento del gen mitocondrial, Citocromo c Oxidasa subunidad 1 - COI (Hebert et al., 2003. Proc. R. Soc. Lond. B. 270: 313-321). Se utilizaron los cebadores diseñados por Folmer et al. (1994. Mol. Mar. Biol. Biotechnol. 3: 294-299), para amplificar una región de 710 pares de bases (658 pb sin cebadores) y el ADN fue extraído usando el kit diseñado por QIAgen ® (DNeasy Blood & Tissue Kit, MD, USA). Para la amplificación y secuenciación del ADN, se utilizaron los protocolos previamente publicados por Ruiz et al. (2010. Op. cit.). Datos de las secuencias (cromatogramas, secuencias y número de acceso al GenBank) están disponibles en http://boldsystems.org (Barcode of Life Data Base – BOLD), proyecto Mosquito Barcode Initiative – MBI. Las secuencias fueron generadas en ambas direcciones usando el kit de Big Dye y un secuenciador 3730, ambos de PE Applied Biosystems (Warrington, UK). Las secuencias fueron editadas usando Sequencher™ v.4.10.8 (Genes Codes Corporation, MI, USA) y posteriormente analizadas en MacClade v.4.06 (Maddison & Madison, 2003, Analysis of phylogeny and character evolution. Sunderland: Sinauer Associates).
La divergencia genética entre las especies colectadas y especies topotípicas de An. marajoara s.s. y An. oswaldoi s.s., fue calculada en MEGA v. 5 (Tamura et al., 2011. Mol. Biol. Evol. 28: 2731-2739) usando Kimura 2-parameter distance model (K2P) (Kimura, 1980. J. Mol. Evol. 16: 111-120) y posteriormente un árbol de distancias genéticas, Bootstrap (Felsentein 1985. Evolution. 39: 783-791) – Neighbor Joining (NJ- K2P) (Saitou & Nei, 1987. Mol. Biol. Evol. 4: 406-425) fue generado en Paup v. 4 (Swofford, 2003. Phylogenetic analysis using parsimony, version 4.0b 10, Sinauer Associates, Sunderland, MA). Las secuencias obtenidas fueron comparadas con las secuencias disponibles en el GenBank, usando BLAST - (http://blast.ncbi.nlm.nih.gov/Blast.cgi), con el objetivo de buscar similitud con secuencias previamente publicadas.
Todas las secuencias generadas en este estudio se encuentran depositadas en el GenBank con los siguientes números de acceso: An. oswaldoi B (KC555056, KC555057, KC555058, KC555059, KC555060, KC555061, KC555072, 555073,KC555074), An. albitarsis F (KC555063, KC55064, KC555066, KC555067, KC555068, KC555069, KC555070, KC555071), An. braziliensis (KC55062) y An. darlingi (KC555065).
La Tabla I muestra las proporciones de los caracteres diagnósticos en la vena Costa del ala y en el segundo tarsómero de las patas posteriores de las especies estudiadas. Para An. albitarsis F se encontraron variaciones en la coloración de las escamas claras del ala; en algunos especímenes las escamas claras del ala variaron de blancas en las venas Costa y Subcosta, y el resto color crema, mientras otros especímenes poseían todas las escamas claras de color blanco, a diferencia de las demás especies del complejo en donde las escamas por lo general son blancas en la parte anterior de las venas Costa y Subcosta y amarillo pálido en el resto de las venas (Motoki et al., 2009. Op. cit.). El rango de variación para las proporciones PHD/HP y SCP/L de 0,22-1,00 y 0,02-0,10 respectivamente (Tabla I), está dentro de los rangos reportados para An. marajoara de Venezuela (Rubio-Palis et al., 2003. Op. cit.). No fue posible comparar estos valores para otras especies del Complejo Albitarsis, puesto que Motoki et al. (2009. Op. cit.) solamente midieron el tamaño del ala y el tamaño de las manchas claras y oscuras y no
las proporciones, lo cual resulta inadecuado puesto que el tamaño del ala y de las manchas varía en función de variables ambientales y disponibilidad de alimento en los criaderos, entre otros (Rubio-Palis, 1998. Op. cit.).
Tabla I. Proporciones (media, desviación estandard y rango) de los caracteres diagnósticos en vena Costa del ala y segundo tarsómero de patas posteriores de Anopheles oswaldoi B (n=10) y Anopheles albitarsis especie F (n=4) de Venezuela.

En cuanto a la proporción del tamaño de la mancha oscura del segundo tarsómero posterior en relación al tamaño del tarsómero (DsTa-III2/Ta-III2) (Tabla I), se observó que la media y rango se solapan con los valores reportados para An. marajoara por Motoki et al. (2009. Op. cit.) y Rubio-Palis et al. (2003. Op. cit.), por lo tanto no es posible utilizando hembras adultas colectadas en el campo diferenciar morfológicamente An. albitarsis F de An. marajoara. Dadas las implicaciones epidemiológicas, resulta fundamental realizar estudios morfométricos de crías asociadas que incluyan todos los estadios a fin de determinar caracteres diagnósticos que permitan diferenciar a An. albitarsis F de las demás especies del complejo, así como ampliar los estudios moleculares a otras regiones del país, puesto que Lehr et al. (2005. Op. cit.) y Ruíz et al. (2012. Op. cit.) confirmaron su presencia al norte del río Orinoco, en los estados Portuguesa, Cojedes y Zulia; más aún, existe la posibilidad que otras especies del complejo además de An. marajoara y An. albitarsis F estén presentes en Venezuela.
Con respecto a An. oswaldoi B, encontramos que los rangos de variación de la longitud de la mancha oscura del segundo tarsómero posterior en relación a la longitud del tarsómero están dentro del rango reportado para An. oswaldoi s.l. (Faran, 1980. Op. cit.), An. oswaldoi s.s. de Brasil (Motoki et al., 2007. Op. cit.) y An. konderi (Flores-Mendoza et al., 2004, Proc. Entomol. Soc. Wash. 106: 118-132) así como para An. oswaldoi s.l. de Venezuela (Rubio-Palis, 2000. Op. cit.). Motoki et al. (2009. Op. cit.) señalan que un carácter diagnóstico confiable para la determinación taxonómica de las especies del Complejo Oswaldoi es mediante el análisis de la forma del ápice del aedeagus, al menos para diferenciar An. oswaldoi s.s. y An. konderi de otras especies del complejo. En el presente estudio no se contó con especímenes machos a fin de analizar la morfología del aedeagus. Caracteres diagnósticos que permiten diferenciar An. oswaldoi s.l., de las demás especies del Subgrupo Oswaldoi tales como la proporción de la longitud de la mancha SCP en relación a la longitud del ala y la proporción de la longitud de la mancha PHD en relación a la longitud de la mancha HP no han sido consideradas en revisiones recientes en esta especie (Motoki et al., 2007. Op. cit.),
reportando sólo el tamaño de las manchas, lo cual es muy variable geográficamente y podría depender de variables ambientales (Rubio-Palis, 1998. Op. cit.).
El análisis de ADN mitocondrial (región código de barras, 658 pb) confirma la presencia por primera vez en Venezuela de An. oswaldoi B, así como de An. albitarsis F para el estado Bolívar. Dadas las implicaciones potenciales de las especies de los Complejos Oswaldoi y Albitarsis en la transmisión de los parásitos maláricos, es fundamental en estudios futuros realizar simultáneamente estudios morfométricos de isofamilias y estudios moleculares que permitan la descripción de estas especies.
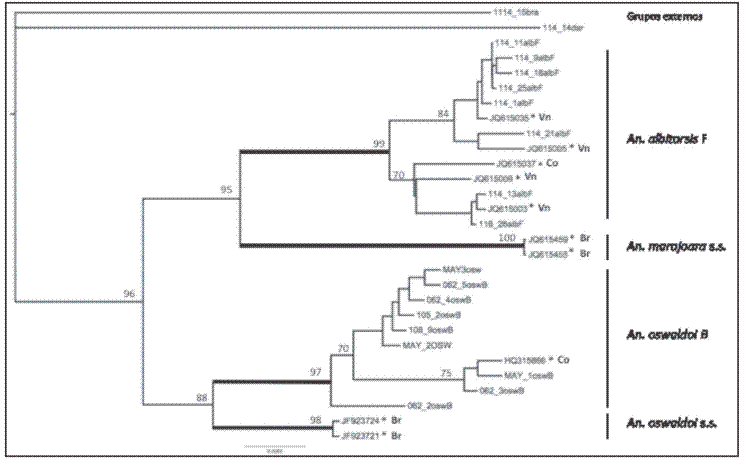
El análisis de la región código de barras mostró una divergencia genética mayor del 3,2% entre todas las taxas. Anopheles oswaldoi B y An. oswaldoi s.s presentaron una divergencia de 3,2%, mientras que en An. albitarsis F and An. marajoara s.s. esta fue de 5.2%; valores que se encuentran por encima del rango utilizado para delimitación de especies (Hebert et al., 2003. Op. cit.; Ruiz et al., 2010. Op. cit., 2012. Op. cit.). No se detectaron codones de parada a lo largo de las 658 bp analizadas (n = 19 secuencias), descartando la presencia pseudogenes. Cuando se sometieron nuestras secuencias consensos de An. oswaldoi B and An. albitarsis F a las registradas en el GenBank para estas especies, estas mostraron una alta homología (98% - 99%) con An. oswaldoi B de Putumayo, Colombia (HQ315866 de Ruiz et al., 2010. Op. cit.) y An. albitarsis F de Venezuela y Colombia (JQ15035, JQ615005, JQ615037, JQ5009 y JQ515003; Ruiz et al. 2012. Op. cit.), confirmando la presencia de estas dos nuevas especies para el estado de Bolívar, Venezuela. Los valores de Bootstrap confirman claramente que An. albitarsis F y An. oswaldoi B son diferentes a las topotípicas especies An. marajoara s.s. y An. oswaldoi s.s. (Fig. 1).
Fig. 1. Árbol filogenético basado en distancias genéticas (NJ/K2P) de An. oswaldoi B, An. albitarsis F (Bolívar, Venezuela) y secuencias previamente publicadas en el GenBank para la región código de barras: An. albitarsis F (JQ615035, JQ615005, JQ615037, JQ615009, JQ615003), An. marajoara s.s. (JQ615455, JQ615459), An. oswaldoi B (HQ315866) y An. oswaldoi s.s. (JF923721, JF923724). Grupos externos: An. (Nys) braziliensis y An. (Nys.) darlingi (Bolívar, Venezuela). *Secuencias previamente publicadas por Ruiz et al. (2012. Op. cit.; 2010. Op. cit.). Br: Brasil, Co: Colombia, Vn: Venezuela.
AGRADECIMIENTOS
A todos los habitantes de El Palmar, Boca de Nichare (especialmente Aurora Rodríguez y Simón Caura), y Jabillal (especialmente Ana María Ibañez y Horacio Vargas) por permitirnos realizar el estudio en sus comunidades y, conjuntamente con la Dirección de Salud Ambiental del Estado Bolívar, por facilitar el apoyo logístico. A los vigilantes entomológicos comunitarios entrenados, por su acompañamiento de campo: Héctor Domínguez y Bonifacio. Este estudio fue posible gracias al financiamiento del International Development Research Centre (IDRC-Canadá) (Proyecto 103696-006), Delegación de la Unión Europea en Venezuela (DCI-NSAPVD/2008/ 166-318), Ministerio del Poder Popular para la Ciencia, Tecnología e Innovación (FONACIT-Contrato Número 200800777, Sub-proyecto Malaria-Componente Caura), National Institute of Health, USA (2R01AI054139 to JEC), Smithsonian Institution, y Walter Reed Army Institute of Research.












 uBio
uBio 
