Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Boletín de Malariología y Salud Ambiental
Print version ISSN 1690-4648
Bol Mal Salud Amb vol.53 no.2 Maracay Dec. 2013
Flebotominos adultos e inmaduros (Diptera: Psychodidae): registros para el Caribe colombiano
Adult and immature phlebotomine sandflies (Diptera: Psychodidae): records for the Caribbean región of Colombia
Rafael José Vivero Gómez1±, Edgar Ortega Gómez2, Yamileth Aparicio Argumedo2, Carolina Torres Gutierrez1, Carlos Muskus Lopez1 & Eduar E. Bejarano Martínez2
1 Programa de Estudio y Control de Enfermedades Tropicales (PECET), Facultad de Medicina, Universidad de Antioquia, Calle 62 #52-59, Sede Investigación Universitaria -SIU, Medellín, Colombia.
2 Grupo de Investigaciones Biomédicas, Universidad de Sucre, Cra. 14 No. 16B-32, Sincelejo, Colombia
*Autor de correspondencia: rajovigo2001@yahoo.com
RESUMEN
Elaborar inventarios de Lutzomyia spp., sin considerar los estados inmaduros de dichos insectos, provee información parcial. Investigar los estados inmaduros de Lutzomyia, es un reto y necesidad actual especialmente en áreas con transmisión de Leishmania spp. El objetivo de este estudio fue detectar sitios de cría naturales, para un inventario de flebotominos adultos e inmaduros del municipio de Colosó (Sucre, Colombia). Los flebotominos fueron recolectados entre mayo y diciembre de 2009, en la estación experimental de fauna silvestre de Colosó. La detección de estados inmaduros se desarrolló por revisión directa de muestras de suelo y árboles, incubación de estos sustratos en laboratorio y por trampas de emergencia. La colecta de adultos se realizó por búsqueda activa diurna con aspiradores bucales en sitios de reposo, principalmente en bases, huecos y raíces tabulares de árboles. Se aislaron 44 inmaduros de flebotominos, de los cuales 32 correspondieron a las especies Lutzomyia migonei, Lu. dubitans, Lu. serrana, Lu. cayennensis cayennensis, Lu. micropyga, Lu. evansi, Lu. gorbitzi, Lu. ovallesi y Lu. shannoni. Así mismo, se colectaron 1231 ejemplares adultos entre los cuales Lu. evansi, Lu. micropyga y Lu. trinidadensis fueron, en su orden, las especies más abundantes. Lu. migonei y Lu. gorbitzi constituyen, respectivamente, primeros registros para el departamento de Sucre y la Costa Caribe. Es necesario incluir muestreos de insectos inmaduros como información complementaria en estudios sobre flebotominos y así reunir información sólida para elaborar inventarios de especies señalando los potenciales vectores en focos de leishmaniasis.
Palabras clave: Lutzomyia, inmaduros, leishmaniasis, costa Caribe.
SUMMARY
Elaborating an inventory for Lutzomyia spp., without considering the immature forms of such insects, gives only a partial information about the species. Investigating immature phlebotomines represents a challenge and urgency especially in Leishmania spp. transmission areas. The objective of this study was to detect natural breeding sites, for an inventory of immature and adult phlebotomine community in the municipality of Colosó, Department of Sucre. Phlebotomine sandflies were collected between May and December of 2009, at the wild life experimental station in Colosó. Detection of immature stages was approached by direct visualization of soil and tree-substrate samples, incubation of substrate in laboratory conditions and use of emergence traps. Adult sampling was conducted by active diurnal search in resting places using bucal aspirators to collect the insects. Resting places were predominantly associated with tree trunks, such as holes in trunks and buttress roots. We collected 44 immatures of phlebotomine sandflies of which 32 belong to the following species: Lutzomyia migonei, Lu. dubitans, Lu. serrana, Lu. cayennensis cayennensis, Lu. micropyga, Lu. evansi, Lu. gorbitzi, Lu. ovallesi and Lu. shannoni. Also, up to 1231 adult individuals were collected and the most abundant species in descending order were Lu. evansi, Lu. micropyga and Lu. trinidadensis. The species Lu. migonei and Lu. gorbitzi are worth noticing given the fact that they represent new records for the Department of Sucre as well as the Caribbean Region in the country. It is necessary to include immature sampling as complementary information on phlebotomine surveys and in this way gather solid information to release proper species inventories with the remarks on potential vectors in leishmaniasis foci.
Key words: Lutzomyia, immature insects, leishmaniasis, Caribbean region.
Recibido el 07/05/2013 Aceptado el 08/09/2913
INTRODUCCIÓN
La leishmaniasis es una enfermedad desatendida y reemergente en el mundo, con una cadena epidemiológica compleja que dificulta el diseño de medidas eficaces para su control (Ashford, 1997). Esta complejidad está dada por la variación antigénica y taxonómica que presentan los parásitos tripanosomátidos del género Leishmania (Saravia et al., 1998; Martínez et al., 2010), reconocidos como agentes causales de la enfermedad; el surgimiento de nuevos brotes de leishmaniasis con diferentes manifestaciones clínicas (Convit et al., 2005); el papel de reservorios en la dinámica de transmisión, que permanece como tópico poco investigado (Ashford, 1997; 2000); y la presencia de insectos hematófagos de la subfamilia Phlebotomine, que representan en gran medida, el riesgo de infección con Leishmania spp. para la población humana de una localidad.
Con relación a los vectores del género Lutzomyia, se ha establecido en su historia natural, que su ecología se encuentra asociada originalmente al ambiente selvático, donde realizan su ciclo biológico (Valderrama et al., 2008). Por consiguiente, la transmisión de la leishmaniasis a la población humana puede ocurrir durante la realización de actividades como el ecoturismo, la extracción maderera, la cacería y el desarrollo de estudios científicos, entre otros (Duque et al., 2004), aunque también predominan los ciclos de transmisión en ambientes domésticos rurales y urbanos (Bejarano et al., 2002). En este sentido, es imperioso examinar periódicamente la riqueza de flebotominos en zonas endémicas de leishmaniasis y divulgar información actualizada de su distribución geográfica, que permita a funcionarios de las unidades de Enfermedades Transmitidas por Vectores (ETV) la vigilancia y posterior intervención oportuna (Amora et al., 2009).
En Colombia se registraron aproximadamente 35.637 casos de leishmaniasis entre el 2009 y 2011 (INS, 2011), y se ha documentado la presencia de más 160 especies de flebotominos, de las cuales 13 han sido incriminadas como vectores de Leishmania spp. (Contreras et al., 2012; Bejarano, 2006). Al realizar un análisis por ecoregión, la Costa Caribe reviste interés epidemiológico en áreas rurales y selváticas, especialmente, la subregión de Los Montes de María, considerado históricamente como el macrofoco de leishmaniasis visceral más importante del país (Travi et al., 2002; Pérez-Doria et al., 2008).
Parte de la extensión territorial del departamento de Sucre corresponde a municipios ubicados en Los Montes de María, donde se ha registrado la presencia de vectores de parásitos del género Leishmania spp. En el municipio de Colosó, Sucre, se ha estudiado con antelación la fauna de flebotominos (Travi et al., 2002; Pérez-Doria et al., 2008; Bejarano et al., 2007), sin embargo, los estudios entomológicos tradicionalmente han contemplado la colecta del estado adulto, lo que implica el levantamiento potencial de inventarios incompletos de especies, debido a que la fauna inmadura puede diferir de la de adultos no solo en la abundancia sino también en la composición de los taxones (Alencar et al., 2011; Sangiorgi et al., 2012).
Esta problemática se sustenta por la dificultad de encontrar inmaduros de flebotominos directamente en sitios de cria naturales (Feliciangeli, 2004). Estos dípteros presentan ubicuidad por diferentes hábitats con materia en descomposición difíciles de percibir por el humano (Sangiorgi et al., 2012). Sin embargo el hecho de hallar inmaduros de Lutzomyia, representa avanzar en la taxonomía de los flebotominos, ya que estos podrían ser útiles para la confirmación de especie en el estado adulto para soportar la confirmación de especie en el estado adulto. El presente estudio tuvo como finalidad identificar los sitios de cría naturales y determinar un inventario de flebotominos inmaduros y adultos en el municipio de Colosó, departamento de Sucre.
MATERIALES Y MÉTODOS
Descripción del área de estudio
El estudio se efectuó en la Estación Experimental de Fauna Silvestre Primates (09º 31 48.0 N - 75º 21 4.3 W, 220m), ubicada dentro de la Reserva Forestal Protectora Serranía de Coraza, perteneciente al municipio de Colosó, departamento de Sucre. Está reserva natural es catalogada como un ecosistema de transición de bosque seco premontano a bosque seco tropical (Holdridge, 1967) y se encuentra constituida por formaciones montañosas rezagadas de la Cordillera Occidental de Los Andes (Hernández et al., 1992). Presenta una temperatura media de 29ºC, humedad relativa de 80-85% y precipitación de 1.114 mm anuales.
Muestreo y determinación taxonómica de flebotominos
Las actividades de colectas de adultos e inmaduros se desarrollaron mensualmente de forma consecuente durante cinco días entre mayo y diciembre del 2009, excepto el mes de octubre. Estos tiempos fueron considerados para aumentar la cobertura del área de muestreo y para explorar una mayor riqueza de hábitats. Para detectar los inmaduros se exploraron posibles sitios de cría naturales con microambientes favorables al desarrollo de estados preimaginales de flebotominos, según lo registrado en la literatura (Feliciangeli, 2004).
El aislamiento de los estados inmaduros y la detección de sitios de cría se realizó por tres métodos: i) revisión directa de sustratos en estereomicroscopio, ii) trampas de emergencia tipo cono plegables, sujetadas a la superficie del suelo, hojarasca y huecos de los árboles, colectando los flebotominos con aspiradores bucales tipo depósito e iii) incubación de sustratos en potes de cría en laboratorio, los cuales han sido descritos en estudios recientes (Alencar et al., 2011; Sangiorgi et al., 2012; Feliciangeli, 2004; Parras et al., 2012; Maroli et al., 1997). Los inmaduros aislados fueron criados bajo condiciones de laboratorio hasta el estado adulto.
Para la recolecta de adultos en el campo, dos investigadores realizaron búsqueda activa diurna (05:00-10:00 h) con aspiradores bucales en sitios de reposo, con una mayor intensidad de muestreo en bases, huecos y raíces tabulares de diferentes especies arbóreas. El número de sitios muestreados por búsqueda activa (n= 50) fue similar al realizado para la búsqueda de potenciales criaderos naturales en el área de estudio, en razón que esta metodología permite una mejor orientación y aumentar la incriminación de sitios positivos. Los ejemplares adultos colectados se conservaron en seco a -20°C y se transportaron al Laboratorio de Investigaciones Biomédicas de la Universidad de Sucre. El proceso de maceración, deshidratación (1 parte de fenol, 0.75 partes de ácido láctico) y montaje (Bálsamo de Canadá) se realizó utilizando el protocolo descrito por Maroli et al., 1997.
Para la identificación morfológica de los flebotominos adultos encontrados por búsqueda activa, al igual que los obtenidos en trampas de emergencia y por incubación, se siguió la clave de Galati (Galati, 2003). El sistema genérico y subgénerico de clasificación corresponde al tradicional de Young & Duncan, 1994. Las larvas y pupas que murieron después de la colecta, se identificaron por secuenciación del marcador mitocondrial Citocromo Oxidasa I (resultados no mostrados).
RESULTADOS
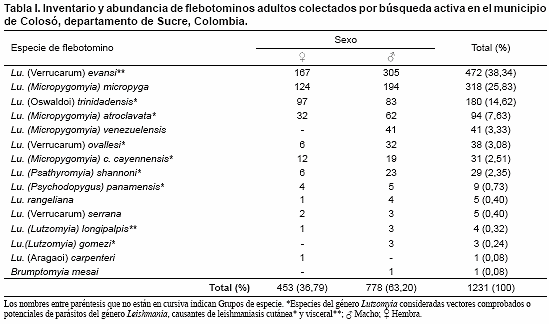
Por búsqueda activa en sitios de reposo se colectaron 1231 ejemplares adultos de 14 especies del género Lutzomyia, distribuidas en cuatro subgéneros y tres grupos de especies. También se encontró una especie del género Brumptomyia correspondiente a Br. mesai (Tabla I).
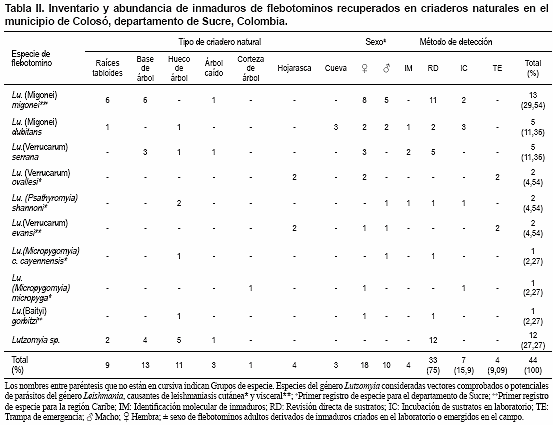
Las tres especies presentes en mayor abundancia relativa en la zona de estudio fueron Lu. evansi (38,34%), Lu. micropyga (25,83%) y Lu. trinidadensis (14,62%) (Tabla I). En relación con la fauna inmadura, se aislaron 44 ejemplares a partir del análisis de sustratos orgánicos de 50 sitios potenciales de cría (33 por búsqueda directa, 7 por incubación, 4 con trampas de emergencia), dentro de los cuales 16 sitios resultaron positivos y correspondieron a hueco de árbol (n= 4), suelo entre raíces tabloides (n= 3), suelo en base de árbol (n= 3), hojarasca (n= 2), tronco de árbol (n= 2), corteza de árbol (n= 1), y cueva (n= 1) (Tabla II). En total se identificaron 32 inmaduros del género Lutzomyia pertenecientes a las especies Lu. migonei, Lu. dubitans, Lu. serrana, Lu. cayennensis cayennensis, Lu. micropyga, Lu. evansi, Lu. gorbitzi, Lu. ovallesi y Lu. shannoni. El número absoluto y porcentual de cada especie, así como su distribución por tipo de criadero y método de detección, se presenta en la Tabla II.
Algunas de las especies vegetales identificadas asociadas a los sitios de cría naturales en el área de estudio fueron Nectandra membranaceae, Myroxylon balsamum, Trichilia acuminata, Aspidosperma megalocarpon, Brownea ariza, Soroceae sprucei, Ceiba pentandra, Basiloxylum excelsum, Dilodendron sp., Heisteria acuminata, Albizia nipoides. Se destaca a la especie Ceiba pentandra por albergar el mayor número de inmaduros. Es necesario resaltar que algunas características morfometricas de los árboles sugieren la posible presencia de los inmaduros encontrados, entre éstas el perímetro a la altura del pecho entre 45cm y 283cm; el número de raíces tabloides (n= 7-11): y el tipo de corteza fisurada y laminar. Otras variables ambientales determinadas fueron la humedad relativa in situ (93%) y la temperatura (27,4°C).
DISCUSIÓN
El presente estudio es pionero en Colombia en el ámbito de la ecología de los estados inmaduros del género Lutzomyia, se destaca la amplia variedad de sitios de cría naturales detectados en la zona, con respecto a otros estudios llevados a cabo en América (Alencar et al., 2011; Sangiorgi et al., 2012; Parras et al., 2012; Ferro et al., 1994). Posiblemente, particularidades ambientales de esta zona de reserva ecológica, tales como diversidad de especies vegetales, constituyentes edáficos y características climáticas, son favorables para el desarrollo de inmaduros del género Lutzomyia (Cabanillas & Castellon, 1999; Rutledge & Ellenwood, 1975).
Al comparar con estudios ecológicos de flebotominos se encuentra similitud en la detección del suelo entre raíces tabloides, bases y huecos de árboles, como criaderos naturales predilectos en ambientes boscosos que pueden albergar más de una especie del género Lutzomyia (Lu. migonei, Lu. dubitans, Lu. serrana, Lu. shannoni, Lu. cayennensis, Lu. gorbitzi) (Alencar et al., 2011; Sangiorgi et al., 2012; Parras et al., 2012; Hanson, 1961). La abundancia de inmaduros en estos tres tipos de criaderos naturales puede explicarse porque corresponden a espacios con alto contenido de materia orgánica en descomposición, generada principalmente por la acumulación de hojas, restos de pequeños artrópodos y heces de animales. Así mismo, estos sitios de cría ofrecen protección contra la lluvia, el viento, la luminosidad y los posibles enemigos naturales (Rutledge & Ellenwood, 1975). En ese orden de ideas, la corteza de los árboles, se puede catalogar como lugar de cría alternativo que puede propiciar un espacio de protección y acumulación de lignina que favorece la alimentación y el desarrollo potencial de larvas de Lu. micropyga.
Por otro lado, microambientes contenidos en la hojarasca, de donde se aislaron inmaduros de Lu. evansi y Lu. ovallesi, representan sitios de cría en áreas relativamente expuestas del ecosistema que permanecen bajo el efecto directo de la luz, desecación y precipitación, lo que torna menos propicios estos microambientes para el desarrollo de inmaduros de flebotominos (Rutledge & Ellenwood, 1975). Algunos estudios registran que las especies antropofílicas prefieren la hojarasca como sitio de cría y destacan que el patrón de distribución de la hojarasca, la composición, textura y estabilidad del suelo interfieren directamente en la abundancia de flebotominos en ambientes silvestres (Rutledge & Ellenwood, 1975; Chaniotis et al., 1974). El estudio de este sitio de cría demanda un mayor esfuerzo pues la muestra a examinar debe ser grande para poder encontrar algún ejemplar inmaduro de flebotomino. En lo que respecta al hallazgo de inmaduros de Lu. dubitans en cuevas, se debe anotar que aunque éstas han sido denominadas por algunos investigadores como ambientes inhóspitos para flebotominos y señaladas solo como sitios de reposo, en trabajos recientes se aislaron 507 inmaduros de diferentes especies de flebotominos en la caverna de Maruaga, Brasil, y tres larvas de Lutzomyia almerioi en la caverna Lago Azul, en el mismo país (Alves et al., 2008).
Es importante destacar el hallazgo de Lu. migonei y Lu. gorbitzi en el presente estudio, que constituyen, respectivamente, no sólo el primer hallazgo para el departamento de Sucre y la Costa Caribe, sino también los primeros registros de flebotominos que se realizan en Colombia a partir de estados inmaduros colectados en campo y criados en laboratorio hasta alcanzar el estado adulto.
Lutzomyia migonei es un flebotomino asociado al ciclo epidemiológico de la leishmaniasis cutánea y visceral (Rangel & Lainson, 1999, De Carvalho, et al., 2012). Este flebotomino tiene una amplia distribución en Sudamérica, incluidos distintos hábitats desde Argentina hasta Colombia, con un marcado carácter endémico en los Andes de Venezuela y en la región tropical y subtropical de Brasil. En Colombia, Lu. migonei está restringido a la Costa Caribe, departamentos de Córdoba, Magdalena y La Guajira (Bejarano, 2006) motivo por el cual el registro de la especie en el departamento de Sucre, a partir de estados inmaduros colectados en raíces, bases y troncos de árboles, actualiza su distribución geográfica. Este hallazgo es relevante, desde el punto de vista epidemiológico, porque implica la co-existencia de esta especie con Lu. evansi y Lu. longipalpis en un foco de leishmaniasis visceral (Travi et al., 2002; Perez-Doria et al., 2008).
El registro de Lu. gorbitzi en el departamento de Sucre representa el segundo reporte de esta especie para Colombia, su antecedente geográfico anterior en el país se relaciona con el departamento de Nariño (Bejarano, 2006). Este flebotomino se encuentra registrado en Costa Rica, Panamá, Ecuador y Perú. Lu. gorbitzi podría estar asociada con la transmisión de la bacteria Bartonella bacilliformis, agente causal de la bartonelosis (Cáceres et al., 2000). No existen trabajos previos sobre el desarrollo de formas inmaduras de Lu. gorbitzi en microhábitats naturales, sin embargo, adultos de la especie fueron hallados en huecos de árboles en ambientes silvestres de Panamá (Christensen et al., 1983), en raíces tabloides de árboles (Ceiba pentadra) y en troncos de árboles dentro de plantaciones de Café (Alexander et al., 1992).
Las diferencias encontradas entre la fauna de inmaduros de los sitios de cría naturales y la fauna de adultos colectados por búsqueda activa, se discuten solo en términos de abundancia relativa, por las diferencias y estandarización en los métodos de colecta para ambos estados, y la falta de asociación en el tiempo, para evitar sesgos por sucesión generacional. Sin embargo, se pueden sugerir diversos factores, tales como la baja densidad de Lu. gorbitzi y Lu. migonei, el hábito de las especies o el desconocimiento del lugar en donde reposan los adultos, debido a que los flebotominos pueden cambiar sus hábitos o sitios de refugio en busca de alimento o protección (Sangiorgi et al., 2012). Otras consideraciones hacen referencia a la discrepancia documentada de sitios de cría con relación al lugar de agregación de los flebotominos adultos; porque las hembras grávidas prefieren ovipositar en microambientes distantes de sus sitios de reposo para evitar la competencia interespecífica o intraespecífica.
Finalmente, este estudio aporta información sobre la biología de inmaduros del género Lutzomyia en el municipio de Colosó, departamento de Sucre, y demuestra la necesidad de incorporar en estudios entomológicos de la leishmaniasis, el muestreo sistemático de inmaduros con el propósito de elaborar inventarios completos de la fauna de flebotominos presentes en focos de la enfermedad y actualizar los listados de distribución de especies disponibles.
Conflicto de intereses
Ninguno reportado.
AGRADECIMIENTOS
Los autores agradecen el apoyo académico y científico brindado por el Programa de Estudio y Control de Enfermedades Tropicales (PECET) de la Universidad de Antioquia y el Grupo de Investigaciones Biomédicas de la Universidad de Sucre. Al Departamento Administrativo de Ciencia, Tecnología e Innovación –COLCIENCIAS, proyecto de investigación 111540820514, contrato número 266-2007.
REFERENCIAS
1. Alencar R., Queiroz R. & Barrett T. (2011). Breeding sites of phlebotomine sand flies (Diptera: Psychodidae) and efficiency of extraction techniques for immature stages in terra-firme forest in Amazonas State, Brazil. Acta Tropica. 118: 204-208. [ Links ]
2. Alexander J.B., Takaoka H., Eshita Y. & Gomez E., Hashiguchi. (1992). New records of phlebotomine sand flies (Diptera:Psychodidae) From Ecuador. Mem. Inst. Oswaldo Cruz. 87: 123-1230. [ Links ]
3. Alves V., Freitas R. & Barrett T. (2008). Lutzomyia maruaga (Diptera: Psychodidae), a new bat-cave sand fly from Amazonas, Brazil. Mem. Inst. Oswaldo Cruz. 103: 251-253. [ Links ]
4. Amora S., Bevilaqua C., Feijo F., Alves N. & Maciel M. (2009). Control de Phlebotomine (Diptera: Psychodidae) Leishmaniasis Vectors. Neotrop. Entomol. 38: 303-10. [ Links ]
5. Ashford R. (1997). The Leishmanioses as model zoonoses. Ann. Trop. Med. Parasitol. 91: 693-701. [ Links ]
6. Ashford R. (2000). The leishmaniasis as emerging and reemerging zoonoses. Int. J. Parasitol. 30: 1269-1281. [ Links ]
7. Bejarano E., Uribe S., Rojas W. & Vélez I. (2002). Phlebotomine sand flies (Diptera: Psychodidae) associated with the appearance of urban leishmaniasis in the city of Sincelejo, Colombia. Mem. Inst. Oswaldo Cruz. 97: 645-647. [ Links ]
8. Bejarano E. (2006). Lista actualizada de los psicódidos (Diptera: Psychodidae) de Colombia. Folia Entomol. Mex. 45: 47-56. [ Links ]
9. Bejarano E., Castro M., Pérez-Doria A., Hernández-Oviedo E., Vélez A. & Vélez I. (2007). First Report of Lutzomyia Franca in the department of Guainia, Amazonian Colombia, and of Brumptomyia mesai Sherlock (Diptera: Psychodidae) in the Colombian Caribbean Coast. Neotrop. Entomol. 36: 990-993. [ Links ]
10. Cabanillas R. & Castellón E. (1999). Distribution of sandflies (Diptera: Psychodidae) on tree-trunks in a non-flooded area of the Ducke Forest Reserve, Manaus, AM, Brazil. Mem. Inst. Oswaldo Cruz. 94: 289-296. [ Links ]
11. Cáceres G., Galati B., Pinto J., Paredes R., Reátegui R., Pérez J., et al. (2000). Psychodidae (Diptera) del Perú I. Phlebotominae en Huánuco, Pasco y Cusco, su relación con la enfermedad de Carrión y la leishmaniasis tegumentaria. Rev. Per. Bio. 7: 27-42. [ Links ]
12. Chaniotis B., Correa M., Tesh R. & Johnson K. (1974). Horizontal and vertical movements of phlebotomine sandflies in a panamanian rain forest. J. Med. Entomol. 3: 369-375. [ Links ]
13. Christensen H., Fairchild A., Johnson M., Young D. & Vasquez A. (1983). The ecology of cutaneous leishmaniasis in the Republic of Panama. J. Med. Entomol. 20: 463-484. [ Links ]
14. Contreras A., Vivero R., Bejarano E., Carrillo L. & Vélez I. (2012). Nuevos registros de flebotominos (Diptera: Psychodidae) en el área de influencia del río Amoyá en Chaparral, Tolima. Biomédica. 32: 263-268. [ Links ]
15. Convit J., Ulrich M., Pérez M., Hung J., Castillo J., Rojas H., et al. (2005). Atypical cutaneous leishmaniasis in Central America: possible interaction between infectious and environmental elements. Trans. R. Soc. Trop. Med. Hyg. 99: 13-17. [ Links ]
16. De Carvalho M., Valença H., da Silva F., de Pita- Pereira D., de Araújo Pereira T., Britto C., et al. (2010). Natural Leishmania infantum infection in Migonemyia migonei (França, 1920) (Diptera: Psychodidae: Phlebotominae) the putative vector of visceral leishmaniasis in Pernambuco State, Brazil. Acta Trop. 116: 108-110. [ Links ]
17. Duque P., Vélez I., Morales M. & Sierra D. (2004). Sand flies fauna involved in the transmission of cutaneous leishmaniasis in Afro-Colombian and Amerindian Communities of Chocó, Pacific Coast of Colombia. Neotrop. Entomol. 33: 263-264. [ Links ]
18. Feliciangeli M. (2004). Natural breeding places of phlebotomine sandflies. Med. Vet. Entomol. 18: 71-80. [ Links ]
19. Ferro C., Pardo R., Torres M. & Morrison A. (1997). Larval microhabitats of Lutzomyia longipalpis (Diptera: Psychodidae) in an endemic focus of visceral leishmaniasis in Colombia. J. Med. Entomol. 34: 719-728. [ Links ]
20. Galati E. (2003). Morfologia, terminologia de adultos e identificação dos táxons da América. En: Rangel EF, Lainson R, editores. Flebotominos do Brasil. Rio de Janeiro: Editora Fiocruz. 53-175.
21. Hanson W. (1961). The breeding places of Phlebotomus in Panama (Diptera: Psychodidae). Ann. Entomol. Soc. Am. 54: 317-322. [ Links ]
22. Hernández J., Hurtado A., Ortiz R. & Walschburger T. (1992). Unidades biogeográficas de Colombia. Págs. 105-152 en: Halffter, G. (ed.). La Diversidad Biológica de Iberoamérica I. CYTED-B Programa iberoamericano de ciencia y tecnología para el desarrollo. Instituto de Ecología, A.C., Xalapa, México.
23. Holdridge L. (1967). Life zone ecology. San José: Tropical Science Center. INS (Instituto Nacional de Salud) (2011). Subdirección de Vigilancia y Control en Salud Pública, Casos Totales en la Semana Epidemiológica 53 y Acumulados del Año. Cuadro 5.
24. Maroli M., Feliciangeli M. & Arias J. (1997). Métodos de Captura, Conservación y Montaje de los Flebótomos (Diptera: Psychodidae). OPS/ OMS/HCP/HCT/95/97. Washington D.C., USA.
25. Martínez L., Rebollo J., Luna A., Cochero S. & Bejarano E. (2010). Molecular identification of the parasites causing cutaneous leishmaniasis on the Caribbean coast of Colombia. Parasitol. Res. 106: 647-652. [ Links ]
26. Parras P., Rosa J., Szelag E. & Salomón O. (2012). Identification of the natural breeding sites of sandflies (Diptera: Psychodidae: Phlebotominae), potential vectors of leishmaniasis, in the province of Chaco, Argentina. Mem. Inst. Oswaldo Cruz. 107: 550-552. [ Links ]
27. Pérez-Doria A., Oviedo E. & Bejarano E. (2008). Lutzomyia (Diptera: Psychodidae) de la Reserva Serranía de Coraza y Montes de María, Colombia. Rev. Colomb. Entomol. 34(1): 98-101. [ Links ]
28. Rangel E. & Lainson R. (2009). Proven and putative vectors of American cutaneous leishmaniasis in Brazil: aspects of their biology and vectorial competence. Mem. Inst. Oswaldo Cruz. 104: 937- 954. [ Links ]
29. Rutledge L. & Ellenwood D. (1975). Production of phlebotomine sandflies on the open forest floor in Panama: hydrologic and phisiographic relations. Environ. Ent. 4: 78-82. [ Links ]
30. Sangiorgi B., Miranda D., Oliveira D., Santos E., Gomes F., Santos E., et al. (2012). Natural Breeding Places for Phlebotomine Sand Flies (Diptera: Psychodidae) in a Semiarid Region of Bahia State, Brazil. J. Trop. Med. 12:40-68. [ Links ]
31. Saravia N., Segura I., Holguin A., Santrich C., Valderrama L. & Ocampo C. (1998). Epidemiologic, genetic and clinical associations among phenotypically distinct populations of Leishmania (Viannia) in Colombia. Am. J. Trop. Med. Hyg. 59: 86-94. [ Links ]
32. Travi B., Adler G., Lozano M., Cadena H. & Montoya- Lerma J. (2002). Impact of habitat degradation on phlebotominae (Diptera: Psychodidae) of tropical dry forests in Northern Colombia. J. Med. Entomol. 39: 451-456. [ Links ]
33. Valderrama A., Herrera M. & Salazar A. (2008). Relación entre la composición de especies del género Lutzomyia franca (Diptera: Psychodidae, Phlebotominae) y los diferentes tipos de bosques en Panamá. Acta Zool. Mex. 24: 66-78. [ Links ]
34. Young G. & Duncan M. (1994). Guide to identification and geographic distribution of Lutzomyia sand flies in Mexico, the West Indies, Central and South America (Diptera: Psychodidae). Mem. Am. Entomol. Inst. 54: 1-881. [ Links ]