Boletín de Malariología y Salud Ambiental
versão impressa ISSN 1690-4648
Bol Mal Salud Amb vol.54 no.2 Maracay dez. 2014
Efecto larvicida de extractos metanólicos obtenidos de semillas y hojas de Persea americana (Laurales: Lauraceae) (aguacate) sobre Aedes aegypti (Diptera: Culicidae)
Larvicide effect of methanolic extracts from seeds and leaves Persea americana (Laurales: Lauraceae) (avocado) on Aedes aegypti (Diptera: Culicidae)
Irma F. Agrela*, Yessika Hidalgo & Flor Herrera
Instituto de Investigaciones Biomédicas (BIOMED), Facultad de Ciencias de la Salud, Sede Aragua. Universidad de Carabobo. Maracay, edo. Aragua - Venezuela
*Autor de correspondencia: agrelairma@hotmail.com
RESUMEN
Aedes aegypti es el principal vector del dengue en el continente americano, una de las arbovirosis de mayor impacto en Venezuela, debido a su alta morbilidad y mortalidad. La ausencia de una vacuna contra este virus ha llevado al uso indiscriminado de insecticidas provocando la resistencia del vector, daños al medio ambiente y reacciones adversas en personas susceptibles. En un esfuerzo por encontrar formas eficaces y asequibles para el control, surge como una alternativa el uso de extractos vegetales que proporcionen menos riesgo ambiental y bajo costo. El objetivo de esta investigación fue evaluar el efecto larvicida de extractos metanólicos obtenidos a partir de semillas y hojas de Persea americana (aguacate) sobre Ae. aegypti [cepas Rockefeller y Mario Briceño Iragorry (MBI)]. El mayor efecto tóxico se observó con el extracto metanólico obtenido a partir de las semillas con 100% de mortalidad a 25 mg/L para la cepa Rockefeller y 50 mg/L para la cepa MBI, 24 horas post-exposición. Las concentraciones letales (CL50) fueron las siguientes: a) extracto metanólico preparado a partir de las semillas CL50= 5,7mg/L para Rockefeller y CL50=9,9 mg/L para MBI; b) extracto metanólico de las hojas CL50= 22,8mg/L para Rockefeller y para MBI CL50= 26,2 mg/L. Los resultados muestran el efecto tóxico de los extractos metanólicos preparados a partir de la semilla y de la hoja del aguacate, sobre Ae. aegypti y sugieren la potencialidad de estos productos como agentes de control químico.
Palabras clave: dengue, Aedes aegypti, Persea americana, larvicidas, concentración letal.
SUMMARY
Aedes aegypti is the main vector of dengue in the Americas. This disease is one of the most important arboviruses in Venezuela due to the high morbidity and mortality it produces. The absence of a vaccine against this virus has led to the indiscriminate use of insecticides causing vector resistance, environmental damage and adverse reactions in susceptible individuals. The search for effective and inexpensive ways to control dengue has led to the evaluation of plant extracts as a low environmental risk, economical alternative. The aim of this study was to assess the larvicidal effect of methanol extracts obtained from the seeds and leaves of Persea americana (avocado) on Ae. aegypti [Rockefeller and Mario Briceño Iragorry (MBI) strains]. The methanol extract obtained from the seeds proved to be the most toxic for Ae. aegypti, producing 100% mortality 24 hours post-exposure, at concentrations of 25 mg/L (Rockefeller strain) and 50 mg/L (MBI strain). The lethal concentrations (LC50) were: a) methanol seed extract LC50 = 5.7 mg/L (Rockefeller strain) and 9.9 mg/L (MBI strain), b) methanol leaf extract LC50 = 22.8 mg/L (Rockefeller strain) and 26.2 mg/L (MBI strain). These results demonstrate the toxicity of methanol extracts from avocado seeds and leaves for Ae. aegypti and suggest that these products have potential as chemical controls of this vector.
Key words: dengue, Aedes aegypti, Persea americana, larvicide, lethal concentrations
Recibido el18/05/2012 Aceptado el 09/10/2014
INTRODUCCIÓN
Pese a los esfuerzos realizados por diferentes entes gubernamentales [Dirección de Epidemiología del Ministerio para el poder popular para la Salud (MPPS), Corporación de Salud (CORPOSALUD), Laboratorio Regional para el Diagnóstico del Dengue y otras Enfermedades Virales (LARDIDEV)] el dengue sigue siendo la arbovirosis de mayor impacto en la salud de los venezolanos. Para el año 2013 se registró un incremento de 36,4% en los casos de dengue a nivel nacional (63.726 en 2013 vs 46.708 en 2012) mientras que la tasa promedio nacional de incidencia fue 211,3/100.000 habitantes la cual fue superada por 12 estados entre los que figuran los estados Aragua, Carabobo y Guárico. Se mantiene la circulación de los cuatro serotipos del virus dengue con predominio del serotipo DEN-2 (MPPS, 2013).
Debido a que aún no se cuenta con una vacuna que permita proteger a la población susceptible, el control del mosquito vector continúa siendo la única herramienta eficaz para controlar la transmisión del dengue. En este sentido, los únicos métodos para prevenir y controlar la enfermedad consisten en reducir el contacto hombre-vector, disminuir las poblaciones de mosquitos mediante el uso de insecticidas y reducir el grado de infestación de los posibles criaderos utilizando larvicidas (Rose, 2001); aunque estos métodos de control han demostrado ser eficientes bajo ciertas condiciones; se ha reportado resistencia a los insecticidas organofosforados y piretroides, utilizados para el desarrollo de las estrategias de control antes mencionadas en diferentes partes del mundo (Rodríguez et al., 2007; Gómez et al., 2011; Lima et al., 2011; Grisales et al., 2013) y además los insecticidas sintéticos pueden ocasionar daños al medio ambiente y a la salud humana (Yang et al., 2002; Chowdhury et al., 2008; Kamaraj et al., 2009).
Productos extraídos a partir de las plantas han mostrado toxicidad frente a adultos y larvas de mosquitos pertenecientes a la familia Culicidae (Pérez y Iannacone, 2004; Bagavan et al., 2009; Raghavendra et al., 2009; Kamaraj et al., 2010; Madhu et al., 2010; Kamaraj et al., 2011) y por ende tienen gran potencial para ser utilizados como herramientas en el control de especies de mosquitos vectores de enfermedades. Entre ellos destacan los extractos preparados a partir de Annona squamosa (Annonaceae, guanábana) (George & Vincent, 2005; Kihampa et al., 2009; Kamaraj et al., 2010, 2011) los cuales han demostrado importantes efectos citotóxicos sobre las células epiteliales del intestino medio de Aedes aegypti (Costa et al., 2014). Así mismo, extractos crudos y aceites esenciales obtenidos a partir de las hojas de chan (Hyptis suaveolens, Lamiaceae) han demostrado actividades repelentes e insecticidas sobre mosquitos (Jaenson et al., 2006; Conti et al., 2012; Kovendan et al., 2012).
El aguacate (Persea americana, Miller) es una planta originaria de América Central, de un elevado valor nutricional gracias a su alto contenido de proteínas y escaso contenido de colesterol. Desde el punto de vista médico, los productos derivados de esta planta tienen efectos potenciales contra parásitos y bacterias (Abe et al., 2005; Dike et al., 2012; Jiménez-Arellanes et al., 2013), efectos antioxidantes (Rodríguez-Carpena et al., 2011) y anticancerígenos (D´Ambrosio et al., 2011); así mismo, se ha señalado que los extractos acuosos obtenidos de la semilla del aguacate reducen la presión arterial (Ojewole et al., 2007) y disminuyen los niveles de colesterol (Lopéz et al., 1996) y glucosa en sangre (Lima et al., 2012).
Por otra parte, se ha descrito la actividad larvicida de extractos obtenidos a partir de la semilla del aguacate sobre larvas de Ae. aegypti (Oberlies et al., 1998; Ramos et al., 2007; Leite et al., 2009); así mismo, está documentado que extractos obtenidos a partir de este producto ocasionan daños histológicos en el intestino medio de larvas de Anopheles gambiae, principal vector de la malaria en África (Koua et al., 1998).
El propósito de la presente investigación fue evaluar el efecto larvicida de extractos metanólicos obtenidos a partir de la hoja y de la semilla del aguacate (Persea americana, variedad criolla) sobre larvas de Ae. aegypti.
MATERIALES Y MÉTODOS:
Obtención del material vegetal
Las hojas y las semillas de aguacate fueron donadas por el Sr. Eduardo Valera, propietario del Fundo Valera ubicado en la Carretera Nacional casa 3, Valle del Tucutunemo, Villa de Cura, estado Aragua. Tanto las hojas como las semillas fueron lavadas con agua corriente y entonces se dejó secar a temperatura ambiente durante, aproximadamente, una semana. Una vez seco el material se procedió a pulverizar las hojas y las semillas por separado, el polvo obtenido de cada parte de la planta se colocó a temperatura ambiente durante cuatro días en metanol a razón de 30 g de material vegetal por cada 150 mL de metanol, agitando dos veces al día. Una vez concluido el periodo de maceración se procedió a filtrar usando papel de filtro (Whatman Nº 1) y posteriormente se evaporó completamente el alcohol en baño de María a 50ºC. El residuo obtenido fue pesado y disuelto completamente en 20 mL de agua destilada. Una vez disuelto el residuo se procedió a realizar diluciones seriadas y cada una de las diluciones fue utilizada en los bioensayos para comprobar la actividad larvicida de los extractos sobre larvas de Ae. aegypti
.Para la evaluación de la actividad larvicida de los extractos obtenidos se utilizaron larvas de tercer estadio tardío y cuarto estadio temprano pertenecientes a la especie
Ae. aegypti obtenidas por el "Laboratorio de Resistencia a Insecticidas de la Dirección de Salud Ambiental del Ministerio del Poder Popular para la Salud"; Maracay en colonias establecidas a partir de material colectado en la comunidad del Sector 4 de Caña de Azúcar, Municipio Mario Briceño Iragorry, Estado Aragua (denominada en adelante MBI) y como cepa de referencia se utilizó la cepa Rockefeller. Los ejemplares fueron mantenidos bajo condiciones estándares y a una temperatura de 27 ± 2ºC, humedad relativa de 65 ± 5% y fotoperiodo de 12 horas.Evaluación de la actividad larvicida
Los bioensayos se realizaron siguiendo las recomendaciones de WHO (1981). Para el extracto
obtenido de la semilla se probaron ocho diluciones (2-50 mg/L) mientras que para el extracto obtenido a partir de la hoja se probaron seis diluciones (10-120 mg/L) y por cada dilución se realizaron cinco réplicas. Como control o testigo se usaron cinco vasos a los cuales no se agregó el extracto. De cada experimento se realizaron tres repeticiones.Las larvas fueron colocadas en una bandeja plástica con agua de chorro y de allí se seleccionaron al azar grupos de 20 larvas que fueron colocadas en vasos plásticos de 150 mL, a los cuales se añadió previamente 90 mL de agua corriente y 10 mL de cada una de las
diluciones del extracto a ensayar (Volumen final=100 mL). Todos los grupos se mantuvieron a una temperatura de 28 ± 2ºC. Los vasos controles de la prueba fueron preparados con 100 mL de agua de chorro y en ellos se colocó 20 larvas por vaso.Evaluación de la mortalidad larvaria
Las larvas fueron expuestas a los extractos en estudio durante 24 horas y éstas se consideraron muertas cuando no reaccionaban al ser tocadas con un puntero romo en la región cervical. Los ensayos se consideraron inválidos si más del 10% de las larvas empupaban y/o si la mortalidad de los controles superaba el 10% (WHO, 1981).
Análisis estadístico
Tanto las curvas dosis-respuesta como las rectas probit-logaritmo y pendientes para hallar los niveles de susceptibilidad, se realizaron mediante el programa Excel for Windows 2007. Así mismo, las concentraciones letales 50 (CL50) y sus respectivos límites de confianza fueron calculados a partir de los datos de mortalidad que se obtuvieron en las pruebas con ambos extractos metanólicos en forma manual según Finney (1971). Finalmente, las diferencias entre las dos cepas de Ae. aegypti al efecto de los extractos de P. americana fue evaluada mediante un análisis de varianza de dos vías y las diferencias significativas entre los tratamientos y/o entre las cepas de Ae. aegypti
fueron evaluadas usando la prueba de Tukey.RESULTADOS
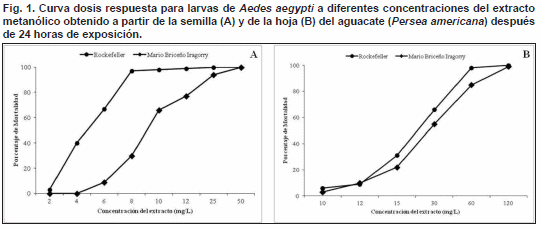
Con el extracto obtenido a partir de las semilla se obtuvo 100% de mortalidad al exponer las larvas durante 24 horas a 25 mg/L y a 50 mg/L para las larvas pertenecientes a la cepa Rockefeller y MBI, respectivamente; mientras que al usar el extracto obtenido a partir de las hojas se necesitó exponer las larvas de ambas cepas a 120 mg/L durante el mismo periodo para lograr el 100% de mortalidad (Fig. 1). En todos los casos la mortalidad en el grupo control (larvas no expuestas pertenecientes a cada cepa) fue igual a cero.
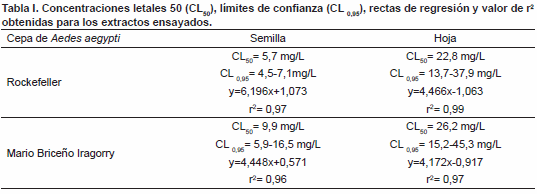
Las concentraciones letales 50 (CL50) y
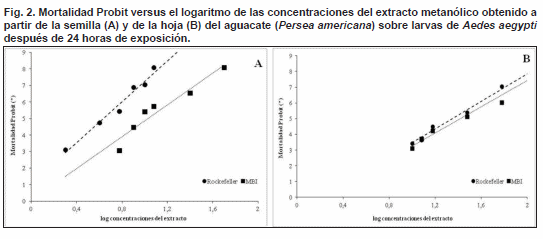
sus límites de confianza (CL 0,95) muestran que la efectividad del extracto obtenido a partir de la semilla del aguacate es superior a la efectividad observada con el extracto obtenido a partir de la hoja. Así mismo, se observó que la CL50 es menor para la cepa Rockefeller (cepa de referencia) que para la cepa MBI (cepa de campo) frente a ambos extractos (Tabla I).La Fig. 2 muestra la mortalidad larvaria en unidades probit en relación con el logaritmo de sus respectivas concentraciones después de 24 horas de exposición al extracto metanólico obtenido a partir de la semilla y de la hoja de P. americana. Las gráficas muestran un patrón de respuesta relativamente homogéneo de ambas cepas de Ae. aegypti frente a cada extracto, lo cual puede observarse en los valores obtenidos para las pendientes de las rectas de regresión (Tabla I).
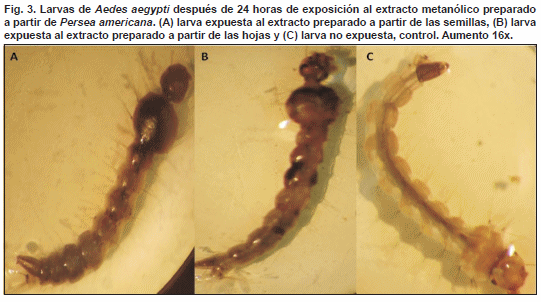
Las larvas muertas por el efecto tóxico del extracto obtenido a partir de la semilla y de la hoja del aguacate mostraron abultamiento del tórax y ennegrecimiento de su cuerpo (Fig. 3).
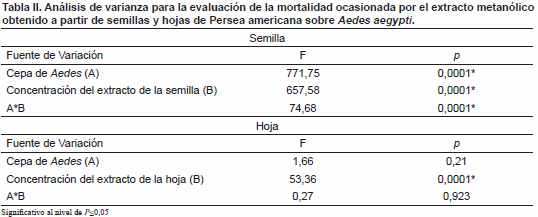
El análisis de varianza en el que se evaluó el efecto de cada variable y su interacción demostró diferencias significativas en la mortalidad ocasionada por el extracto obtenido a partir de las semillas y de las hojas pero no para los valores de mortalidad observada para ambas cepas durante su exposición al extracto metanólico obtenido a partir de la hoja (Tabla II).
DISCUSIÓN
Los resultados obtenidos muestran que ambos extractos tienen efecto letal sobre larvas de Ae. aegypti; no obstante, el efecto larvicida del extracto metanólico obtenido a partir de la semilla es superior al efecto letal ocasionado por el extracto metanólico obtenido a partir de la hoja; esto, relacionado con el hecho de que la semilla es un órgano de reserva y donde, muy probablemente, se concentren los principios activos capaces de causar toxicidad sobre las larvas en comparación con la hoja que mostró menor toxicidad (Bobadilla et al., 2005).
Los resultados obtenidos con el extracto metanólico preparado a partir de la semilla son consistentes con los obtenidos por Ramos et al. (2007), y Leite et al. (2009), quienes también observaron el efecto tóxico de un extracto metanólico obtenidos a partir de la semilla de P. americana, aunque la CL50 obtenida por ellos fue mucho mayor que la obtenida en este estudio. Las diferencias observadas en la respuesta inducida por fitoquímicos sobre una especie particular de mosquito pueden estar influida por una serie de factores que incluyen la época de recolección, la variedad empleada y el origen geográfico de la planta; así como también aspectos relacionados con la población o cepa de mosquito que se estudió y el método utilizado para evaluar la susceptibilidad del vector.
Durante el desarrollo del estudio se observó que la cepa Rockefeller es más sensible al efecto tóxico de ambos extractos; esto, probablemente se deba al hecho de ser una cepa de laboratorio no expuesta a los productos usados en los programas de control, los cuales pueden generar resistencia cruzada. Así mismo, a partir del valor de las pendientes obtenidas en las rectas de regresión se deduce que ambas cepas mostraron homogeneidad en su respuesta frente a ambos productos.
Para las condiciones en las que se llevó a cabo los ensayos, el análisis estadístico de los resultados demostró que el efecto tóxico del extracto obtenido a partir de la semilla depende tanto de la cepa utilizada como de la dosis a la cual fueron expuestas las larvas; sin embargo, el efecto tóxico del extracto preparado con la hoja del aguacate depende únicamente de la concentración empleada. Estos datos sugieren que el extracto obtenido a partir de la hoja es menos tóxico y afecta por igual a ambas cepas; por el contrario, el extracto preparado con la semilla del aguacate mostró efecto tóxico a concentraciones más baja y afectó de manera más significativa a la cepa de laboratorio.
A pesar de que el extracto metanólico obtenido a partir de la hoja de P. americana, resultó ser menos eficiente que el obtenido a partir de la semilla; que se tenga conocimiento, es la primera vez que se evalúa el potencial larvicida de esta parte de la planta y los resultados obtenidos sugieren que la hoja de la planta del aguacate también poseen compuestos químicos con actividad larvicida pero, probablemente en menor concentración.
Koua et al. (1998), describieron que extractos acuosos de P. americana tienen importantes efectos histopatológicos sobre el intestino de An. gambiae; es posible que los extractos evaluados durante el desarrollo de esta investigación ocasionen también daños importantes sobre el intestino de Ae. aegypti los cuales podrían explicar nuestras observaciones con respecto al abultamiento del tórax y ennegrecimiento del cuerpo de las larvas muertas por el efecto tóxico de los extractos.
Finalmente, aunque durante la realización de este estudio no se realizó una evaluación fitoquímica a fin de conocer los metabolitos secundarios presentes en los extractos evaluados; otros investigadores han señalado la presencia de esteroides, triterpenos, sesquiterpenlactonas y ácidos grasos tales como 1, 2, 4 trihidroxi-nonadecane y el 1, 2, 4 trihidroxi-heptadecano (Oberlies et al., 1998; Ramos et al., 2007) en los extractos obtenidos a partir de la semilla de aguacate. De acuerdo con Ramos et al. (2007), la actividad larvicida está relacionada con triterpenos y sesquiterpenlactonas presentes en el extracto metanólico obtenido a partir de la semilla de P. americana; sin embargo, es probable que la actividad larvicida se deba a la combinación exacta de los diferentes componentes presentes en los extractos obtenidos a partir de la planta más que a un compuesto en particular.
Por lo antes expuesto, se concluye que los extractos obtenidos a partir de la semilla y la hoja del aguacate representan una posible alternativa para el control de Ae. aegypti, el principal vector del dengue en las Américas.
AGRADECIMIENTOS
Al Sr. Eduardo Valera por donar el material vegetal con el cual se realizaron los ensayos aquí descritos. Al Sr. Jesús González y a la Economista Karen Flores del Laboratorio de Resistencia a Insecticidas de la Dirección de Salud Ambiental del Ministerio del Poder Popular para la Salud, por facilitar el material biológico utilizado durante el desarrollo de estos ensayos. A la Dra. Yasmín Rubio-Palis por la revisión del manuscrito. La ejecución de este trabajo de investigación fue posible gracias al financiamiento del Fondo Nacional para la Ciencia, Investigación y Tecnología (FONACIT) a través de Misión Ciencia, Sub-proyecto 2008000911-1.
REFERENCIAS
1. Abe F., Nagafuji S., Okawa M., Kinjo J., Akahane H., Ogura T., Martinez-Alfaro M. A. & Reyes-Chilpa R. (2005). Trypanocidal constituents in plants 5. Evaluation of some Mexican plants for their trypanocidal activity and active constituents in the seeds of Persea americana. Biol. Pharm. Bull. 28:
1314-1317. [ Links ]2. Bagavan A., Kamaraj C., Rahuman A. A., Elango G., Zahir A. A. & Pandiyan G. (2009) Evaluation of larvicidal and nymphicidal potential of plant extracts against
Anopheles subpictus Grassi, Culex tritaeniorhynchus Giles and Aphis gossypii Glover. Parasitol. Res. 104: 1109-1117. [ Links ]3. Bobadilla M., Zavala F., Sisniegas M., Zavaleta G., Mostacero J. & Taramona L. (2005). Evaluación larvicida de suspensiones de Annona muricata Linnaeus "guanábana" sobre
Aedes aegypti Linnaeus (Diptera, Culicidae). Rev. Peru. Biol. 12: 142-152. [ Links ]4. Chowdhury N., Ghosh A. & Chandra G. (2008).
Mosquito larvicidal activities of Solanum villosum berry extract against the dengue vector Stegomyia aegypti. BMC Complement. Altern. Med. Documento en línea. Disponible en: http://www.biomedcentral.com/1472-6882-8-10. Consultado: 2013, Septiembre, 20.5. Conti B., Benelli G., Flamini G., Cioni P.L., Profeti R., Ceccarini L., Macchia M. & Canale A. (2012). Larvicidal and repellent activity of
Hyptis suaveolens (Lamiaceae) essential oil against the mosquito Aedes albopictus Skuse (Diptera: Culicidae). Parasitol. Res. 110: 2013-2021. [ Links ]6. Costa M. S., Cossolin J. F., Pereira M. J., Sant'Ana A. E., Lima M. D., Zanuncio J. C. & Serrão J. E. (2014).
Larvicidal and cytotoxic potential of squamocin on the midgut of Aedes aegypti (Diptera: Culicidae). Toxins. 6: 1169-1176. Documento en línea. Disponible en: http://www.mdpi.com/journal/toxins6041169 Consultado: 2014, Septiembre, 28.7. D'Ambrosio S. M., Han C., Pan L., Kinghorn A. D. & Ding H. (2011). Aliphatic acetogenin constituents of avocado fruits inhibit human oral cancer cell proliferation by targeting the EGFR/RAS/RAF/MEK/ERK1/2 pathway. Biochem. Biophys. Res. Commun. 409:
465-469. [ Links ]8. Dike I. P., Obembe O. O. & Adebiyi F. E. (2012). Ethnobotanical survey for potential anti-malarial plants in south-western Nigeria.
J. Ethnopharmacol. 144: 618-626. [ Links ]9. Finney D. J. (1971).
Probit Analysis. 3º ed. Cambridge, England. University Press Cambridge.10. George S. & Vincent S. (2005). Comparative efficacy of Annona squamosa Linn. and Pongamia glabra Vent. to Azadirachta indica A. juss against mosquitoes. J. Vector Borne Dis. 42:
159-163.11. Gómez A., Seccacini E., Zerba E. & Licastro S. (2011). Comparison of the insecticide susceptibilities of laboratory strains of
Aedes aegypti and Aedes albopictus. Mem. Inst. Oswaldo Cruz. 106: 993-996. [ Links ]12. Grisales N., Poupardin R., Gomez S., Fonseca-
Gonzalez I., Ranson H. & Lenhart A. (2013). Temephos resistance in Aedes aegypti in Colombia compromises dengue vector control. PLoS Negl. Trop. Dis. 7: e2438. Documento en línea. Disponible en: http://www.plosntds.org Consultado: 2013, Septiembre, 15.13. Jaenson T. G., Pålsson K. & Borg-Karlson A. K. (2006). Evaluation of extracts and oils of mosquito (Diptera: Culicidae) repellent plants from Sweden and Guinea-Bissau.
J. Med. Entomol. 43: 113-119. [ Links ]14. Jiménez-Arellanes A., Luna-Herrera J., Ruiz-Nicolás R., Cornejo-Garrido J., Tapia A. & Yépez-Mulia L. (2013). Antiprotozoal and antimycobacterial activities of Persea americana seeds. BMC Complement. Altern. Med. 13:
109. Documento en línea. Disponible en: http://www.biomedcentral.com/1472-6882/13/109 Consultado: 2013, Agosto, 18.15. Kamaraj C., Bagavan A., Rahuman A. A., Zahir A. A., Elango G. & Padiyan G. (2009). Larvicidal potencial of medical plant extracts against
Anopheles subpictus Grassi and Culex tritaeniorhynchus Giles (Diptera: Culicidae). Parasitol. Res. 104: 1163-1171. [ Links ]16. Kamaraj C., Abdul Rahman A., Bagavan A., Abduz Zahir A., Elango G., Kandan P., Rajakumar G., Marimuthu S. & Santhoshkumar T.
(2010). Larvicidal efficacy of medicinal plant extracts against Anopheles stephensi and Culex quinquefasciatus (Diptera: Culicidae). Trop Biomed. 27: 211-219. [ Links ]17. Kamaraj C., Bagavan A., Elango G., Zahir A. A., Rajakumar G., Marimuthu S., Santhoshkumar T. & Rahuman A. A. (2011). Larvicidal activity of medicinal plant extracts against
Anopheles subpictus & Culex tritaeniorhynchus. Indian J. Med. Res. 134: 101-106. [ Links ]18. Kihampa C., Joseph C. C., Nkunya M. H., Magesa S. M., Hassanali A., Heydenreich M. & Kleinpeter E. (2009). Larvicidal and IGR activity of extract of Tanzanian plants against malaria vector mosquitoes. J. Vector Borne Dis. 46: 145-152. [ Links ]
19. Koua H. K., Han S. H. & d´Almeida M. A. (1998). Histopathology of Anopheles gambiae s.l. Giles, 1902 (Diptera, Culicidae) subjected to the larvicidal activity of the aqueous extract of Persea americana Miller, 1768 (Lauraceae). Bull. Soc. Pathol. Exot. 91:
252-256.20. Kovendan K., Murugan K., Panneerselvam C., Mahesh Kumar P., Amerasan D., Subramaniam J., Vincent S. & Barnard D. R. (2012). Laboratory
and field evaluation of medicinal plant extracts against filarial vector, Culex quinquefasciatus Say (Diptera: Culicidae). Parasitol. Res. 110: 2105-2115. [ Links ]21. Leite J. J., Brito E. H., Cordeiro R. A., Brilhante R. S., Sidrim J. J., Bertini L. M., Morais S. M. & Rocha M. F. (2009). Chemical composition, toxicity and antifungal activities of Persea americana (avocado) seed extracts. Rev. Soc. Bras. Med. Trop. 42: 110-113. [ Links ]
22. Lima C. R., Vasconcelos C. F., Costa-Silva J. H., Maranhão C. A., Costa J., Batista T. M., Carneiro E. M., Soares L. A., Ferreira F. & Wanderley A. G. (2012) Anti-diabetic activity of extract from Persea americana Mill. leaf via the activation of protein kinase B (PKB/Akt) in streptozotocin-induced diabetic rats. J. Ethnopharmacol. 141:
517-525. [ Links ]23. Lima E. P., Paiva M. H., de Araújo A. P., da Silva
E. V., da Silva U. M., de Oliveira L. N., et al. (2011). Insecticide resistance in Aedes aegypti populations from Ceará, Brazil. Parasit. Vectors. 4: 5. Documento en línea. Disponible en: http://www.parasitesandvectors.com/content/4/1/5 Consultado: 2013, Septiembre, 15.24. López R., Frati A. C., Hernández B. C., Cervantes S., Hernández M. H., Juárez C. & Morán S. (1996) Monounsaturated fatty acid (avocado) rich diet for mild hypercholesterolemia. Arch. Med. Res. 27: 519-523. [ Links ]
25. Madhu S. K., Shaukath A. K. & Vijayan V. A. (2010). Efficacy of bioactive compounds from Curcuma aromatica against mosquito larvae. Acta Trop. 113: 7-11. [ Links ]
26. MPPS (2013). Boletín epidemiológico Nº 52. Documento en línea. Disponible en: http://www.mpps.gob.ve/index.php?option=com_phocadownload & view=category&id=35:2013 & Itemid=915 Consultado: 2014, Febrero, 20.
27. Oberlies N. H., Rogers L. L., Martin J. M. & McLaughlin J. L. (1998). Cytotoxic and insecticidal constituents of unripe fruit of Persea americana. J. Nat. Prod. 61: 781-785. [ Links ]
28. Ojewole J. A, Kamadyaapa D. R, Gondwe M. M., Moodley K. & Musabayane C. T. (2007). Cardiovascular effects of Persea americana Mill (Lauraceae) (avocado) aqueous leaf extract in experimental animals. Cardiovasc. J. Afr. 18: 69-76. [ Links ]
29. Peréz D. & Iannacone J. (2004). Efecto insecticida de sacha yoco (Paullinia clavigera var. bullata Simpson) (Sapindaceae) y oreja de tigre (Tradescantia zebrina Hort ex Bosse) (Commelinaceae) en el control de Anopheles benarrochi Gabaldon, Cova García y López, 1941, principal vector de malaria en Ucayali, Perú. Ecol. Apl. 3: 64-72.
30. Raghavendra K., Singh S. P., Subbarao S. K. & Dash A. P. (2009). Laboratory studies on mosquito larvicidal efficacy of aqueous & hexane extracts of dried fruit of Solanum nigrum Linn. Indian J. Med. Res. 130: 74-77. [ Links ]
31. Ramos F., Oranday A., Rodríguez M. L., Verdes M. J., Flores A. & Ponce G. (2007). Efecto larvicida del extracto de hueso de Persea americana var. Hass en Aedes aegypti (L.). Ciencia UANL. 10:
25-28. [ Links ]32. Rodríguez M. M., Bisset J. A. & Fernández D. (2007) Levels of insecticide resistance and resistance mechanisms in
Aedes aegypti from some Latin American countries. J. Am. Mosq. Control Assoc. 23: 420-429. [ Links ]33. Rodríguez-Carpena J. G., Morcuende D., Andrade M. J., Kylli P. & Estévez M. (2011). Avocado (
Persea americana Mill.) phenolics, in vitro antioxidant and antimicrobial activities, and inhibition of lipid and protein oxidation in porcine patties. J. Agric. Food Chem. 59: 5625-5635. [ Links ]34. Rose R. (2001). Pesticide and Public Health:
Integrated Methods of Mosquito Management. Emerg. Infect. Dis. 7: 17-23. [ Links ]35. WHO (1981). Instructions for determining the susceptibility or resistance of mosquito larvae to insecticides.
WHO/VBC/81.807 Geneva: World Health Organization p.7.36. Yang Y. C., Lee S. G., Lee H. K., Kim M. K., Lee S. H. & Lee H. S. (2002). A piperidine amide extracted
from Piper longum L. fruit shows activity against Aedes aegypti mosquito larvae. J. Agric. Food Chem. 5: 3765-3767. [ Links ]











 uBio
uBio