Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Ciencias Veterinarias
versión impresa ISSN 0258-6576
Rev. Fac. Cienc. Vet. v.49 n.2 Maracay dic. 2008
Parasitismo gastrointestinal en un bioterio canino en venezuela.
Canine gastrointestinal parasites in a canine kennel in venezuela.
Jéssica Quijada*,1, Angélica Bethencourt*, Arlett Pérez*, Isis Vivas**, Aixa Aguirre* y Yuraima Reyes***
*Cátedra de Parasitología. Venezuela.
** Cátedra de Bioestadística. Venezuela.
***Sección de Caninos, Felinos y Batracios. Universidad Central de Venezuela, Facultad de Ciencias Veterinarias. Apartado Postal 4563. Maracay 2101, estado Aragua. Venezuela.
1 A quien debe dirigirse la correspondencia (To whom correspondence should be addressed) Correo-E:jessica.quijada@ucv.ve
Resumen
La Sección de Caninos, Felinos y Batracios del Bioterio la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela, cumple un papel fundamental en la docencia y la investigación en esta institución. Las gastroenteritis parasitarias, son uno de los problemas sanitarios en los caninos, cuyo control requiere de la aplicación de medidas integrales, con conocimiento epidemiológico de estas infecciones. Con el objetivo de obtener información acerca de la prevalencia y géneros parasitarios presentes, se llevó a cabo un estudio de la población de este bioterio conformada por 64 caninos mestizos, mayores de un año de edad y de ambos sexos. Mensualmente durante cinco meses, se recolectaron a primera hora de la mañana las heces que estaban presentes en cada jaula, para un total de 141 muestras, que se procesaron mediante las técnicas de Mc Master Modificada y Baerman. Se obtuvo un valor de prevalencia promedio general de infecciones con parásitos gastrointestinales durante todo el estudio de 58,10%, con prevalencias promedio mensuales entre 38,88 y 65,62%. Los valores promedio de prevalencia y rangos correspondientes de acuerdo al tipo de parásitos fueron: nematodes: Ancylostoma spp= 56,59% (33,33 a 65,62%),Strongyloides stercolaris=11,80% (0-25%) y Toxocara spp=3,80% (0-11%); se observaron además ooquistes de protozoarios del género Cystoisospora (Isospora)=19,82% (2-17%). Sólo hubo diferencias en la prevalencia de S. stercolaris por mes (p<0,05), debido probablemente a la mayor humedad ambiental durante los meses noviembre y diciembre por la presencia de lluvias; no se encontraron diferencias en la prevalencia parasitaria por sexo de hospedador (p>0,05).
(Palabras clave: Perro, sistema digestivo, nematoda, protozoa, morbosidad, Aragua)
Abstract
The Sección de Caninos, Felinos y Batracios from the Facultad de Ciencias Veterinarias at Universidad Central de Venezuela (UCV) has an important role in teaching and research in the institution. Gastrointestinal parasitism is one of the mayor diseases in canines; therefore, integral control measurements to prevent parasitism must be considered epidemiological knowledge of these parasites. In order to get data about the prevalence and parasites genera present in this population, the examination of 64 dogs of mixed breeds including both genders older than 1 year, was carried out. A total of 141 fecal samples were monthly collected, early in the morning from every cage during 5 months. Samples were processed using both Mc Master and Baerman techniques. The general average prevalence of gastrointestinal parasitism was 58.10%, being between 38.88% and 65.62% monthly. The mean prevalence and ranks according to genera were: Nematoda Ancylostoma spp=56.59% (33.33-65.62%), Strongyloides stercolaris=11.80% (0-25%) and Toxocara spp=3.80% (0-11%). In addition, other classes of parasites were observed: protozoan (coccidian) oocyst Cystoisospora (Isospora)=19.82% (2-17%). There were only differences in the prevalenceof S. stercolaris by month (p<0.05), may be as a consequence of a higher ambient humidity during November and December. There were no differences in the prevalence of parasitism according to the gender of the host.
(Key words: Dog, digestive system, nematode, protozoa, morbidity, Aragua)
Recibido: 31/01/07 - Aprobado: 29/10/08
Introducción
Uno de los problemas sanitarios mas comunes de toda población de hospedadores caninos son las gastroenteritis parasitarias, cuyo control requiere de la aplicación de medidas integrales, con conocimiento epidemiológico de estas infecciones. Las parasitosis gastrointestinales son de las mas comunes infecciones de los caninos, provocándoles de moderadas a serias alteraciones de la salud. El parasitismo gastrointestinal en los caninos, como en todos los animales domésticos, tiene una etiología de diversa naturaleza, (protozoarios, helmintos). Estos parásitos cohabitan en el tracto digestivo, sumando los efectos negativos que cada uno produce (Cordero et al., 1999; Asano et al., 2004; Ramírez-Barrios et al., 2004; Ponce-Macotela et al., 2005; Dalimi et al., 2006; Fontanarosa et al., 2006; Pullola et al., 2006). Por otra parte, el parasitismo gastrointestinal del canino representa un riesgo zoonótico por nemátodes de los géneros: Ancylostoma, Toxocara, Strongyloides, y cestodes como: Echinococcus y Dipylidum (Benito et al., 2006; Sommerfelt et al., 2006; Dubná et al., 2007a; Gonçalves et al., 2007), así como protozoarios: Giardia spp, Cryptosporidium entre otros (Ponce-Macotela et al., 2005). Considerando que la población canina de la Sección de Caninos, Felinos y Batracios del Bioterio de la Facultad de Ciencias Veterinarias de la Universidad Central de Venezuela está destinada para fines de docencia e investigación y que por lo tanto, debe garantizarse el mejor estado sanitario de estos animales a fin de proteger su salud y en consecuencia la de las personas que trabajan en este bioterio (empleados, estudiantes, profesores, investigadores), se planteó una evaluación parasitológica a fin de determinar el perfil del parasitismo gastrointestinal de esta población canina, identificar los grupos parasitarios prevalentes y su distribución dentro de la población.
Materiales y Métodos
El estudio se llevó a cabo en la Sección de Caninos, Felinos y Batracios de la Facultad de Ciencias Veterinarias (FCV) de la Universidad Central de Venezuela (UCV), ubicada a 436 m.s.n.m. en la ciudad de Maracay (10 15´00 N, 67 39´00 O), en el estado Aragua, en la región centro-norte costera de Venezuela. El bioterio cuenta con 34 jaulas, con piso de concreto, paredes de 60 cm de alto seguidas por 1,20 m de malla metálica tipo ciclón (Alfajol®). La muestra estuvo conformada por la totalidad de la población canina de ese bioterio para el momento del estudio: 64 caninos mestizos, mayores de un año de edad y de ambos sexos (38 hembras y 26 machos); los cuales se ubican por pares del mismo sexo, en cada jaula. Los caninos de carácter feroz se alojan solos. A los caninos una vez que ingresan a la sección, se les administra un antihelmíntico, ivermectina 1% (200 µg/Kg pv) y luego cada tres meses junto con el resto de la población. Para el momento del inicio del presente estudio, habían transcurrido 2 meses desde la última administración de antihelmínticos; no habiendo administración de alguna dosis hasta el final de la evaluación. El manejo sanitario de la población, incluye además la aplicación de una vacuna antirrábica y una triple viral (Adenovirus, Parvovirus, Distemper).
El estudio se realizó durante cinco meses continuos (octubre 2006 a febrero 2007). El período de lluvias en Venezuela es de mayo a noviembre, extendiéndose algunas lluvias hasta diciembre, aunadas a un descenso en la temperatura ambiental.
Una vez al mes se recolectaron, a primera hora de la mañana con bolsas de polietileno (nuevas e identificadas), las heces que estaban presentes en cada jaula, obteniéndose un total de 141 muestras, que se procesaron mediante la técnica de Mc Master y de Baerman Modificada a fin de detectar larvas de Strongyloides stercolaris (Rivera, 1996; Bowman, 1999). De las heces presentes en cada jaula se hizo un pool para que la evaluación fuese representativa del par de caninos alojados allí.
De acuerdo al número de animales positivos a infección parasitaria por muestreo (con presencia de al menos un parásito), se determinó el valor de prevalencia, término que se calculó y definió de acuerdo a Margolis et al. (1982). Los valores de prevalencia mensual por parásito, por sexo de los caninos y por muestreo se analizaron utilizando pruebas estadísticas no paramétricas: Kruskal-Wallis y Chi cuadrado (c2), utilizando en ambos casos un valor de a= 0,05. El paquete estadístico empleado fue el SAS (Statistical Analysis System) versión 8.2 (SAS, 1998).
Resultados y Discusión
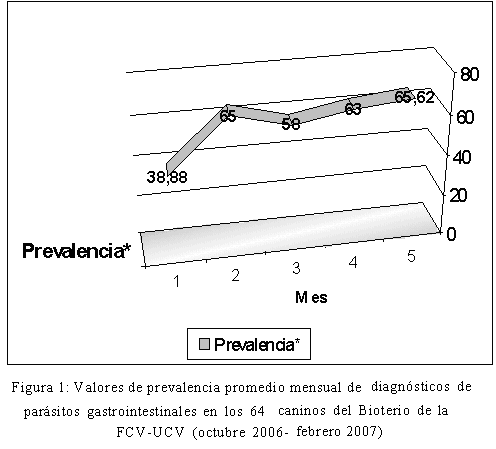
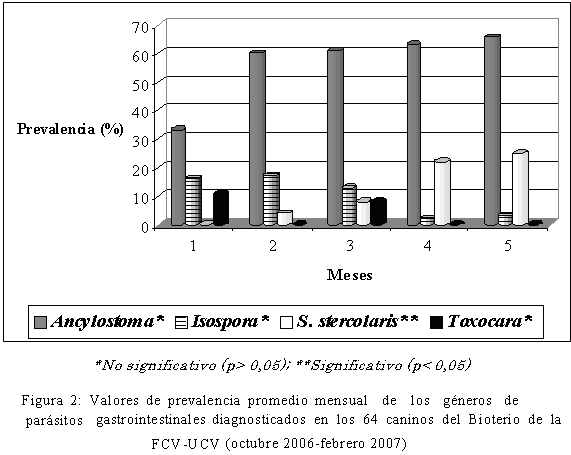
El valor de prevalencia promedio general de infecciones con parásitos gastrointestinales durante todo el estudio fue de 58,10% (Figura 1) con un valor máximo en el último mes de evaluación de 65,62%, lo que puede indicar el desarrollo normal de la intensidad parasitaria en función del tiempo. Los valores de prevalencia promedio obtenidos resultaron mayores que los obtenidos por Ramírez-Barrios et al. (2004) de 35,5% en Venezuela, por Pullola et al. (2006) de 5,9% en Finlandia y Papazahariadou et al. (2007) de 26% en Grecia; sin embargo, se debe considerar que las poblaciones caninas evaluadas por estos investigadores correspondían a pacientes de clínicas veterinarias, de lo que se infiere que su control sanitario era superior, al tener atención médico veterinaria regular y por tener estatus de mascota, que supone una mejor alimentación, menor estrés, planes sanitarios completos, etc. No obstante, al comparar los resultados obtenidos con estudios realizados en criaderos (kennels) y refugios caninos, continúan siendo altos, en relación a los valores de prevalencia de parasitismo gastrointestinal reportados por Gonçalves et al. (2007) en Brasil de 36,5% y 23,9% de Palmer et al. (2008) en Australia. De esta manera, observamos que solamente el valor promedio mínimo de prevalencia de infecciones parasitarias mensuales, obtenido en el presente estudio (38,88%) se aproxima a los reportados para caninos que tienen algún tipo de supervisión veterinaria; aspecto que sin lugar a dudas limitó de alguna manera la prevalencia parasitaria en la población estudiada, cuando comparamos los valores de prevalencia obtenidos con aquellos reportados para caninos sin supervisión veterinaria alguna (perros callejeros o realengos): 63% en Sudáfrica, 85% en México, 41,7% en la República Checa; 71,33% en España (Minnaar et al., 2002; Eguía-Aguilar et al., 2005; Dubná et al., 2007b; Martínez-Moreno et al., 2007). En cuanto a las formas parasitarias (huevos, larvas y ooquistes) identificadas durante la evaluación, correspondieron a los helmintos nematodos: Ancylostoma spp, Toxocara spp y Strongyloides stercolaris y el protozoario Isospora spp. Los valores de prevalencia promedio mensual de cada uno de estos parásitos se muestran en la Figura 2. El parásito más prevalente fue Ancylostoma spp, siendo los valores promedio y rangos de prevalencia por parásito observados durante el estudio de: Ancylostoma spp 56,59% (33,33-65,62%), Strongyloides stercolaris 11,80% (0-25%) y Toxocara spp 3,80% (0- 11%). Sólo se hallaron diferencias estadísticas entre los meses de muestreo, para los valores de prevalencia promedio mensual de Strongyloides stercolaris entre los cinco meses de evaluación (p<0,05). Los tres nemátodes que conforman la helmintofauna parasitaria de esta población canina, tienen carácter zoonótico: Ancylostoma spp, Toxocara spp y Strongyloides stercolaris, por lo que resulta necesario evaluar el riesgo de infección tanto del personal que labora en este bioterio, como el de los estudiantes, profesores e investigadores que se relacionan con esta población canina (Gonçalves et al., 2007).
En relación a los parásitos observados, la prevalencia de Ancylostoma y Toxocara coinciden en proporción con la mayoría de los estudios de prevalencia parasitaria en caninos que se revisaron, en los que se señalan a estos dos nematodes como los más prevalentes en caninos. En particular, el valor de prevalencia promedio de Ancylostoma spp observado (56,59%) se aproxima al reportado por Eguía-Aguilar et al. (2005) de 62,5%, en perros callejeros; pero en ese estudio el valor de Toxocara fue mayor (13,3%) al observado en el presente trabajo (3,8%). En general, la proporción helmíntica de Ancylostoma spp, Toxocara spp y Strongyloides stercolaris en esta población estudiada, coincide con la reportada por varios investigadores en distintas latitudes (Ramírez-Barrios et al., 2004; Pullola et al., 2006; Ponce-Macotela et al., 2005; Eguía-Aguilar et al., 2005; Dubná et al., 2007b; Martínez-Moreno et al., 2007; Papazahariadou et al., 2007; Palmer et al., 2008), aún cuando el número de especies observadas por esos autores fue mayor que el de esta investigación.
El valor de prevalencia observada (19,82%) de Isospora o Cystoisospora, resultó ser mayor que el de otros valores reportados, ubicándose por debajo de un 18,3% de prevalencia, y siempre por debajo de los valores de prevalencia helmíntica (Ramírez-Barrios et al., 2004; Freites et al., 2007); los parásitos del género Isospora, resultaron ser los segundos más prevalentes en la evaluación realizada en este bioterio.
Llama la atención que aún cuando los céstodes representan un importante componente de la fauna parasitaria de los caninos (Cordero et al., 1999; Minnaar et al., 2002; Sánchez et al., 2003; Eguía-Aguilar et al., 2005; Dubná et al., 2007b; Martínez-Moreno et al., 2007; Papazahariadou et al., 2008) no se observaron en ninguna de las evaluaciones coproparasitológicas realizadas, macro (proglotides) y microscópicamente. No obstante, cabe mencionar que los estudios en los que se reporta la presencia de cestodes en menor o mayor proporción, se realizaron evaluaciones a caninos callejeros o realengos, lo que explica que en esos hospedadores, debido a sus condiciones de vida (hábitos de predación, ingestión de hospedadores intermediarios de céstodes), es común el establecimiento de estas parasitosis. Esto a su vez guarda relación con la presencia de huevos de céstodes en heces, como un importante hallazgo en las evaluaciones de heces y/o suelo de parques y zonas de recreación, aunque si bien es cierto que los huevos de Toxocara spp suelen ser los más frecuentes (Rubel et al., 2003; Sánchez et al., 2003; Rubel y Wisnivesky, 2005; Benito et al., 2006; Cazorla et al., 2007; Palmer et al., 2007).
Los valores de prevalencia parasitaria del presente estudio, coinciden en cuanto a proporciones y especies parasitarias (Ancylostoma spp, Toxocara spp, S. stercolaris e Isospora spp, respectivamente) con los que describen Ramírez-Barrios et al. (2004), si bien es cierto que los valores de prevalencia que reportan fueron mayores que los de esta investigación, y los caninos que ellos evaluaron eran pacientes de un hospital veterinario. Sin embargo, resulta una información muy valiosa para comparar los datos obtenidos en el presente estudio, por cuanto es una investigación realizada también en Venezuela (Maracaibo, estado Zulia) y puede marcar una tendencia acerca de la fauna parasitaria en caninos de este país. En ese mismo estado, Freites et al. (2007), evaluaron una población canina de diferentes grupos etarios, observando una prevalencia de parásitos intestinales de 53,9%, los parásitos observados fueron: Ancylostoma spp (45,5%), Toxocara spp (38,2%) e Isospora spp (10,7%). La prevalencia promedio general de infección parasitaria elevada descrita por Freites et al. (2007), estuvo en función de que el grupo más afectado fue el de cachorros menores a 9 meses de edad (grupo de edad más susceptible al parasitismo gastrointestinal) y que presentó elevadas prevalencias que aumentaron el promedio general.
En relación con la presentación de las infecciones por mes de muestreo, sólo se observaron (Figura 2) diferencias estadísticas para la prevalencia de Strongyloides stercolaris (p<0,05), a diferencia de lo observado por Ramírez-Barrios et al. (2004) y Freites et al. (2007) quienes no encontraron diferencias de prevalencia por mes de muestreo para ningún parásito. La diferencia en cuanto a la prevalencia de Strongyloides stercolaris, como explicaron Gonçalves et al. (2007), puede estar relacionado a pobres o deficientes condiciones higiénicas, sobre todo en cuanto a niveles de humedad ambiental se refiere, tomando en cuenta que el estudio se llevó a cabo en época de lluvias, y a que la humedad ambiental en el bioterio es alta. Por otro lado, la relativamente alta prevalencia, considerando que los caninos eran mayores de un año de edad y por tanto inmunológicamente más resistentes a este parasitismo, está en relación como explican dichos autores, a las autoinfecciones producidas por las larvas infectivas (L3) de S. stercolaris, que pueden desarrollarse a nivel intestinal en los hospedadores caninos, elevando la prevalencia de infección al eliminar la fase ambiental del ciclo del parásito (Cordero et al., 1999; Ferreira-Junior et al., 2006). Por otro lado, se puede considerar el comportamiento de S. stercolaris en hospedadores humanos en quienes, como señala Girard (2005), aumenta la susceptibilidad a S. stercolaris con la edad del hospedador, distinto a lo que pasa con las otras especies de Strongyloides en sus respectivos hospedadores.
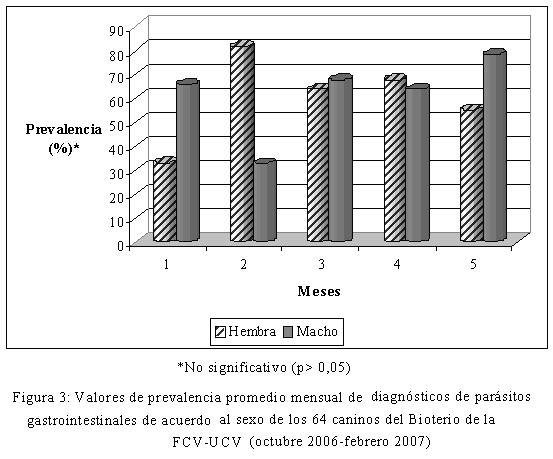
Con respecto a la distribución de las infecciones por sexo del hospedador, datos que se muestran en la Figura 3, no hubo diferencias estadísticas (p>0,05) entre los valores de prevalencia parasitaria entre sexos, lo cual coincide con los hallazgos de Ramírez-Barrios et al. (2004), Fontanarosa et al. (2006) y Freites et al. (2007). Ambos sexos tuvieron la misma susceptibilidad a estas infecciones, bajo las condiciones del presente estudio.
Por otra parte, los niveles parasitarios observados, hacen pensar en la necesidad de evaluar la efectividad de los tratamientos antihelmínticos que se aplican a esta población, en cuanto a: calidad del principio activo, forma de aplicación y más allá de eso, cuáles medidas ambientales son llevadas a cabo para reducir la contaminación ambiental con formas parasitarias infectivas (Kopp et al., 2007). Los huevos de los parásitos de los caninos son muy resistentes a las condiciones ambientales, como señalan Sánchez et al. (2003). Un huevo de Echinococcus granulosus puede permanecer viable hasta 41 meses en el ambiente, una larva de S. stercolaris puede permanecer viable por 18 días en el suelo (Girard, 2005). Por otra parte, se debe valorar el hecho de que independientemente de las medidas de control aplicadas en un criadero canino como explican Becker et al. (1977), existe una interacción bioclimática que involucra al hospedador canino y la vida extraparasitaria de los parásitos (huevos, ooquistes y larvas) y que son factores determinantes en el establecimiento del parasitismo gastrointestinal. Por otra parte, la continua presencia de parásitos gastrointestinales en los caninos bajo las condiciones de este bioterio, merece considerar mas allá de las condiciones higiénicas, manejo, tratamientos antihelmínticos, edad, raza y sexo de los animales, el papel de las formas infectivas (huevos larvados) que pueden subsistir en el pelo de los mismos, principalmente los de pelo largo o con doble capa. Las formas infectivas bajo esas condiciones pueden ser una importante fuente de infección para poblaciones caninas en cautiverio (Aydenizöz-Özkayhan et al., 2008; Roddie et al., 2008), ya que las cargas parasitarias presentes allí, pueden llegar a ser mayores a las que se reportan en el suelo (Roddie et al., 2008).
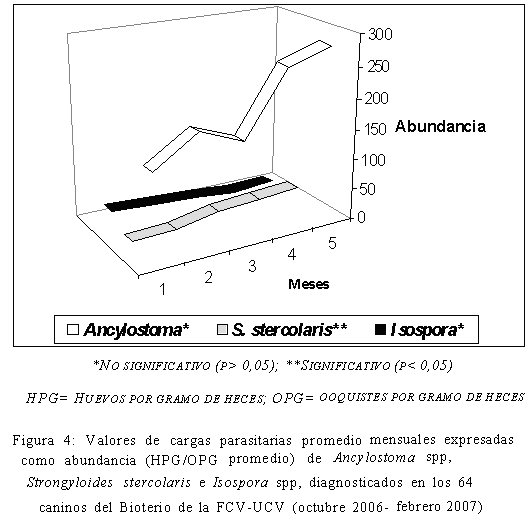
Sin embargo, aunque los niveles de prevalencia obtenidos fueron altos, desde el punto de vista clínico los valores de huevos por gramo de heces (HPG) y ooquistes por gramo de heces (OPG) obtenidos (Figura 4), parecen no haber tenido importancia clínica en virtud de que no se observaron heces diarréicas durante los muestreos, que son un buen indicador de fuerte parasitismo gastrointestinal en los caninos (Rubel et al., 2003; Sánchez et al., 2003), lo cual puede expresar el desarrollo de algún grado de resistencia o resiliencia parasitaria desarrollado por los caninos evaluados hacia los parásitos, que reduce la cantidad de huevos, ooquistes y larvas de parásitos liberados en las heces (Fahrion et al., 2008). Aún cuando todos los cánidos bajo una alta presión de infección, como parece ocurrir en este bioterio, están a riesgo de sufrir estas infecciones (Aydenizöz-Özkayhan et al., 2008; Fahrion et al., 2008). Asimismo, se debe considerar que los caninos evaluados son mestizos, lo cual los hace genéticamente más resistentes que un canino de raza pura (Cordero et al., 1999; Ramírez-Barrios et al., 2004).
Recomendaciones
Debido a los altos valores de prevalencia parasitaria observados, se recomienda revisar el programa de aplicación de antihelmínticos a la población canina; ajustar las dosis de antihelmínticos o cambiar de principio activo, vigilar la calidad de los principios activos (laboratorio de prestigio, fecha de caducidad, condiciones de almacenamiento del producto); instaurar la aplicación de desinfectantes y/o flameados regulares en las jaulas, para eliminar las formas infectivas (huevos, ooquistes, larvas) del medio ambiente. Por el carácter zoonótico de Ancylostoma spp, Toxocara spp y Strongyloides stercolaris, se recomienda evaluar y educar al respecto, a todo el personal que labora en este bioterio.
Agradecimiento
Al Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela (CDCH-UCV), por el financiamiento de esta investigación (Nº 11.275.2006).
Referencias
1. Asano, K.; Suzuky, K.; Matsumoto, T.; Sakai, T.; Asano, R. 2004. Prevalence of dogs with intestinal parasites in Tochigi, Japan in 1979, 1991 and 2002. Vet. Parasitol., 120: 243-248. [ Links ]
2. Aydenizöz-Özkayhan, M; Yagci, B.; Erat, S. 2008. The investigation of Toxocara canis eggs in coats of different dog breed as a potential transmission route in human toxocariasis. Vet. Parasitol., 152:94-100. [ Links ]
3. Becker, S.; Selby, L.; Hutcheson, D.; Hacker, D. 1977. The asssociation of selected climatic factors with natural alimentary parasites of the dogs. Environ. Res., 14:141-151. [ Links ]
4. Benito, A.; Carmena, D.; Joseph, L.; Martínez, J.; Guisantes, J. 2006. Dog echinococcosis in northern Spain: comparison of coproantigen and serum antibody assay with coprological exam. Vet. Parasitol., 142:102-111. [ Links ]
5. Bowman, D. 1999. Georgis Parasitology for Veterinarians. 7ª ed. W. B. Saunders Company. Philadelphia. pp. 285-396. [ Links ]
6. Cazorla, D.; Morales, P.; Acosta, M. 2007. Contaminación de suelos con huevos de Toxocara spp (Nematoda, Ascaridida) en parques públicos de la ciudad de Coro, estado Falcón, Venezuela. Rev. Científ. FCV LUZ, 17:117-122. [ Links ]
7. Cordero, M.; Rojo, F.A.; Martínez, A.R.; Sánchez, M.C.; Hernández, S.; Navarrete, I.; Diez, P.; Quiroz, H.; Carvahlo, M. 1999. Parasitología Veterinaria. Mc Graw Hill Interamericana de España, S. A. U. Madrid. 968 p. [ Links ]
8. Dalimi, A.; Sattari, A.; Motamedi, G. 2006. A study of helminthes of dogs, foxes and jackals in the western part of Iran. Vet. Parasitol., 142:129-133. [ Links ]
9. Dubná, S.; Langrová, I.; Jankosvká, I.; Vadlejch, J.; Pekár, S.; Nápravník, J.; Fetchner, J. 2007a. Contamination of soil with Toxocara eggs in urban (Prague) and rural areas in the Czech Republic. Vet. Parasitol., 144: 81-86. [ Links ]
10. Dubná, S.; Longrová, I.; Nápravník, J.; Jankovská, I.; Vadlejch, J.; Pékar, S.; Fechtner, J. 2007b. The prevalence of intestinal parasites in dogs from Prague, rural areas and shelters of the Czech Republic. Vet. Parasitol., 145:120-128. [ Links ]
11. Eguía-Aguilar, P.; Cruz-Reyes, A.; Martínez-Maya, J. 2005. Ecological analysis and description of the intestinal helminthes present in dogs in Mexico City. Vet. Parasitol., 127:139-146. [ Links ]
12. Fahrion, A.; Staebler, S.; Deplazes, P. 2008. Patent Toxocara canis infections in previously exposed and in helminth-free dogs after infection with low numbers of embryonated eggs. Vet. Parasitol., 152:108-115. [ Links ]
13. Ferreira-Junior, A.; Gonçalves, M.; Silva, D.; Gonçalves, A.; Costa-Cruz, J. 2006. Parasitological and serological diagnosis of Strongyloides stercolaris in domesticated dogs from southeastern Brazil. Vet. Parasitol., 136:137-145. [ Links ]
14. Fontanarosa, M.; Vezzani, D.; Basabe, J.; Eiras, D. 2006. An epidemiological study of gastrointestinal parasites of dogs from southern greater Buenos Aires (Argentina): age, gender, breed, mixed infections, and seasonal and spatial patterns. Vet. Parasitol., 136: 283-295. [ Links ]
15. Freites, A.; Freites, C.; Martínez-Freites, M.; Freites, A.R. 2007. Prevalencia de parásitos intestinales en perros domésticos de comunidades rurales del Estado Zulia, Venezuela. Bol. Malariol. Salud Amb., 47 (suppl.1): 311. [ Links ]
16. Girard, R. 2005. Consideraciones sobre la epidemiología de Strongyloides stercolaris. Parasitol. Latinoam., 60 (1) Número extraordinario: 113. [ Links ]
17. Gonçalves, A.; Machado, G.; Gonçalves-Pires, M.; Ferreira-Júnior, D.; Silva, D.; Costa-Cruz, J. 2007. Evaluation of strongyloidiasis in kennel dogs and keepers by parasitological and serological assays. Vet. Parasitol., 147:132-139. [ Links ]
18. Kopp, S.; Kotze, A.; Mc Carthy, J.; Coleman, G. 2007. High-level pyrantel resistance in the hookworm Ancylostoma caninum. Vet. Parasitol., 143:299-304. [ Links ]
19. Margolis, L.; Esch, G.W.; Colmes, J. C.; Kuris, A.M.; Schad, G.A. 1982. The use of ecological terms in parasitology (Report of an ad hoc committee of the American Society of Parasitologist). J. Parasitol., 68:131-133. [ Links ]
20. Martínez-Moreno, F.; Hernández, S.; López-Cobos, E.; Becerra, C.; Acosta, I.; Martínez-Moreno, A. 2007. Estimation of canine intestinal parasites in Cordoba (Spain) and their risk to public health. Vet. Parasitol., 143:7-13. [ Links ]
21. Minnaar, W.; Krecek, R.; Fourie, L. 2002. Helmiths in dogs from a peri-urban resource-limited community in Free State Province, South Africa. Vet. Parasitol., 107:343-349. [ Links ]
22. Palmer, C.; Traub, R.; Robertson, I.; Hobbs, R.; Elliot, A.; While, L.; Rees, R.; Andrew, R. 2007. The veterinary and public health significance of hookworm in dogs and cats in Australia and the status of A. ceylanicum. Vet. Parasitol., 145:304-313. [ Links ]
23. Palmer, C.; Thompson, A.; Traub, R.; Rees, R.; Robertson, J. 2008. National study of the gastrointestinal parasites of dogs and cats in Australia. Vet. Parasitol., 151:181-190. [ Links ]
24. Papazahariadou, M.; Founta, A.; Papadopoulos, E.; Chliounakis, S.; Antoniadou-Sotiriadou, K.; Theodories, Y. 2007. Gastrointestinal parasites of shepherd and hunting dogs in the Serres Prefecture, Northern Greece. Vet. Parasitol., 148:170-173. [ Links ]
25. Ponce-Macotela, M.; Peralta-Abarca, G.; Martínez-Gordillo, M. 2005. Giardia intestinalis and other zoonotic parasites: prevalence in adults dogs from the southern part of Mexico City. Vet. Parasitol., 131:1-4. [ Links ]
26. Pullola, T.; Vierimaa, J.; Saari, S.; Virtala, A.; Nikander, S.; Sukura, A. 2006. Canine intestinal helminth in Finland: prevalence, risk factors and endoparasites control practices. Vet. Parasitol., 140:321-326. [ Links ]
27. Ramírez-Barrios, R.; Barboza-Mena, G.; Muñoz, J.; Angulo-Cubillán, F.; Hernández, E.; González, F.; Escalona, F. 2004. Prevalence of intestinal parasites in dogs under veterinary care in Maracaibo, Venezuela. Vet. Parasitol., 121:11-20. [ Links ]
28. Rivera, M. 1996. Manual de prácticas de enfermedades parasitarias. FCV-UCV. 60 p. [ Links ]
29. Roddie, G.; Stafford, P.; Holland, C.; Wolfe, A. 2008. Contamination of dog hair with eggs of Toxocara canis. Vet. Parasitol., 152:85-93. [ Links ]
30. Rubel, D.; Zunino, G.; Santillán, G.; Wisnivesky, C. 2003. Epidemiology of Toxocara canis in the dog population from two areas of different socioeconomic status, Greater Buenos Aires, Argentina. Vet. Parasitol., 115:275-286. [ Links ]
31. Rubel, D.; Wisnivesky, C. 2005. Magnitude and distribution of canine fecal contamination and helminth eggs in two areas of different urban structure, Greater Buenos Aires, Argentina. Vet. Parasitol., 133:339-347. [ Links ]
32. Sánchez, P.; Jensen, O.; Mellado, I.; Torrecillas, C.; Flores, M.; Minvielle, M.; Basualdo, J. 2003. Presence and persistence of intestinal parasites in canine fecal material collected from the environment in the province of Chubut, Argentine Patagonia. Vet. Parasitol., 117:263-269. [ Links ]
33. SAS. 1998. In: SAS/STAT. User´s guide(Release 6.03 ed). SAS Institute Inc. Cary, NC. [ Links ]
34. Sommerfelt, I.; Cardillo, N.; López, C.; Ribicich, M.; Gallo, C.; Franco, A. 2006. Prevalence of Toxocara cati and other parasites in cat´s faeces collected from the open spaces of public institutions: Buenos Aires, Argentina. Vet. Parasitol.,140:296-301. [ Links ]