Universidad, Ciencia y Tecnología
versión impresa ISSN 1316-4821
uct vol.17 no.67 Puerto Ordaz jun. 2013
Trabajo de investigación bibliográfica estructura y propiedades de fatiga del titanio y sus aleaciones usadas como biomateriales
González Leonardo1
1 Profesor Jubilado UNEXPO Vicerrectorado Puerto Ordaz Venezuela. lgdavinci41@gmail.com
Resumen:
Un biomaterial es todo material diseñado y fabricado para interactuar, satisfactoriamente, con cualquier medio biológico, principalmente con el cuerpo humano. Estos materiales pueden ser metálicos, cerámicos y plásticos. Por la misma actividad dinámica y rítmica del cuerpo humano, la propiedad mecánica más importante a evaluar es su resistencia a la fatiga, mientras que su propiedad fisicoquímica más importante es su resistencia a la corrosión. Por ello los procesos de deterioro de implantes y prótesis en el sistema óseo están asociados con procesos de corrosión-fatiga. Tanto la estructura cristalográfica como la estructura metalográfica son la base fundamental para un determinado comportamiento en la falla por fatiga en estos materiales. Por esta razón los procesos de fabricación y de tratamientos térmicos juegan un papel importante en el desempeño del dispositivo en servicio, aunque, desde luego, esto involucra un costo. Para los fines del presente estudio se hará un resumen muy breve de las propiedades de resistencia a la fatiga mecánica, fatiga con corrosión y de estructura del titanio y sus aleaciones, usadas actualmente como biomateriales.
Palabras clave: Biomateriales/ Fatiga/ Aleaciones de Titanio/ Estructura/ Transformaciones de fase/ Prótesis/ Implante/ Osteogénesis/ Osteosíntesis/ Nitinol.
Structure and fatigue properties of titanium and its alloys used as biomaterials
Abstract:
A biomaterial is any material which has been made and designed to interact, properly, with a biological environment, mainly human body. Biomaterials can be classified as: metallic, ceramics and plastics. As a consequence of dynamic and human activities, the most important mechanical property to evaluate is the fatigue resistance, whereas the physicochemical one is corrosion resistance. For this reason, failures in many implants and prostheses at the osteosystem occur by corrosion-fatigue processes. In these issues the metallographic and crystallographic structures play an important role in the behavior of these devices during service. Making, shaping and heat treating processes are also extremely important to acquire such high quality properties, although an additional cost is involved. For the scope of this subject mechanical fatigue strength, corrosion-fatigue strength and structure of titanium and its alloys, used nowadays as biomaterials, will be considered in shortly.
Keywords: Biomaterials/ Fatigue/ Titanium Alloys/ Structure/ Phase Transformations/ Prostheses/ Implants/ Osteogeneses and Osteosyntheses/ Nitinol
I. INTRODUCCION
Un biomaterial es cualquier material diseñado y fabricado para formar un dispositivo con el objeto de interactuar, satisfactoriamente, con un medio biológico, principalmente el cuerpo humano. Esto abarca desde hilos para suturas en intervenciones quirúrgicas hasta materiales empleados, como prótesis e implantes, en ortopedia, traumatología y odontología.
Una prótesis es un aparato o dispositivo diseñado y fabricado con la finalidad de sustituir total o parcialmente a un órgano del cuerpo humano, el cual falta, o no funciona apropiadamente, por un accidente, una enfermedad o por razones congénitas. Las prótesis pueden ser fijas o removibles.
Un implante es un material biológico inerte, absorbible o no, o un dispositivo que se coloca en alguna parte del cuerpo para ayudar a la recuperación de un tejido o un órgano, o por razones estéticas, sin ocasionar daños colaterales. Los implantes pueden ser temporales o permanentes, esto es una vez recuperado el tejido deben retirarse o bien dejarse si son biodegradables y absorbibles por el cuerpo humano sin daños colaterales.
Cuando las lesiones del tejido óseo son pequeñas el cuerpo humano puede autorrepararse. Esta reparación recibe el nombre de osteogénesis, aunque el término se refiere, en general, al proceso de formación del esqueleto mediante la formación del osteoblasto, que es la célula productora de sustancia ósea. Una vez hecha la reparación, el osteoblasto da paso al osteocito que es la célula del hueso plenamente desarrollado.
Sin embargo, lesiones serias del tejido óseo necesitan ayuda externa para su completa recuperación. La intervención quirúrgica que permite la fijación mecánica de los fragmentos óseos de una fractura, por medio de una pieza hecha de un biomaterial, se llama osteosíntesis.
El presente trabajo está dirigido a las aleaciones metálicas usadas como prótesis e implantes en el sistema óseo y cardiovascular. Para que un material se considere un biomaterial para el tejido óseo debe cumplir con las siguientes características:
1) Ser biocompatible, esto es tener la capacidad de adaptarse al medio biológico sin producir daños colaterales. Para ello, después de la osteosíntesis, debe: a) no ser tóxico, b) no ser cancerígeno, c) no producir alergia, d) no afectar al sistema inmunológico y e) no producir infección.
2) Facilitar la osteogénesis, lo cual se logra mediante una completa integridad estructural del dispositivo. Para ello el biomaterial debe ser resistente al fenómeno corrosión-fatiga y tener una adecuada interacción superficial con el hueso y con el medio que lo rodea, a objeto de evitar desplazamientos, y asegurar una osteointegración.
Hay factores ajenos al biomaterial, pero que son importantes para el buen desempeño del dispositivo, como son: la bioingeniería, la osteosíntesis, el estado de salud del paciente y su voluntad de aceptación o rechazo del dispositivo.
Los biomateriales se pueden clasificar desde el punto el punto de vista biológico y de de material, según su comportamiento ante el tejido o según el tipo de material del que está hecho respectivamente. La interacción biológica tiene lugar entre las superficies del tejido y la del biomaterial y, en el caso del sistema óseo, es la que determina la osteointegración. Esta interacción biológica, además de ser un fenómeno de intercara, es completamente de naturaleza fisicoquímica, por lo que involucra fenómenos de cinética, termodinámica, moleculares y difusión.
Desde el punto de vista biológico los biomateriales se clasifican de la siguiente manera:


El precio de los materiales y de la osteosíntesis son factores muy limitantes que atenta contra la calidad de vida de muchísimos pacientes.
En el presente trabajo estudiaremos el titanio y sus aleaciones usados como biomateriales, principalmente Ti-6Al-4V, haciendo énfasis en su estructura metalográfica y cristalográfica y su relación con las propiedades de fatiga mecánica y fatiga con corrosión, para ser usados en ortopedia, odontología y traumatología. También se señalarán algunas características del nitinol.
II. DESARROLLO
1. Antecedentes
Fuera de los milagros de Jesús de Nazaret [1,2], que se consideran regénesis, el hombre ha tratado de reparar su organismo, desde tiempos ancestrales, como lo demuestra un implante del dedo gordo del pie, encontrado en una momia egipcia de hace 3000 años A.C [3]. La historia señala que se hicieron progresos en las épocas de los imperios griego y romano y a lo largo de la edad media, principalmente en el campo de la suturación de heridas. Durante la primera y segunda guerra mundial los médicos observaron que el cuerpo humano podía tolerar las inclusiones de astillas de metralla y de vidrio, en soldados de infantería y pilotos de combate, lo que permitió la experimentación con metales en traumatología y vidrio en oftalmología. Hasta el siglo XVIII se usaba solamente el oro y la plata en implantes quirúrgicos; en el siglo XIX se introdujo el acero inoxidable y en el siglo XX las aleaciones de titanio y las de memoria de forma. Para el siglo XXI la prótesis de palo y garfios de los piratas darán paso a prótesis robóticas.
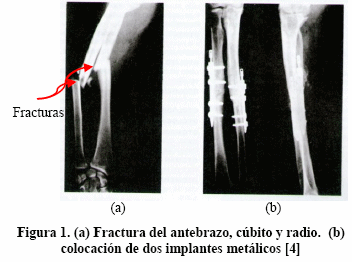
En la Figura.1 se puede apreciar dos implantes para reparar las fracturas de los huesos del antebrazo, cúbito y radio, hechos con material metálico, probablemente titanio o acero inoxidable [4].
2. Fenómeno de corrosión-fatiga
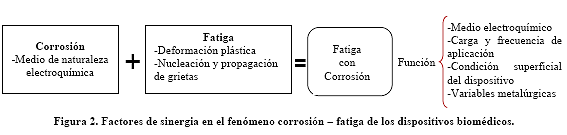
La corrosión es un fenómeno químico o electroquímico mientras que la fatiga es un fenómeno mecánico. Por separado producen fallas en los metales, de modo que combinados tienen un efecto de sinergia. En la Figura 2 se muestra este efecto en los dispositivos biomédicos.
De la Figura 2 puede verse que el fenómeno corrosión-fatiga en los dispositivos biomédicos depende de: medio electroquímico (saliva, sangre, tejido, etc.); carga y frecuencia de aplicación (el dispositivo en los miembros superiores o inferiores, en el sistema cardiovascular, en la columna vertebral, costillas, etc.); de las condiciones superficiales (inclusiones, rayado, dureza) y de las variables metalúrgicas de la aleación (nivel de inclusiones no metálicas, naturaleza de las fases presentes, tamaño de grano, modos de deformación, partículas de precipitados, etc.).
3. Técnica Experimental
Los ensayos de fatiga en biomateriales, en general, siguen el mismo curso que los ensayos de fatiga ordinarios, usando máquinas para ensayos de flexión alternativa, flexión rotativa y de tracción-compresión, esto último en máquinas de tracción con servomecanismo donde se puede seleccionar una amplia variedad de condiciones de frecuencia y carga, incluyendo las de muy baja frecuencia denominadas oligofrecuencias, esto es menores a 10 Hz.
Las condiciones superficiales de las probetas es uno de los factores más importantes a considerar en un mismo lote, lo que muchas veces no es fácil de controlar, lo que podría origina una gran dispersión en los resultados. Los ensayos de tracción, impacto y tenacidad siguen su curso ordinario.
Las normas ASTM que rigen estos ensayos, entre otras, son las siguientes:
E647: Standard Test Method for Measuring of Fatigue Crack Propagation.
F136: Standar Specifications for Wrought Titanium-6 Aluminum-4 Vanadium ELI (extra low interstitial) Alloy for surgical Implant Application.
F1472: Standard Specifications for Wrought Titanium- 6 Aluminum-4 Vanadium for Surgical Implants Applications.
F67: Standard Test Method for unalloyed Titanium, for Surgical Implant Applications.
4. Comparación elástica de los biomateriales
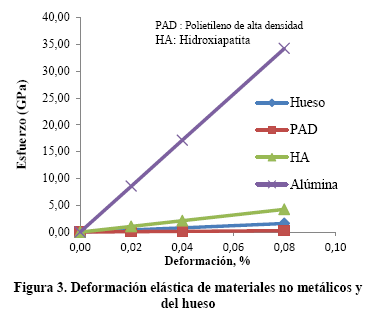
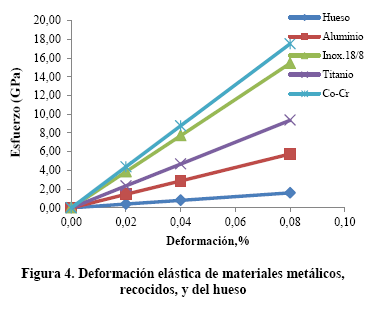
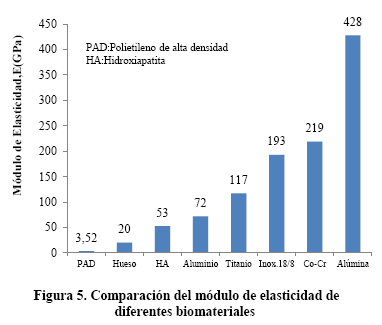
Las propiedades elásticas de los biomateriales, módulo de elasticidad y resistencia a la fluencia, son de las más importantes en bioingeniería y en su comportamiento a fatiga. En la Figura 3 se compara la deformación elástica de materiales no metálicos con el hueso. En la Figura 4 se compara la deformación elástica de materiales metálicos, en estado de recocidos, con el hueso
En la Figura 5 se tiene un diagrama de barras donde se muestra la variación del módulo de elasticidad de los diferentes materiales. El módulo de elasticidad es una medida de la rigidez del material. Para una misma carga, un implante de titanio se deforma seis veces menos que el hueso y como consecuencia de la restricción que existe en el hueso, por la presencia de un implante, se desarrollan esfuerzos opuestos al del implante. Así, durante la acción de caminar, la pierna apoyada está sometida a compresión y la pierna en el aire está sometida a tracción, por la acción muscular, lo que produce un ciclo alternado, asimétrico, tracción compresión sobre el implante. Esto se traduce en fatiga.
5. El titanio y sus aleaciones
El titanio es un metal de transición, número atómico 22, peso atómico 47,90 g/molg, densidad 4,5 g/cm3 (experimental), punto de fusión 1812 °C, siendo las minas de titanio abundantes en la naturaleza, ocupando el décimo puesto como el elemento más común.
En estado de recocido, la razón resistencia a la fluencia/densidad es 250 MPa/(g/cm3), no obstante sus aleaciones presentan valores mayores. Este valor es mayor que el del aluminio, 150MPa/(g/cm3), y significativamente mayor que el del acero inoxidable 316L, 40MPa/(g/cm3), ambos en estado de recocido. Esta propiedad es sumamente importante tanto en bioingeniería como en aeronáutica.
A 882°C el titanio sufre una transformación alotrópica, pasando, por calentamiento, de estructura hexagonal compacta (hc), llamada Ti-b, a cúbica centrada en el cuerpo (cc), llamada Ti-a. Esto se puede escribir así:
![]()
Las celdas del titanio tiene los siguientes parámetros cristalográficos [5]: celda a(hc) a= 2,9504Å, c=4,6833Å, lo cual conduce a una relación c/a=1,587; celda b (cc), a=2,9504Å. Las densidades, calculadas, del Ti-a y del Ti-b son 4,51 y 4,31 g/cm3 respectivamente.
Como consecuencia de esta transformación alotrópica, los elementos químicos que entran en solución sólida con el titanio se clasifican en estabilizadores de la fase a y estabilizadores de la fase b.
Los estabilizadores de la fase a son: Al, que entra en solución sólida sustitucional; C, H, N, O que entran en solución sólida intersticial, colocándose en las posiciones c/2.
Los estabilizadores de la fase b son: V, Nb, Cr, Fe, Mo, Cu los cuales son, a excepción del cobre, metales de transición y entran en solución sólida sustitucional. En esta fase los intersticiales ocupan, preferentemente, posiciones octaédricas: centro de las caras P (½, ½, 0)! y centro de las aristas P(½, 0, 0)! (!=permutación de las coordenadas de los puntos).
Basado en los estabilizadores, las aleaciones de titanio pueden ser toda-a, toda-b y mezcla a+b. Así tenemos [6]:
a) Toda-a: Ti+5%Al+2,5%Sn
b) Toda-b: Ti+13%V+11%Cr+3%Al.
Ti+11,5%Mo+6%Zr+4,5%Sn
Ti+8%Mo+8%V+2%Fe+3%Al
c) Mezcla a+b: Ti+6%Al+4%V
Ti+6%Al+2%Sn+4%Zr+6%Mo
Un nuevo grupo de aleaciones de titanio han sido desarrolladas con fines médicos, ellas son [7]:
a) Toda-b: Ti+15%Mo
Ti+12%Mo+6%Zr+2%Fe
Ti+15%Mo+2,8%Nb+3%Al+0,2%Si
Ti+15%Mo+2,8%Nb+0,2%Si
Ti+13%Nb+13%Zr
b) Mezcla a+b: Ti+6%Al+7%Nb
Ti+15%Sn+4%Nb+2%Ta+0,2%Pd
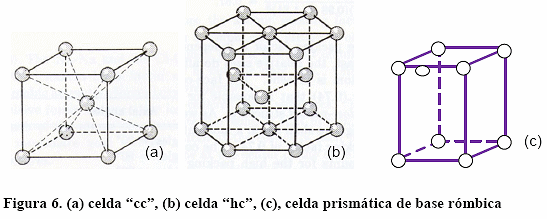
En la Figura 6 se puede ver la celda unitaria "cc", "hc" y la celda prismática de base rómbica de esta última, la cual será útil más adelante. La celda "hc" contiene tres celdas prismáticas de base rómbica.
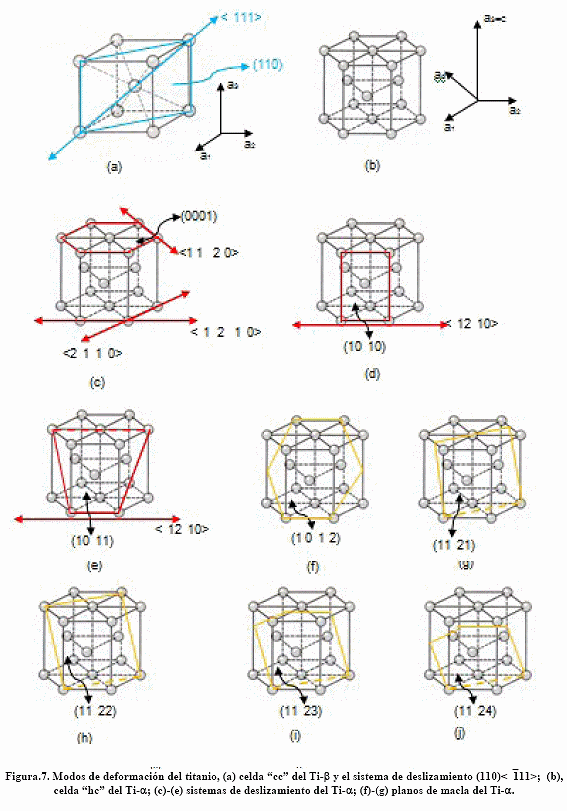
En la Figura 7 se tienen los diferentes sistemas de deformación que presenta el titanio y sus aleaciones. En la Figura.7(a) se tiene la estructura "cc" del Ti-b con sus sistema de deformación por deslizamiento (110) <![]() 11>; en la Fig.7 (b) se tiene la celda "hc" ara el Ti-a. Para el Ti-a se tienen los siguientes sistemas de deformación por deslizamiento: (0001) <11
11>; en la Fig.7 (b) se tiene la celda "hc" ara el Ti-a. Para el Ti-a se tienen los siguientes sistemas de deformación por deslizamiento: (0001) <11 ![]() 0>; (10
0>; (10 ![]() 0) <
0) <![]() 2
2 ![]() 0>; (10
0>; (10 ![]() 1) <
1) <![]() 2
2 ![]() 0>
0>
Planos de deformación por macla: (10 ![]() 2), (11
2), (11 ![]() 1), (11
1), (11 ![]() 2), (11
2), (11 ![]() ,3), (11
,3), (11 ![]() 4).
4).
Tal variedad de sistemas de deformación hacen del titanio y sus aleaciones materiales fáciles de trabajar en caliente y en frío adquiriendo notable ductilidad, desarrollando los fenómenos conocidos como superelasticidad y superplasticidad.
El titanio tiene gran avidez por el C, N, H y O y el efecto de estos intersticiales en las propiedades mecánicas de tracción y de fatiga son notables. Se puede determinar la cantidad de oxígeno presente por análisis instrumental, pero es costumbre expresar la cantidad de los intersticiales en función del oxígeno equivalente, atendiendo a las reacciones siguientes:
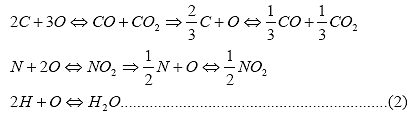
Lo cual conduce a:
% oxígeno equivalente % O + 2/3 (%C) +½(%N) + 2(%H).. (3)
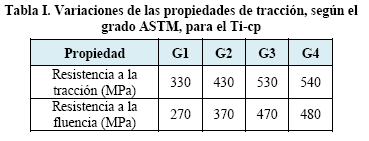
Dado que es difícil evitar la contaminación del titanio, no solamente durante su obtención como metal por el proceso Kroll, sino durante su trabajado en caliente, se han desarrollado normas para lo que se denomina "titanio comercialmente puro" (Ti-cp). Entre estas normas se tienen las ATSM B256, B338, B367 y F67, en grados 1, 2, 3 y 4, cuya diferencia estriba en el contenido de oxígeno y hierro como impureza.
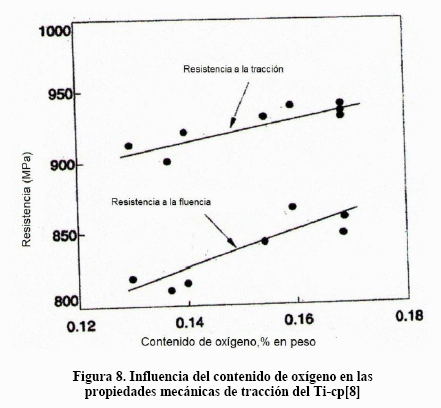
En la Figura 8 se aprecia el efecto del oxígeno en la resistencia a la tracción y a la fluencia del Ti-cp [8].
Sin embargo, es más fácil medir las propiedades de tracción que determinar el contenido de intersticiales. Por esta razón, las características de tracción de los grados de Ti-cp se pueden ver en la Tabla I.
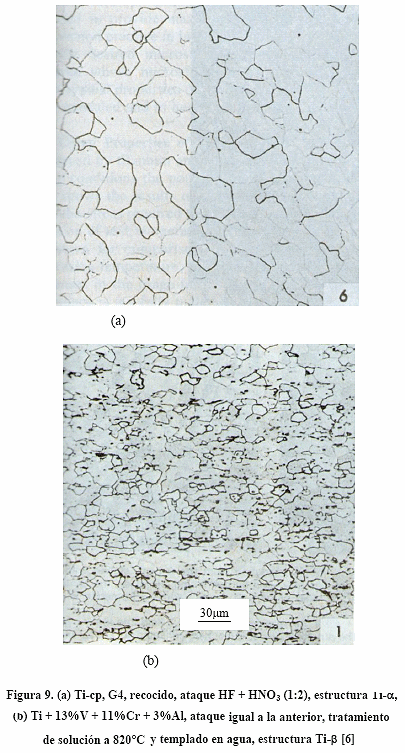
En la Figura 9a se puede ver la microestructuras óptica del Ti-cp, G4, recocido, la cual corresponde a Ti-a [6]. En la Fig.9b se tiene la microestructura óptica de la aleación Ti + 13%V +11%Cr + 3%Al con tratamiento térmico de envejecimiento, la cual corresponde a Ti-b [6].
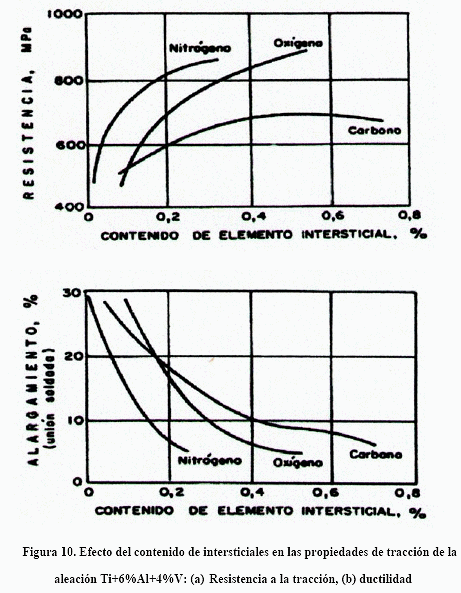
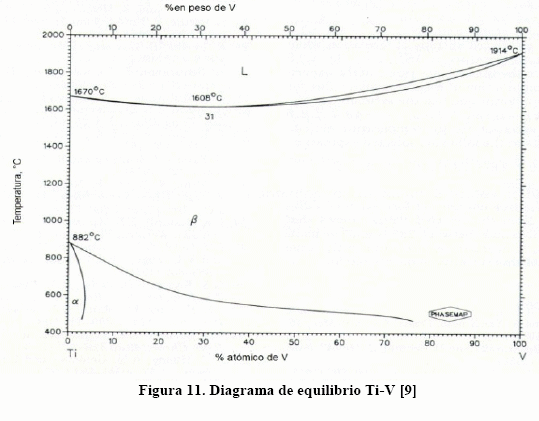
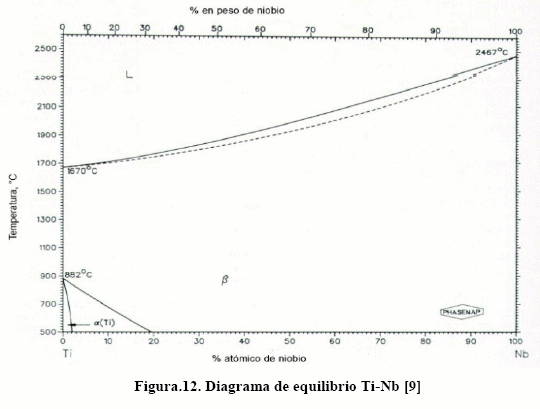
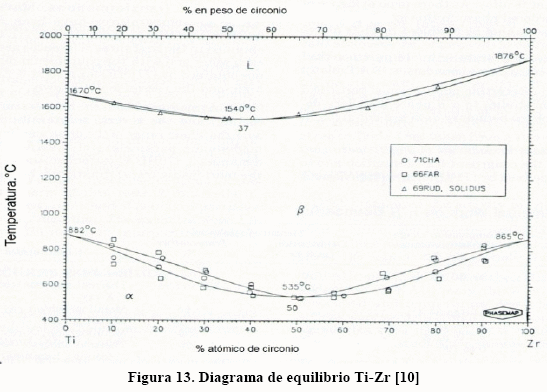
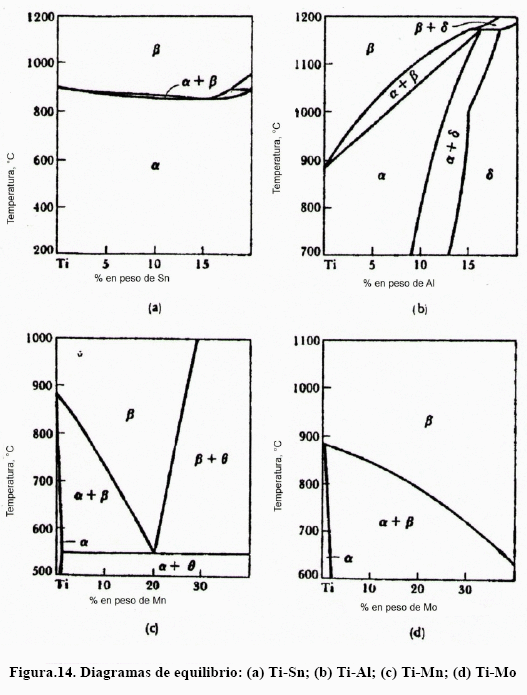
La aleación de titanio que más se usa con fines médicos, en implantes y prótesis, es la Ti-6Al-4V. Para estas aleaciones el efecto de los intersticiales en las propiedades mecánicas también es notable, como puede verse en la Figura 10. Puede verse que este efecto endurecedor es particularmente notable para el nitrógeno, lo que se le atribuye a la formación de compuestos intersticiales de nitruros de titanio, aluminio y vanadio. No obstante, las soluciones sólidas sustitucionales de V y Nb y las propias solucione sólidas intersticiales de estos elementos tienen efecto endurecedor. Resulta por demás interesante conocer los diagramas de equilibrio binarios Ti-V, Ti-Nb, Ti-Zr y otros más, los cuales se muestran en las Figuras 11-14.
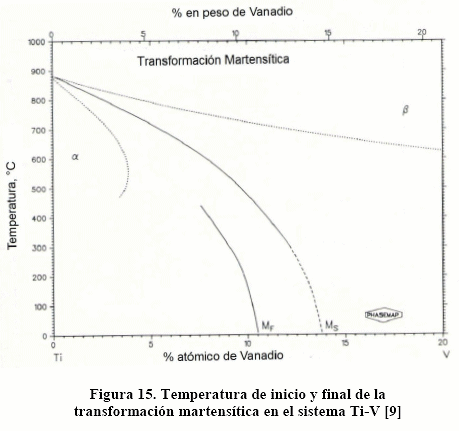
Puede verse, de los diagramas de las Figs. 11-14, que, con excepción del diagrama Ti-Al, el campo b se amplía. Las aleaciones de titanio son susceptibles de transformadas por envejecimiento y por temple y revenido, para lo cual es necesario que contenga suficiente cantidad de fase b. Esto puede verse con más facilidad en la Figura. 15, donde se muestra la temperatura de inicio (Ms) y final (Mf) de la transformación martensítica para el sistema Ti-[9].
De la Figura 15, a medida que aumenta el contenido de elementos estabilizadores de la fase b disminuye Ms, a tal punto que con suficiente cantidad la transformación martensítica no se ejecuta. Así, con 15% V la transformación martensítica no se ejecuta.
El titanio es un metal que forma una capa de TiO2 que lo hace resistente a la corrosión, particularmente a fluidos corporales, y manifiesta una buena osteointegración. Las estructuras metalográficas y cristalográficas son de capital importancia para las propiedades de fatiga de las aleaciones de titanio usadas como biomaterial en implantes y prótesis para el tejido óseo, particularmente en la aleación Ti-6Al-4V. Consideremos algunas muestras sometidas a diferentes tratamientos térmicos:
Figura 16: Ti-6Al-4V: Calentada a 910°C (campo a + b) durante 20h, pasada a un horno a 790°C (campo a) durante 1h y luego templada en agua.
Figura 17: Ti-6Al-4V: Calentada en el campo b (1050°C) y pasada a un horno a 930°C (campo a + b ) durante 46h, templada en agua, revenido a 770°C (campo a) y templada de nuevo en agua.
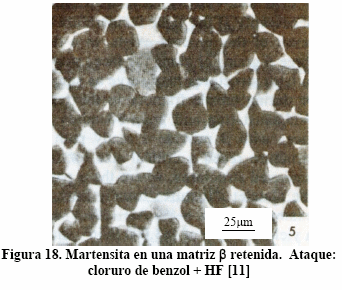
Figura 18: Ti-6Al.4V: Calentamiento a 1050°C (campo b) durante 1h y temple en agua. Se supone que el ataque es cloruro de benzol + HF. La escala es calculada.
Figura 19. Ti-6Al-4V: Calentada a 930°C (campo a + b) durante 72h y templada en agua, envejecida 2h a 740°C (campo a) y templada nuevamente en agua.
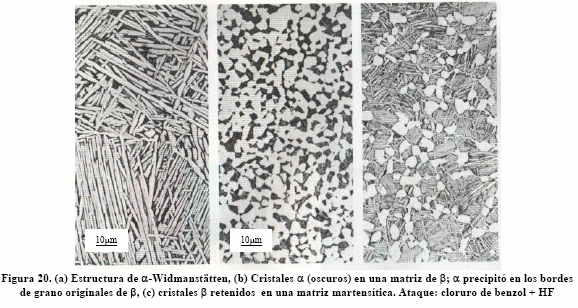
Los tratamientos térmicos anteriores muestran que la fase b se puede transformar en placas a-Widmanstätten, en granos equiaxiales y/o facetados a, en estructura masiva a formada en bordes de grano de b y en estructura acicular martensítica, dependiendo de la temperatura de la transformación y, desde luego, de la cantidad de elementos estabilizadores de la fase b.
Si la aleación se calienta en el campo b (>1030°C) y luego se pasa al campo a + b (entre 830 y 1030°C), para que la reacción b → a se ejecute, el resultado es a-Widmanstätten formado en los originales cristales b y precipitado masivo de a en los bordes de grano de b, como puede apreciarse en las Figuras 17 y 20 (a).
Si la aleación se calienta en el campo b y se hace un normalizado, el resultado es cristales a en una matriz de b retenida, debido a que el enfriamiento es lo suficientemente rápido para evitar que la reacción b→a se ejecute completamente, a causa de los b estabilizadores, como puede verse en la Figura 20(b).
Si la aleación se calienta en el campo b y se templa en agua, algunos cristales de b se retienen y otros se transformarán en martensita, como puede verse en la Figura 20(c).
Los estudios en microscopía electrónica de transmisión y de difracción de rayos X demuestran que pueden haber dos tipos de martensita: martensita a¢, la cual es hc, y a², la cual es ortorrómbica, ambas sobresaturadas con respecto a b. La primera es propia de las aleaciones diluidas; la última, con mayor contenido de elementos b-estabilizadores de las aleaciones, es propia de las aleaciones concentradas. La martensita de la aleación Ti-6Al-4V es a¢.
El revenido de a¢ o a² produce un fino precipitado de partículas a (hc) o b (cc) y es la base para mejorar la tenacidad de las aleaciones de titanio, particularmente la Ti-6Al-4V.
La fase b retenida se puede descomponer, por el revenido a 550°C, para formar una solución sólida cc, llamada b¢, que contiene menos elementos b-estabilizadores que la original b. Los elementos de aleación expulsados de la fase b forman un fino precipitado complejo, llamado w, de estructura hc. w, en suficiente cantidad, fragiliza completamente el material.
La aleación Ti-6Al-4V, y particularmente la Ti-6Al-2Sn-4Zr-6Mo, puede ser endurecida por envejecimiento. Para ello se calienta en el campo bifásico a +b (830 a 1030°C) y se enfría rápidamente en un tratamiento de solución, con lo cual las fases a y b quedan en una situación de metastabilidad; posteriormente se calienta a 650°C y la fase b precipita finamente en la matriz a, endureciendo y reduciendo marcadamente la ductilidad. La fase a recupera su estabilidad y recibe el nombre de a original.
Considérese que b tiene una densidad menor que la matriz a, de modo que en el mismo volumen entra menor cantidad de materia cuando b reemplaza a a, de modo que a comprime a b y a la vez se deforma aumentando la densidad de dislocaciones con lo que se endurece la matriz.
Wilhelm Gerard Burgers y Johannes Martinus Burgers fueron dos hermanos holandeses, metalurgistas, que vivieron a mediados del siglo XIX. Johannes es célebre por haber inventado, en 1839, el vector que lleva su apellido, el cual cierra el circuito alrededor de las dislocaciones y que permite identificar su naturaleza.
Wilhelm es célebre por haber propuesto la existencia de las dislocaciones de hélice y por haber establecido, mediante difracción de rayos X, la existencia de una relación de orientación entre las placas de titanio a-Widmanstätten y la matriz b. Tal relación es:
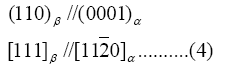
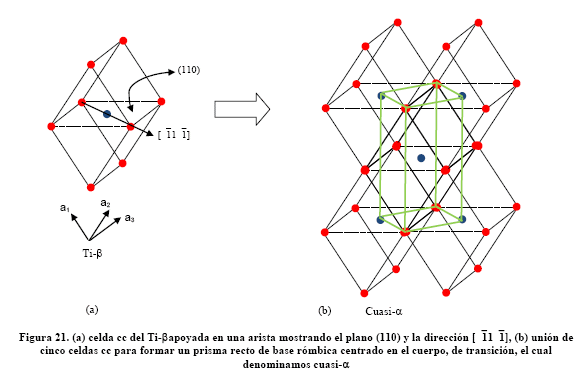
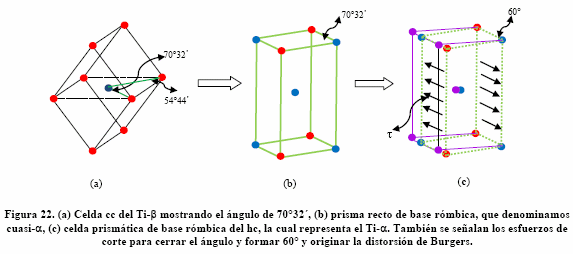
Para dar forma gráfica a esta relación consideremos el cristal cúbico de Ti-b apoyado sobre una arista, como se muestra en la Figura 21(a) La unión de cinco celdas cúbicas forma un prisma recto de base rómbica, centrado en el cuerpo como se muestra en la Figura 21(b), el cual denominamos cuasi-a. Este prisma tiene un ángulo basal de 70°32´, como se muestra en la Figura 22 (b). Sin embargo, como el prisma de Ti-a es hc, debe cerrarse 10°32´ en la dirección [11 ![]() 0], para generar un prisma recto de base rómbica de 60°, como el mostrado en la Figura 6(c). Para ello se deben crear esfuerzos residuales de corte t en los planos prismáticos (10
0], para generar un prisma recto de base rómbica de 60°, como el mostrado en la Figura 6(c). Para ello se deben crear esfuerzos residuales de corte t en los planos prismáticos (10 ![]() 0) y (
0) y (![]() 010), como se muestra en la Figura 22(c), lo que se conoce como distorsión de Burgers.
010), como se muestra en la Figura 22(c), lo que se conoce como distorsión de Burgers.
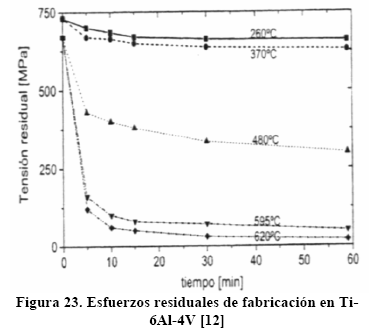
Resulta particularmente llamativo los enormes esfuerzos residuales que pueden resultar después de la laminación en frío de la aleación Ti-6Al-4V, como se muestra en la Figura 23 [12], lo cual está en estrecha relación con la distorsión de Burgers.
Puede verse, de la Figura 23, que un recocido para alivio de tensiones reduce el esfuerzo residual, efecto que es tanto mayor cuanto mayor es la temperatura de recocido.
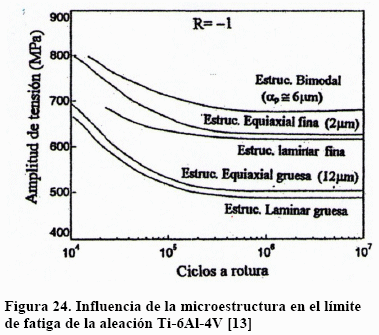
Los esfuerzos residuales que resultan en la intercara a/b son responsables de la nucleación de grietas en las placas a-Widmanstätten durante los ensayos de fatiga. Cuanto mayor es el tamaño de la placa tanto mayor es el tamaño de la grieta, alcanzando su valor crítico y propagándose. En la Figura 24 se puede ver este efecto [13].
Puede verse que, para la misma morfología, la estructura con granos a-equiaxiales finos tienen mayor límite de fatiga que el grueso y lo mismo ocurre con la estructura Widmanstätten fina. La estructura formada por mezcla fina de a y b es la que tiene mejor comportamiento debido a que los cristales bloquean el movimiento de las grietas de fatiga.
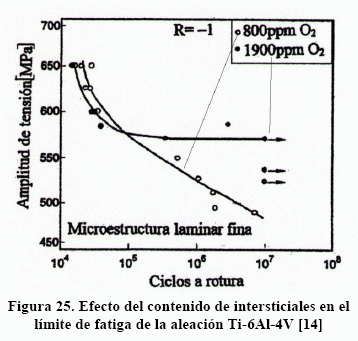
Un detalle importante de la Figura 24 es que todas las microestructuras muestran un límite de fatiga. Sin embargo, la incorporación de intersticiales cambia este comportamiento haciendo desaparecer el límite de fatiga, como se muestra en la Figura 25 [14].
El incremento de intersticiales aumenta la resistencia a la tracción (Figura 10) y también la resistencia a la fluencia. Ello se traduce en mayor dificultad para que las dislocaciones se muevan dificultando la deformación plástica e incrementando el límite de fatiga.
Sin embargo, la relación de orientación de Burgers ofrece una interpretación más sutil sobre el efecto de los intersticiales. Cuando los planos de deslizamiento de a-Widmanstätten tienen cualquier dirección éstos continúan en la matriz b y la deformación continua sin dificultad, Sin embargo, cuando los planos son paralelos a la interfase a/b la pequeña diferencia en desplazamiento entre ambas fases, debido a la pequeña variación en los vectores Burgers, produce discordancias en la interfase que generan dislocaciones. La condensación de estas dislocaciones produce microcavidades, siguiendo el mecanismo propuesto por Karl Zener, las cuales al coalescer producen separación de la fase a-Widmanstätten de la matriz y grieta en la intercara a/b. Esto es lo que normalmente se observa en las fractografías de este tipo de microestructura [11]. La presencia de intersticiales representa un lastre para que las dislocaciones, en la interfase, se muevan y condensen. Por ello se incrementaría el límite de fatiga. Sin embargo, el incremento de intersticiales disminuye la ductilidad reduciendo el conformado y la tenacidad.
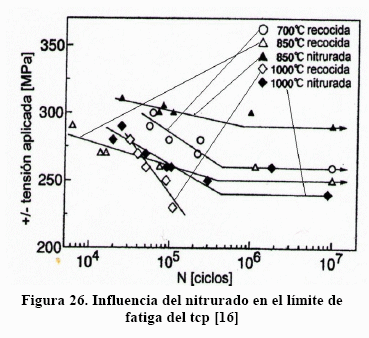
Los investigadores médicos [11,15], reportan que el titanio y sus aleaciones no resisten esfuerzos de corte y que no son aconsejables en las uniones metal-metal de las artroprótesis, desaconsejándolo completamente en uniones con tornillos y clavos. Todo ello a consecuencia de los excesivos desgastes en prótesis y aflojamiento de implantes. Para mejorar este comportamiento tribológico, el tcp ha sido endurecido superficialmente mediante nitruración y ensayada a fatiga, como se muestra en la Figura 26 [16]
A medida que aumenta la temperatura de recocido disminuye el límite de fatiga y a 1000°C desaparece. En el material nitrurado la temperatura de nitruración es un factor crítico. A menor temperatura de nitruración mayor el límite de fatiga por el efecto del tamaño de grano,
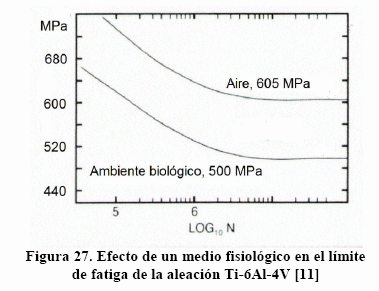
Un efecto que merece la pena considerar es la corrosión-fatiga en la aleación Ti-6Al-4V, como se muestra en la Figura. 27 [11], donde el límite de fatiga desciende de 605 a 500 en un medio fisiológico.
En 1961 William Buehler y su grupo desarrollaron una aleación 50% at. Ni-50% at. Ti, que llamaron nitinol (NiTi Naval Ordnance Laboratory), la cual presenta varias características interesantes: a) la denominada memoria de forma (shape memory alloy), b) superelasticidad, c) superplasticidad. Esta aleación, con esta disposición equiatómica, es una solución sólida ordenada, como lo es Ti3Al, en el campo d, del diagrama Ti-Al (Fig.14b), la cual no debe confundirse con la Al3Ti, que es un compuesto intermetálico. Esta aleación, de excelente biocompatibilidad está siendo usada para diferentes dispositivos biomédicos.
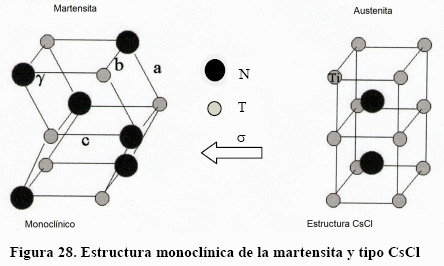
La memoria de forma no es la propiedad que interesa en el campo biomédico sino la superelasticidad. El NiTi es una estructura tipo CsCl, llamada austenita la cual, mediante esfuerzos, en el intervalo -50 a 110°C, puede transformarse a una estructura monoclínica llamada martensita, que sólo por remembranza se les ha dado el mismo nombre que en los aceros.. Ambas estructuras son ordenadas, como se ve en la Fig. 28. Puede verse que, a consecuencia del orden, existen muchos planos de macla, por lo que ambas estructuras se pueden deformar por maclaje. Sin embargo, lo interesante es que este maclaje ocurre en el campo elástico.
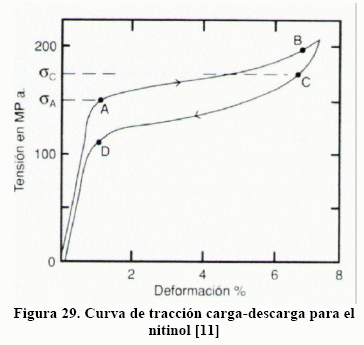
En la Figura 29 [11] se tiene una curva de tracción, carga-descarga, para el nitinol a temperatura ambiente. A temperatura ambiente la estructura estable es la austenita. El trayecto OA representa la deformación elástica de la austenita. Al llegar al punto "A", el esfuerzo sA se inicia el maclaje de la austenita cuyo proceso produce un cambio de estructura cristalina y pasa a monoclínico, esto es martensita, siendo la base de la elasticidad Esta transformación hace que las maclas sólo aparezcan en la martensita. A medida que aumenta la carga, el maclaje continúa de modo que la intercara austenita/martensita se mueve progresivamente a lo largo de AB, dejando tras de sí martensita En el punto "B" toda la austenita se ha transformado en martensita y lo que sigue es la deformación elástica, no lineal, de la martensita, el cual puede llegar hasta 10%, una cantidad considerable si se compara con la gran mayoría de las aleaciones metálicas que no superan el 1%.
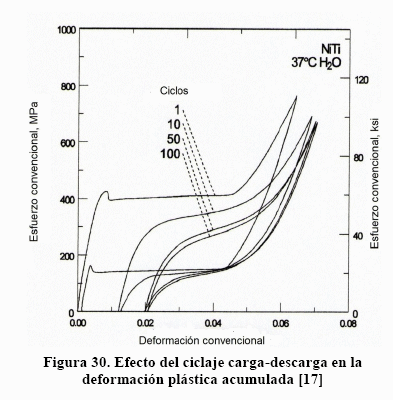
Al producirse la descarga, se inicia con la recuperación elástica, no lineal, de la martensita hasta el punto "C", donde con el esfuerzo sC se inicia el desmaclaje de la martensita, lo cual origina una reversión de la estructura, formándose austenita. Este proceso de desmaclaje mueve la intercara austenita/martensita dejando tras de sí austenita. El proceso de desmaclaje dura el todo el trayecto CD. A partir del punto "D", con el esfuerzo sD se inicia la recuperación elástica de la austenita. Si se observa con detenimiento, el punto de inicio y el punto final no coinciden, lo que significa que queda algo de deformación plástica. Es decir, el maclaje conduce a una pequeñísima deformación plástica. Esto puede verse en la Figura 30, donde el proceso carga-descarga se repitió 100 veces [17].
De la Figura 30 se desprenden dos aspectos de fatiga muy interesantes. Primero, hay un valor de saturación de deformación plástica, el cual es de 2%. Segundo, a medida que se suceden los ciclos, las curvas van descendiendo y se van cerrando, lo cual significa que no hay endurecimiento y que la cantidad de energía liberada es absorbida por la deformación plástica en un proceso de recuperación
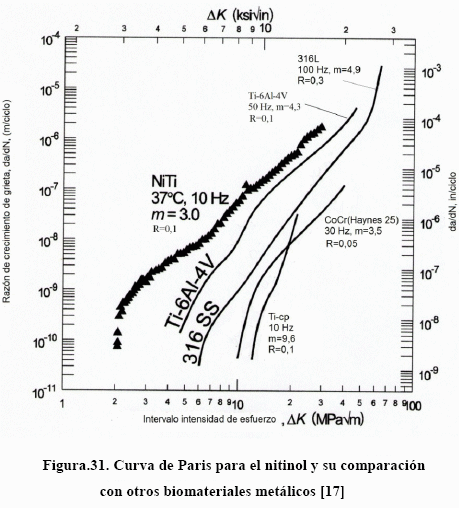
En la Figura 31 [17] se tiene la curva de Paris para el nitinol y se compara con varios biomateriales. El nitinol es el que presenta la menor frecuencia umbral, en tanto que el Ti-cp presenta la mayor. El nitinol presenta el menor exponente de París, mientras que el Ti-cp presenta el mayor exponente. Esto significa que si bien el nitinol requiere menos esfuerzos que el Ti-cp para iniciar el crecimiento de las grietas, éstas se propagan con menor velocidad que en el Ti-cp. Este valor de esfuerzo para el Ti-cp ha hecho que se esté popularizando su uso en ortopedia y traumatología como prótesis de hombro, osteosíntesis maxilofacial y de columna, placas para el cráneo, etc.
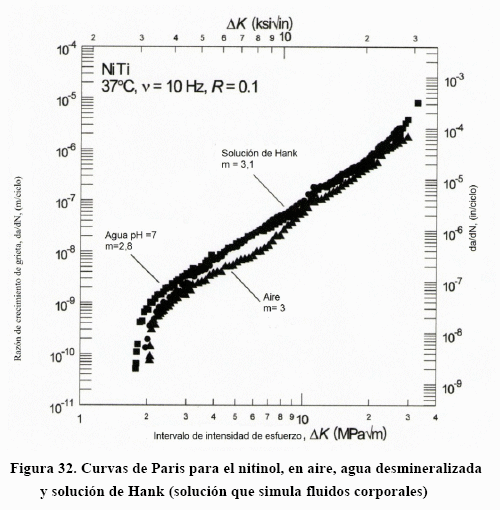
El nitinol presenta una ventaja muy importante, la cual es su comportamiento a fatiga muy similar, en el aire, en el agua neutra y frente a un medio que simula fluidos corporales (solución de Hank) (Fig.32) [17], y ésta, unida a su superelasticidad lo presenta como un elemento muy competitivo frente a los otros materiales metálicos. La osteosíntesis para reparación de fracturas óseas sería más simple y el proceso de curación más limpio. Su uso en alambres odontológicos, para el enderezado de piezas dentarias, también sería más efectivo que los alambres convencionales. Lo mismo puede decirse sobre los sistemas de fijación para la columna vertebral. Su uso en los "stents", dispositivos cilíndricos con superficie de malla, para la osteosíntesis en el sistema cardiovascular es de una valía extraordinaria, gracias a su superelasticidad que permite ajustes excelentes a temperatura corporal.
III. CONCLUSIONES
1. El titanio, y sus aleaciones, es un elemento que presenta una relación resistencia/peso alta, lo cual lo hace atractivo en muchas aplicaciones, entre las que destaca la aeronáutica.
2. Su resistencia a la corrosión, a la corrosión-fatiga en fluidos corporales, su biocompatibilidad y su osteointegración lo califican como un biomaterial de extraordinarias cualidades.
3. Este comportamiento está íntimamente relacionado con su estructura metalográfica y cristalográfica, al formar una variedad de estructuras en las aleaciones a + b. También el Ti-cp, monofásico a, como las aleaciones más complejas b están siendo desarrolladas y aplicadas exitosamente en el campo de la biomedicina y de la bioingeniería donde las condiciones de corrosión-fatiga son factores esenciales a considerar.
4. El nitinol, con su transformación martensítica inducida por esfuerzo, dándole propiedades de superelasticidad, se ofrece como un maravilloso biomaterial para la construcción de dispositivos para el tejido óseo y el sistema cardiovascular, que hacen las intervenciones quirúrgicas menos invasivas.
IV. REFERENCIAS
1. Mateo 9:6, 7,20-33; 11:5; 12:22; 14:35, 36; 15:28, 30,31 [ Links ]
2. Lucas 22:50,51
3. Ingeniería Biomédica, Wikipedia, la enciclopedia libre
4. El Pequeño Larousse Ilustrado, diccionario enciclopédico, USA, 1966, p.741
5. Cullity, B.D, Elements of X-Ray Diffraction, Addison-Wesley Publishing Company, Inc, USA, 1967, Appendix 13, p. 384.
6. Brick, R.M, Pense, A.W, Gordon, R.W, Structure and Properties of Engineering Materials, McGraw-Hill Kogakusha, Ltd, Tokyo, Japan, 1977, chapter 10, pp. 233-253.
7. ASTM Special Technical Publication (STP) 1272, Application of Titanium and its alloys: The Material and Biological Issues, Stanley A. Brown and Jack E. Lemons editors, Proceeding of Symposium held in 1994 in Phoenix, Arizona, USA.
8. Handbook of Material Properties of Titanium alloys, Welsh G., Boyer R., Collins, E.W., ASM, Ohio, USA, 1994.
9. ASM, Bulletin of Alloy Phase Diagram, Vol.2 N°.1, June 1981.
10. ASM, Bulletin of Alloy Phase Diagram, Vol.2 N°2, September 1981.
11. Gil, F.J., Planell, J.A., "Aplicaciones Biomédicas del Titanio y sus Aleaciones", Biomédica-Originales, Universidad Politécnica de Cataluña, España, 1991, pp. 34-42.
12. Seminario-Fiabilidad de los Materiales Aeronáuticos Estructurales: Aleaciones de Titanio, Propiedades y Aplicaciones. No hay más información.
13. Lütgering, G., Gysler, A., Titanium Science and Technology, Deutsche Gessellschaft für Metalkunde, Germany, 1985, p. 2068.
14. Starke, E.A and Lütgering, G., Cyclic Plastic Deformation and Microstructure, Fatigue and Microstructure, ASM, USA, 1979, p.237.
15. De Paz, Melini, F., "Propiedades del Titanio Usado en Cirugía Ortopédica"
16. Tokoji, K., Ogawa T., Shibata, H., ―The effect of Gas Nitriding on Fatigue Behaviour in Pure Titanium‖, Fatigue, vol.16, Japan, 1994, pp. 331-336.
17. Kelvey, A.L, Ritchie, R.O, ―Fatigue-Crack Propagation in nitinol, a Shape Memory and Superelastic Endovascular Stent Material‖, Journal of Biomedical Material Research, USA, January, 1999, 26 pp.












 uBio
uBio